抗保幼激素调控家蚕发育相关血液蛋白质组的初步分析
2012-09-11王廷良吴志平郑必平谈建中
王廷良 吴志平,2 郑必平 谈建中,3
(1苏州大学建筑与城市环境学院,江苏苏州 215123; 2江苏华佳丝绸有限公司,江苏吴江 215227;3苏州大学蚕桑研究所,江苏苏州 215123)
家蚕幼虫期的生长发育主要受蜕皮激素和保幼激素的调节控制[1],咽侧体分泌的保幼激素主要是维持幼虫形态,阻止幼虫变态发育,而前胸腺分泌的蜕皮激素则是促进幼虫蜕皮和变态,家蚕每个龄期的生长发育状态主要由这2种激素的相对浓度决定[2-3]。为了提高蚕丝经济产量或应用价值,许多学者就外源性保幼激素、蜕皮激素和抗保幼激素等在家蚕上的应用进行了探索,以期通过调控家蚕生长发育来生产超细纤度或超粗纤度的生丝,开拓蚕丝新用途[4-6]。
抗保幼激素(Anti-juvenile hormone,AJH)是一类能引起家蚕早熟变态的咪唑类化学物质,在家蚕幼虫的2龄、3龄或4龄的早期使用这类化合物,均能诱导家蚕早熟变态获得三眠蚕,生产细纤度的茧丝[7-8]。其诱导三眠蚕的作用机理在于抑制了咽侧体产生保幼激素或作为阻碍剂来阻止保幼激素生物合成,或是抑制了前胸腺的活性,使体液中蜕皮激素滴度峰延迟呈现,从而表现变态蜕皮[9-10]。本试验应用金鹿三眠素处理4龄饷食家蚕,用十二烷基硫酸纳-聚丙烯酰胺凝胶电泳(SDS-PAGE)和质谱技术,就AJH处理后家蚕血液中差异表达的蛋白质组分进行了分析与鉴定,以期在蛋白质水平上研究抗保幼激素对家蚕发育调控的作用机理。
1 材料与方法
1.1 供试材料
供试蚕品种:大造,二化性品种,由苏州大学蚕桑研究所司马杨虎教授提供;抗保幼激素:金鹿三眠素,由浙江大学动物科学学院陆雪芳教授提供。
1.2 三眠蚕的诱导方法
供试家蚕品种大造在1~3龄期间按常规方法饲养,4龄饷食时分区处理。试验设金鹿三眠素处理组(A)、清水对照组(CK)。抗保幼激素处理时,首先将金鹿三眠素配成质量浓度为400 g/L的水溶液,用喷雾器均匀喷湿桑叶的正反两面,稍晾干后于4龄饷食开始给桑,连续添食2 d。对照区用清水处理过的桑叶,连续添食2 d。添食结束后,改用常规桑叶(片叶)饲养,金鹿三眠素诱导处理组的三眠蚕率平均可达96%。
1.3 家蚕血液的采集
金鹿三眠素处理组于4龄饷食后48、72、96、120、144、168 h,清水对照组于 4 龄饷食后 48、72 h、熟蚕期等不同发育阶段分别采集雌蚕血液,并置于-70℃冰箱中保存备用。
1.4 血液蛋白质的提取
参照文献[11]的方法提取和定量分析家蚕血液蛋白质:取上述不同时期金鹿三眠素处理组和清水对照组的雌蚕血液,加入2.5倍体积的样品缓冲液(6 mol·L-1Urea、2 mol·L-1Thiourea、2%CHAPS、15 mmol·L-1DTT),加液氮研磨,使血细胞充分破碎,待溶解后于4℃、14 000 r/min条件下离心20 min;弃沉淀,取上清,于4℃、14 000 r/min条件下离心30 min;取上清,加3倍丙酮在-20℃下沉淀过夜;沉淀加样品缓冲液重悬后,取上清液蛋白质样品用Bradford法[11]测定蛋白质浓度,然后分装保存于-70℃备用。
1.5 血液蛋白质的SDS-PAGE
按照参考文献[12]的方法,配制丙烯酰胺浓度(体积比)分别为12%的分离胶和5%的浓缩胶;分别取金鹿三眠素处理组、清水对照组血液蛋白等量样品50μg进行SDS-PAGE;上样后,用恒定电流进行电泳,当溴酚蓝指示剂到达凝胶底部时停止电泳;电泳结束后,采用考马斯亮蓝染色2 h后,用脱色液脱色过夜,用扫描仪高精度扫描和比较凝胶图谱后,将凝胶置于洁净玻璃板上,切取差异性条带用于质谱分析[13]。
1.6 蛋白质胶内酶切与质谱分析
选取差异表达蛋白质条带,委托上海新科生命生物科技公司进行胶内酶切及质谱分析。
2 结果与分析
2.1 抗保幼激素诱导相关血液蛋白质的SDSPAGE分析
对金鹿三眠素处理组不同发育时期的血液蛋白质进行了SDS-PAGE分析,结果如图1所示,4龄饷食开始连续添食抗保幼激素后,检测到蛋白质群a(70 kD左右)与蛋白质群c(30 kD左右)的表达量逐渐增加,之后含量都维持在较高的水平,其中30 kD左右蛋白质组分的表达量最为丰富,70 kD蛋白质组分次之,而蛋白质群b的表达量则逐渐降低。其次,在4龄饷食后72 h(AH2)与48 h(AH1)之间检测到了明显差异表达蛋白的条带,从72 h开始出现了条带S1和S2,直到熟蚕时都保持着很高的表达量,但条带S4在72 h后开始消失。
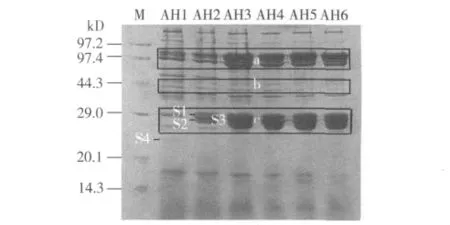
图1 金鹿三眠素诱导处理后4龄蚕血液蛋白质的SDS-PAGE图谱
2.2 抗保幼激素诱导处理组与对照组血液蛋白质SDS-PAGE比较分析
在上述分析的基础上,选取几个特殊发育阶段的血液蛋白质进行SDS-PAGE分析,结果在用抗保幼激素(金鹿三眠素)诱导处理组与对照组之间检测到了发育相关的差异表达蛋白 S1、S2、S3和S4(图2)。其中,条带S1和S2在处理组72 h(AH2)时开始出现,一直到熟蚕期都大量积累,而对照组在4龄期不存在这2个条带,直到熟蚕期才检测到大量积累。相似地,金鹿三眠素诱导处理组条带S3的表达量也高于对照组。其次,金鹿三眠素诱导处理组条带S4在72 h时(AH2)消失,而对照组(CH1、CH2)中条带S4比较明显,暗示差异条带S4可能含有与维持幼虫形态有关的蛋白质组分,而差异条带S1、S2、S3可能含有与家蚕变态发育(老熟结茧)调控有关的蛋白质组分。
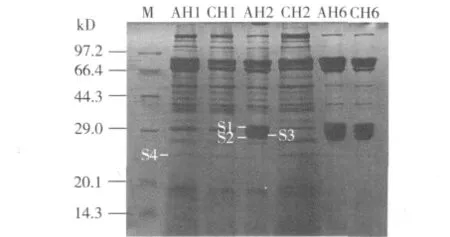
图2 金鹿三眠素诱导处理组与对照组血液蛋白质SDS-PAGE分析图谱
2.3 抗保幼激素诱导处理组与对照组血液蛋白质差异条带的MS分析
为研究三眠蚕血液差异性条带的蛋白质组分,从图2的1DE凝胶上切取条带S1、S2和S4(因S1、S2、和S3条带相距太近,为便于切胶操作,明确区分条带,故未取条带S3),经胶内酶切、质谱鉴定及Mascot检索进行分析,结果共获得了82个相匹配的候选蛋白质,剔除覆盖率较低(小于15%)的组分后,鉴定了其中的26个蛋白质组分,鉴定结果如表1。
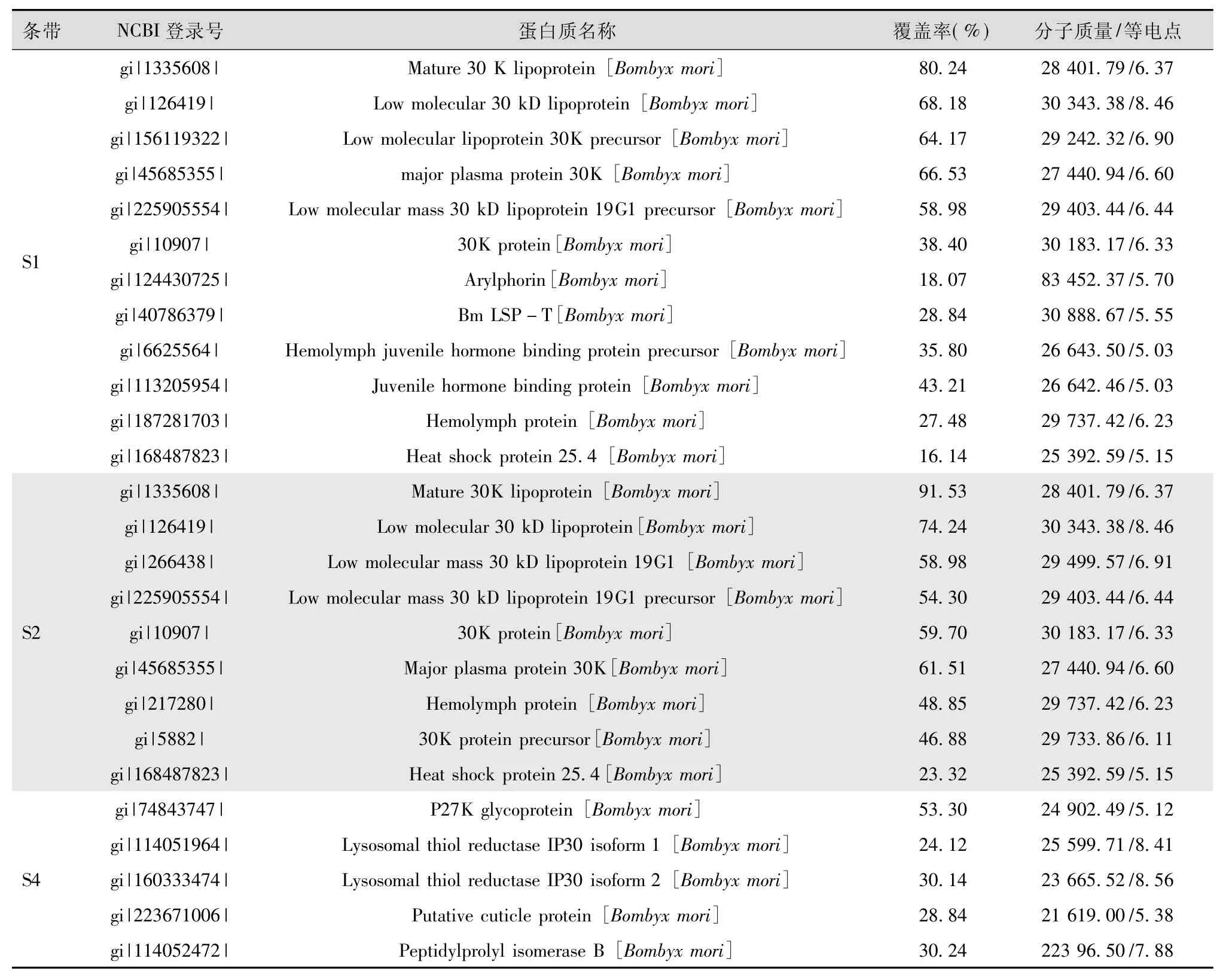
表1 三眠蚕血液差异蛋白质条带的MS/MS鉴定结果
在差异条带S1、S2中,鉴定得到了多种与生理代谢相关的功能蛋白质,其中30 kD蛋白家族的组分最多(表1)。业已清楚,大部分的30 kD蛋白基因活性从5龄第3天开始上升,5龄第4天到吐丝期活性持续提高,随后迅速下降,化蛹时完全消失,其功能可能涉及到脂肪酸的转运、胚胎发育、细胞程序化死亡及血浆天然免疫反应等[14]。另一组分家蚕幼虫血清蛋白BmLSP,分子质量约为30 kD,具有免疫、转运与贮藏等生理功能,具有发育与组织特异性表达的特征[15]。本研究在家蚕4龄饷食时开始用抗保幼激素金鹿三眠素进行诱导处理,结果在4龄第3天(72 h)即检测到了30 kD蛋白的大量表达,而对照组此时未见明显变化。
保幼激素结合蛋白(Juvenile hormone binding protein)是存在于血淋巴和细胞内的一种特异载体蛋白,与保幼激素结合后保护保幼激素不被酶降解,并将它运送到作用部位,参与家蚕发育的调控过程[16]。芳基贮存蛋白(Arylphorin)是一种富含苯丙氨酸和酪氨酸等芳香族氨基酸的蛋白[16],在幼虫摄食期的脂肪体中合成旺盛,分泌到血液中,化蛹时,又几乎全部再被脂肪体摄取并积聚于脂肪体细胞的蛋白质颗粒中,其主要功能是在幼虫蜕皮及变态中作为主要的氨基酸供源,用于体内组织的形成和生殖的需要[17]。
热激蛋白25.4属于小热休克蛋白家族,小分子热休克蛋白的主要功能是与其他蛋白进行相互作用,从而使信号转导、新陈代谢、转录、翻译等生命过程中的各种细胞蛋白保持稳定。前人研究发现热休克蛋白25.4主要存在于家蚕5龄幼虫脂肪体和血液组织中[18],本试验在抗保幼激素金鹿三眠素诱导处理组4龄蚕的血液蛋白质中就已检测到了热休克蛋白25.4,说明用抗保幼激素处理的家蚕表现出了5龄期的性状。
从条带S4中鉴定得到的蛋白质还包括了溶酶体硫醇还原酶IP30前体1型和2型,家蚕中有关这种酶的研究目前还比较少,蔡克亚等[19]分析了家蚕抗核型多角体病毒(BmNPV)抗性品系与感性品系血淋巴液蛋白质组的差异,发现溶酶体硫醇还原酶IP30前体1型存在于感性品种中,而在高抗品系中没有检测到。本试验中发现用抗保幼激素处理过的家蚕,S4条带在处理后72 h消失,但对其功能了解尚少。
此外,从家蚕血液总蛋白中还鉴定到了其他14种蛋白(覆盖率小于15%),推测这些蛋白的表达量相对较低。如胰凝乳蛋白酶抑制剂(Chymotrypsin inhibitor CI-8A)、14-3-3 ε 蛋白(14-3-3 epsilon protein)、酪氨酸3-单加氧酶/色氨酸5-活化蛋白 ε多肽(Tyrosine 3-monooxygenase/tryptophan 5-monooxygenase activation protein epsilon polypeptide)、性别特异性储藏蛋白SP1(Sex-specific storage-protein SP1)、丝氨酸蛋白酶前体(Serine protease precursor)、类丝氨酸蛋白酶(Scolexin)、类几丁质 EN03(Chitinase-like protein EN03)、成虫原基生长因子(Imaginal disk growth factor)、类 IDGF蛋白(IDGF like protein)、围脂滴蛋白(Perilipin)、转铁蛋白(Transferrin)、同源异型盒蛋白(Homeobox protein)、突触融合蛋白(Syntaxin)、线粒体磷酸烯醇式羧激酶亚型2(Mitochondrial phosphoenolpyruvate carboxykinase isoform 2),这些蛋白质分别参与了不同的生理代谢。如胰凝乳蛋白酶抑制剂属于丝氨酸蛋白酶抑制剂的一种,在家蚕体内主要对蛋白酶的活性进行调控,维持昆虫正常的生理功能[20];类丝氨酸蛋白酶是一种昆虫免疫蛋白,为应对外来细菌或病毒的入侵而在体内产生的一种能引起凝血的血浆蛋白[21];围脂滴蛋白是脂滴相关蛋白家族的核心成员之一,是定位于脂滴表面的高磷酸化蛋白,对脂肪组织中甘油三脂代谢有双重调节作用[22];转铁蛋白是控制生物体液中自由铁含量的铁结合血浆糖蛋白[23];突触融合蛋白是参与胞吐作用的一组细胞膜结合Q-SNARE蛋白的蛋白质家族[24]。
3 讨论
用抗保幼激素类药物处理家蚕,可使普通四眠蚕变为三眠蚕。吴金美等[25]研究认为,KK-42应用于家蚕4龄前期时,靶细胞器官首先是咽侧体,咽侧体合成活性的变化反馈到脑,使脑分泌的PTTH发生相应变化,使得抗保幼激素处理组第3天家蚕体内蜕皮激素的浓度降低,促使蜕皮激素高峰的延迟,而对照组此时的蜕皮激素浓度维持在一个较高的浓度。由于蜕皮激素峰值的延迟、同时保幼激素相对馈乏,两者共同作用引起了家蚕化蛹蜕皮,从而由四眠蚕形成三眠蚕。
本试验用抗保幼激素类物(金鹿三眠素)在4龄饷食后48 h内对家蚕品种大造进行处理,应用单向凝胶电泳与质谱技术,分析了抗保幼激素作用相关的差异蛋白质组分,结果从血液蛋白质的SDSPAGE中检测到了差异表达的蛋白质,对具有表达差异蛋白条带进行了质谱鉴定,结果检测到了多种30 kD蛋白组分。一般认为,家蚕从蚁蚕至4龄末期的血液中都检测不到30 kD蛋白的表达,大部分的30 kD蛋白基因活性从5龄第3天开始上升,5龄第4天开始到吐丝期活性持续提高,随后迅速下降,化蛹时完全消失[14]。通过手术摘除家蚕幼虫咽侧体,家蚕血浆中30 kD蛋白的表达量会迅速上升[14];随着5龄初期家蚕体内保幼激素浓度的下降,30 kD蛋白在血浆中的浓度确有升高,由此认为,30 kD蛋白在脂肪体内的生物合成可能受到保幼激素的影响[14]。
本研究在家蚕4龄饷食时开始用抗保幼激素进行处理,在4龄第3天(72 h)即检测到了30 kD蛋白的大量表达,而对照组此时未见明显变化,推测用抗保幼激素处理4龄家蚕可能抑制了咽侧体分泌保幼激素,使保幼激素浓度进入一个低水平时期,提前启动了30 kD蛋白相关基因的表达,从而使家蚕进入变态发育阶段。据此推测,30 kD蛋白可以为研究保幼激素调控基因表达提供一个模式系统。
条带S1中还含有家蚕幼虫血清蛋白BmLSP,分子质量约为30 kD,在幼虫脂肪体细胞内合成,具有组织特异性,以及免疫、转运与贮藏等生理功能。免疫和转运功能的血清蛋白在发育过程中维持恒定的水平,而作为贮藏功能的血清蛋白随着发育阶段不同呈现有规律的变化,为昆虫蜕皮或变态提供能量或原料[15]。研究发现,BmLSP从蚁蚕开始至5龄第3天之前各个龄期食桑阶段均有转录表达,每个龄期的初期表达量较高,在4龄眠中有微弱表达,5龄饷食后BmLSP mRNA虽有转录,但是转录水平急剧下降,到第3天已检测不出,熟蚕时完全消失,在蛹期和成虫期也未检测到BmLSP mRNA[15]。本研究用抗保幼激素处理后,在4龄第3天(72 h)仍检测到BmLSP的表达,这与JH在幼虫5龄初期的表达变化相似,推测BmLSP可能是承担保幼功能蛋白质中的一员[26],但对其诱导家蚕早熟变态的具体作用机理还有待进一步研究。
[1]徐豫松,徐俊良.昆虫保幼激素研究新进展[J].中国蚕业,2001,22(1):56 -57.
[2]缪云根,江丽军.抗保幼激素与蜕皮激素对蚕生长发育及咽侧体和前胸腺超微形态的影响[J].蚕业科学,1998,24(1):39 -43.
[3]Kinjoh T,Kaneko Y,Itoyama K,et al.Control of juvenile hormone biosynthesis inBombyx mori:cloning of the enzymes in the mevalonate pathway and assessment of their developmental expression in the corpora allata[J].Insect Biochemistry and Molecular Biology,2007,37(8):808 -818.
[4]Tsubouchi K,Akahane T,Imai T.High strength silk fiber obtained from super finefilament of silkworm cocoon treated with bioactive substances[J].Japan Agricultural Research Quarterly,1997,31(2):133 -136.
[5]Kamimura M,Shimura S,Kiuchi M.Simple manipulation of silkworm molting by an artificial diet containing plant-derived 20-hydroxyecdysone[J].Journal of Insect Biotechnology and Sericology,2003,72(3):197 -201.
[6]Kamimura M,Kiuchi M.Effects of a juvenile hormone analog,fenoxycarb,on 5th stadium larvae of the silkworm,Bombyx mori(Lepidoptera:Bombycidae) [J].Applied Entomology and Zoology,1998,33(2):333-338.
[7]缪云根,江丽军.抗保幼激素的研究概况[J].中国蚕业,1998,19(2):8-10.
[8]Gu SH,Chow Y S.Analysis of precocious metamorphosis induced by application of an imidazole derivative to early third instar larvae of the silkworm,Bombyx mori[J].Archives of Insect Biochemistry and Physiology,1997,36:349 -361.
[9]桑野荣.抗保幼激素活性物质研究的最新进展[J].植物防疫,1987,41(8):32 -37.
[10]顾世红,申屠仁华.咪唑在决定家蚕发育中的效果[J].国外农学—蚕业,1994,(3):30 -32.
[11]刘艳艳.家蚕幼虫期和蛹期发育相关蛋白质组的研究[D].苏州:苏州大学,2009.
[12]Laemmli UK.Cleavage of structural proteins during theassembly of the head of bacteriophage T4 [J].Nature,1970,227:680 -685.
[13]刘艳艳,池旭娟,谈建中,等.家蚕蚁蚕蛋白质组的质谱鉴定与数据库构建[J].蚕业科学,2008,34(4):676 -683.
[14]杨捷频.家蚕30K蛋白的结构功能及五龄血浆蛋白质组学研究[D].合肥:中国科学技术大学,2011.
[15]邓党军.家蚕脂肪体特异启动子BmLSP、BmLP3的克隆、鉴定及应用[D].重庆:西南大学,2011.
[16]Zheng W H,Li Q J,Gong H.Juvenile hormone binding protein in the ovaries of housefly musca domestica vacina[J].Entomologia Sinica,1994,1(4):339-345.
[17]永田昌男,小林正彦.家蚕幼虫发育中贮藏蛋白质的含量变化[J].王彦文,译.蚕学通讯,1994(1):48 -52.
[18]夏佳音.家蚕小热休克蛋白BmHSP25.4基因的克隆、表达及其细胞定位[D].杭州:浙江理工大学,2008.
[19]蔡克亚,陈克平,刘晓勇,等.家蚕抗BmNPV品系与感性品系血淋巴液蛋白质组的差异分析[J].生物工程学报,2008,24(2):285-290.
[20]赵萍.家蚕丝氨酸蛋白酶抑制剂研究[D].重庆:西南大学,2008.
[21]Finnerty CM,Karplus P A,Granados R R.The insect immune protein scolexin is a novel serine proteinase homolog[J].Protein Science,1999,8(1):242-248.
[22]张利红,张立杰,杨公社.一种调控脂解的重要蛋白—围脂滴蛋白(Perilipin)[J].中国生物化学与分子生物学报,2006,22(12):931-934.
[23]Crichton R R,Charloteaux W M.Iron transport and storage[J].European Journal of Biochemistry,1987,164(3):485-506.
[24]Bennett M K,García JE,Elferink L A,et al.The syntax in family of vesicular transport receptors[J].Cell,1993,74(5):863 -873.
[25]吴金美,吴载德.三眠蚕诱导剂咪唑类物质KK-42对桑蚕内分泌系统的作用[J].昆虫学报,1991,34(3):278 -282.
[26]Fuijiwara Y,Yamashita O.Purification,characterization and changes in the titer of a new larval serum protein of the silkworm,Bombyx mori[J].Insect Biochemistry,1990,20(7):751 – 759.
