生产倍半碳酸钠的相图分析
2012-09-08尹小春丁珊修
尹小春,丁珊修
(1.青岛海湾设计研究院,山东 青岛 2 6 6 0 4 3;2.青岛碱业股份有限公司,山东 青岛 2 6 6 0 4 3)
专论与综述
生产倍半碳酸钠的相图分析
尹小春1,丁珊修2
(1.青岛海湾设计研究院,山东 青岛 2 6 6 0 4 3;2.青岛碱业股份有限公司,山东 青岛 2 6 6 0 4 3)
详细介绍了用纯碱和小苏打生产倍半碳酸钠的理论基础,绘制了N a2C O3-N a HC O3-H2O三元体系常用温度范围内的相图,并计算了倍半碳酸钠生产过程的物料平衡,对生产过程具有指导意义。
倍半碳酸钠;溶解度;三元体系相图
倍半碳酸钠又名碳酸钠盐(2∶3)、碳酸氢三钠、碳酸钠碳酸氢钠二水合物,英文名S O D I UM S E SQU I C AR B ONAT E D I HY D R AT E。倍半碳酸钠是白色针状或片状结晶或结晶性粉末,相对密度2.1 1 2,易溶于水及酸,水溶液呈强碱性,但较碳酸钠弱;分子式为N a2C O3·N a HC O3·2 H2O,分子量2 2 6;C A S号5 3 3-9 6-0。倍半碳酸钠是一种新型浴剂和洗涤剂。
倍半碳酸钠可以用天然碱石加工获得。本文介绍一种用纯度较高的纯碱和小苏打制造高品质倍半碳酸钠的方法。
1 N a2C O3-N a HC O3-H2O三元体系相图
表1是N a2C O3-N a HC O3-H2O三元体系不同温度下的溶解度数据[1]。
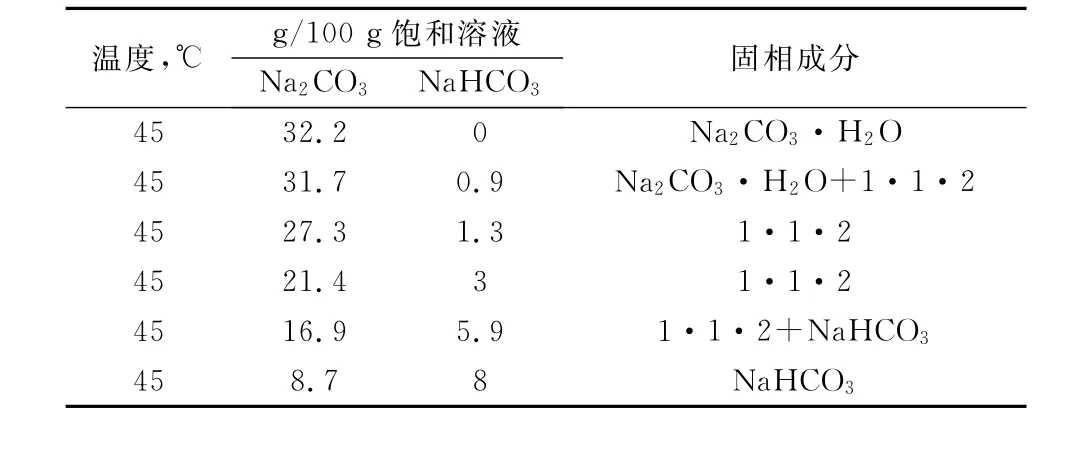
表1 N a2C O3-N a H C O3-H2O溶解度数据

(续表)
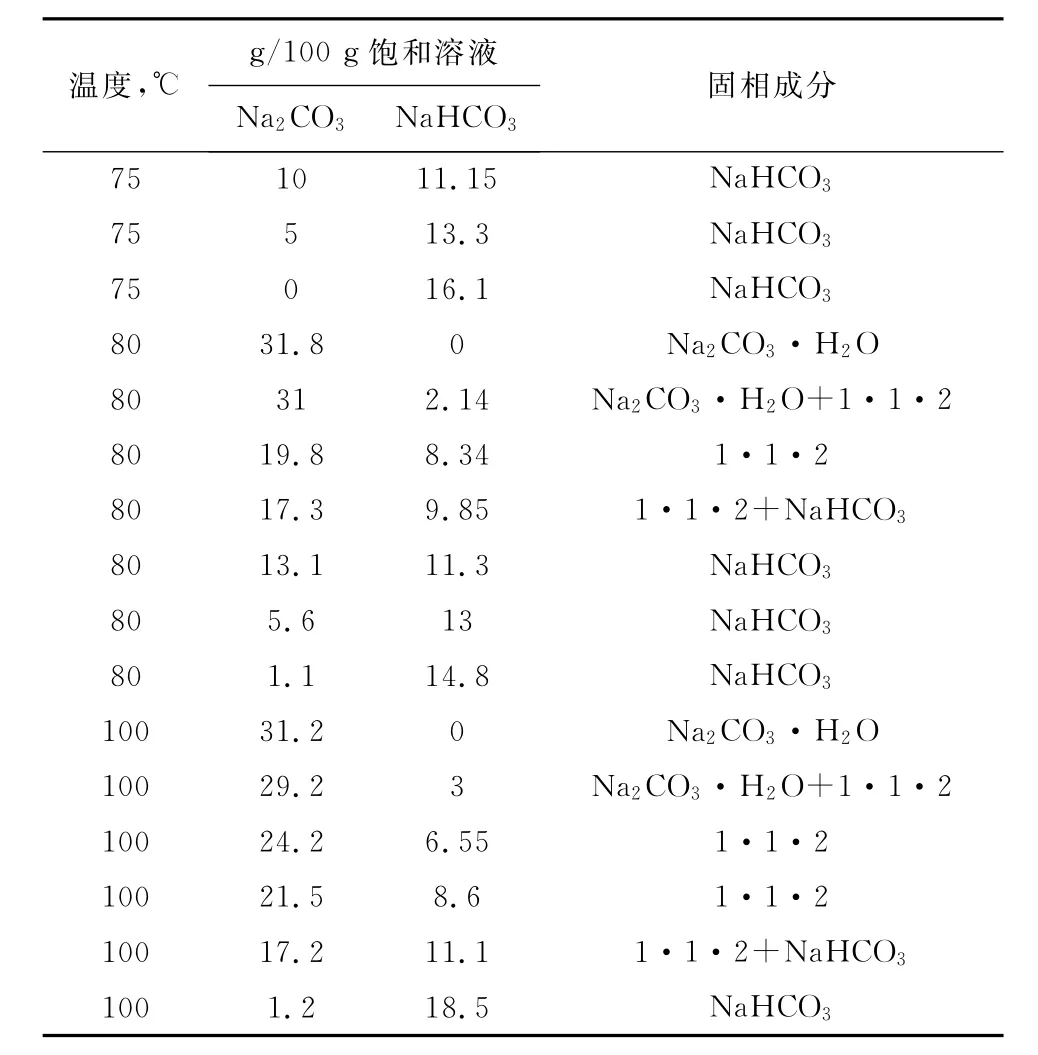
(续表)
笔者将以上数据绘制成等边三角形相图,分别示于图1~图6 。

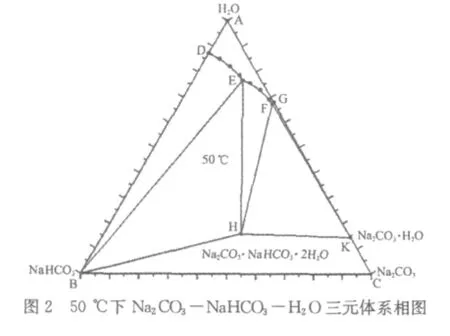
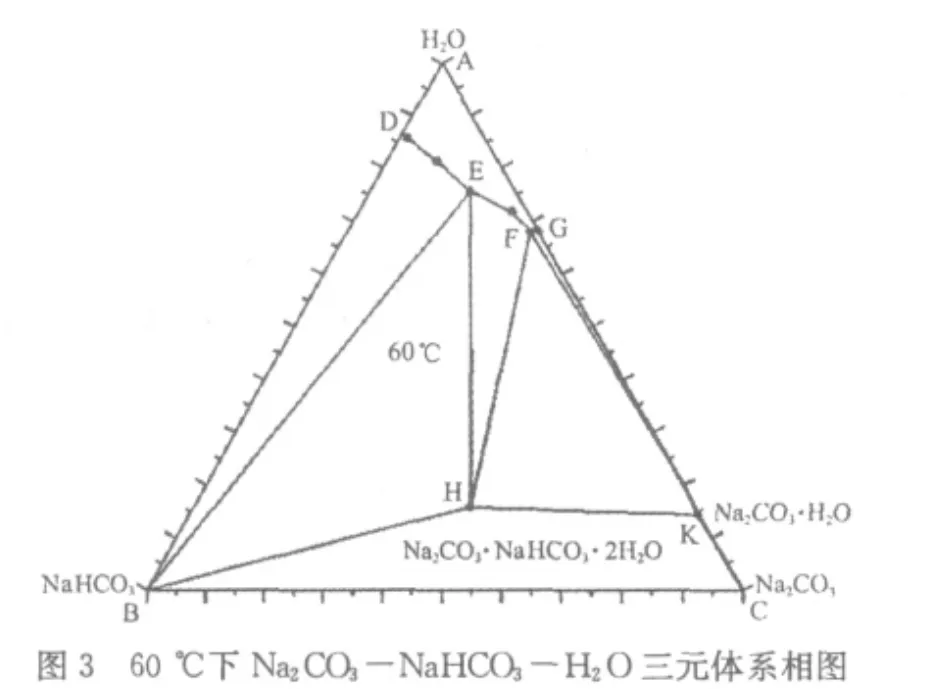

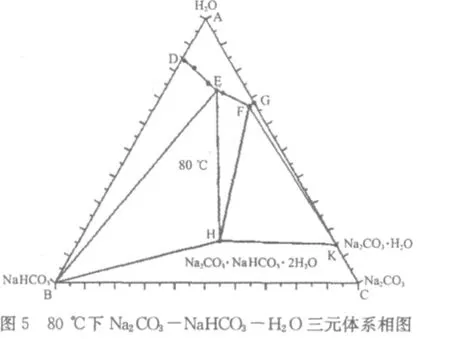
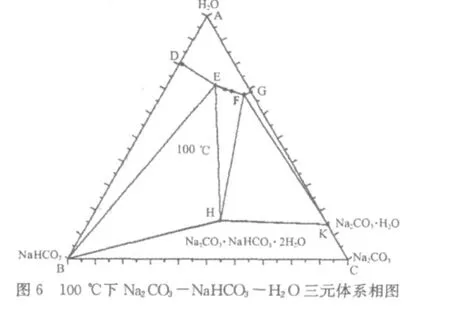
从图1~图6可以看出,在4 5℃~1 0 0℃范围内,N a2C O3-N a HC O3-H2O三元体系可能结晶出水合盐即一水碱N a2C O3·H2O或水合复盐即倍半碳酸钠N a2C O3·N a HC O3·2 H2O。
我们以6 0℃下N a2C O3-N a HC O3-H2O三元体系相图为例(图3),对这一体系的相图进行分析。
三角形的三个顶点A、B、C分别代表三种纯物质:水H2O、小苏打N a HC O3、纯碱N a2C O3。H点代表倍半碳酸钠N a2C O3·N a HC O3·2 H2O;K点代表一水碱N a2C O3·H2O。
D点是纯小苏打在纯水中的溶解度,G点是一水碱在纯水中的溶解度。E点是小苏打和倍半碳酸钠在三元体系中的共饱和点;F点是一水碱和倍半碳酸钠在三元体系中的共饱和点。
曲线D E是纯小苏打在三元体系中的溶解度线;曲线E F是倍半碳酸钠在三元体系中的溶解度线;曲线F G是一水碱在三元体系中的溶解度线。
区域A D E F GA是液相区,系统总组分落在该区域内时,体系只有液相,没有固相析出。区域D B E D是小苏打的结晶区,系统总组分落在该区域内时,固相为小苏打N a HC O3,液相为D E曲线上的某一点,该点就是体系总组分点与B点连接的直线延长至与D E曲线相交的那个点。区域E BHE是小苏打和倍半碳酸钠共饱和结晶区,系统总组分落在该区域内时,固相为小苏打N a HC O3和倍半碳酸钠N a2C O3·N a HC O3·2 H2O的混合物,液相总为E点不变,固相中小苏打和倍半碳酸钠的百分含量随体系总组分的变化而变化。区域EHF E是倍半碳酸钠的结晶区,系统总组分落在该区域内时,固相为倍半碳酸钠N a2C O3·N a HC O3·2 H2O,液相为E F曲线上的某一点,该点就是体系总组分点与H点连接的直线延长至与E F曲线相交的那个点。区域FHK F是一水碱和倍半碳酸钠共饱和结晶区,系统总组分落在该区域内时,固相为一水碱N a2C O3·H2O和倍半碳酸钠N a2C O3·N a HC O3·2 H2O的混合物,液相总为F点不变,固相中一水碱和倍半碳酸钠的百分含量随体系总组分的变化而变化。区域F KG F是一水碱的结晶区,系统总组分落在该区域内时,固相为一水碱N a2C O3·H2O,液相为F G曲线上的某一点,该点就是体系总组分点与C点连接的直线延长至与F G曲线相交的那个点。区域BHK C B是固体小苏打、固体倍半碳酸钠、固体一水碱、固体纯碱的混合区域,由于是固体物质的简单混合,没有相平衡,所以在相图上,这一区域没有意义。
相图中没有纯碱的溶解度曲线,只有其水合盐一水碱的溶解度曲线,说明一水碱是Ⅰ型水合物;复盐射线AH与H点的溶解度曲线E F不相交,说明倍半碳酸钠是异成分复盐[2]。
从相图中还可以看出,温度由4 5℃变化到1 0 0℃,液相区A D E F GA变化并不明显。所以,用纯碱和小苏打生产倍半碳酸钠不宜采用高温下制成饱和溶液,低温下结晶的传统方法,因为液相区变化小,意味着每次升温、降温后,单位体积的母液获得的产品较少。
2 倍半碳酸钠生产流程
笔者根据相图原理,设计一个用纯碱、小苏打生产倍半碳酸钠的流程。在恒温条件下,通过不断添加纯碱、小苏打,就可以不断从母液中取出倍半碳酸钠产品。
2.1 生产过程在相图上的表述
考虑母液加热和保温的难易程度,选择生产温度为6 0℃。
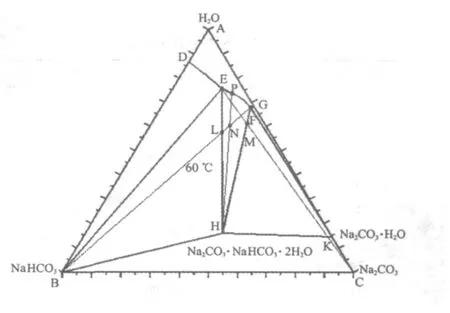
图7 生产过程相图描述
第一步,我们将母液配制到F点,这是母液中纯碱含量能达到的最大值。如果在F点母液中再加纯碱,就会有一水碱和倍半碳酸钠的混合物析出。

第三步,从体系中分离出固相H,系统的总组成点变为液相E点。
第四步,往E点母液中逐渐加入纯碱,纯碱会完全溶解,倍半碳酸钠逐渐析出,液相成分由E点向F点方向沿曲线E F移动。体系的总组成点将沿直线E C向C点移动,到M点,停止加纯碱,分离出固相H,系统的总组成点恢复为液相F点,可循环再进行第一步。分别控制好纯碱和小苏打的加入量,维持母液平衡,就可以不断地得到产品倍半碳酸钠。
2.2 物料平衡
在以下的计算中,我们假设所有的物料为1 0 0 %纯净,假设固液分离不损失母液。图7中各点的组成和有关直线段的长度列于表2、表3。
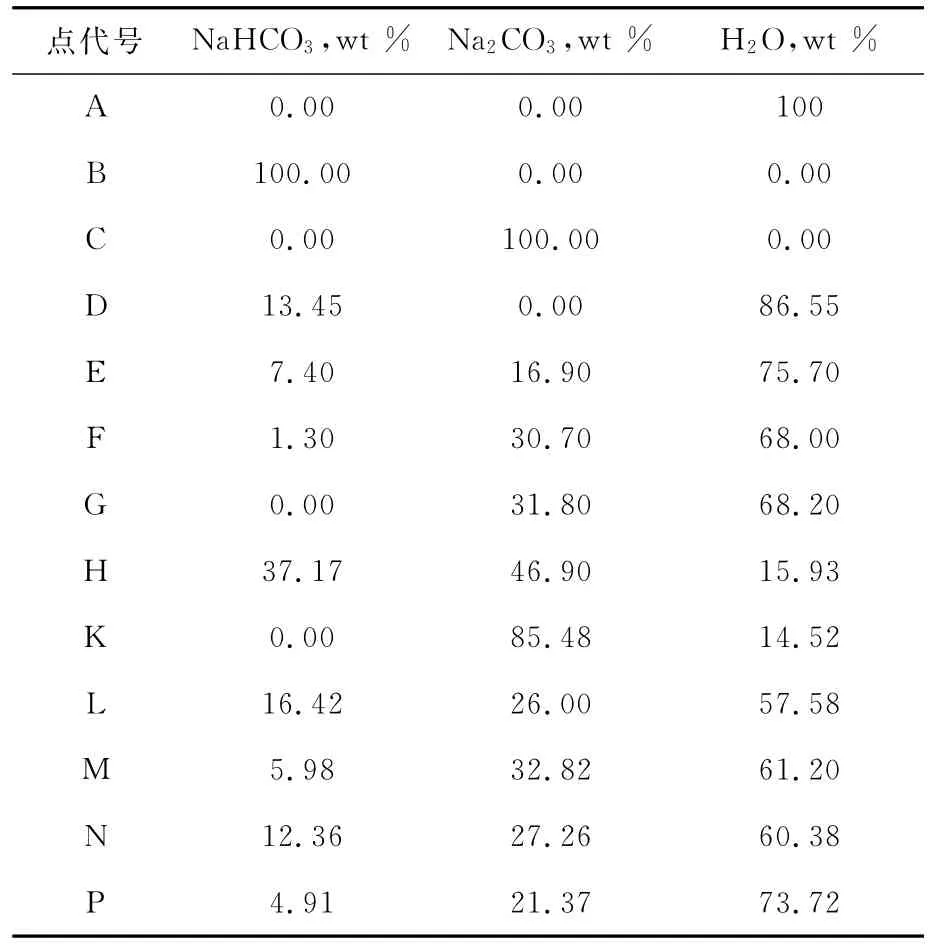
表2 图7中各点组成
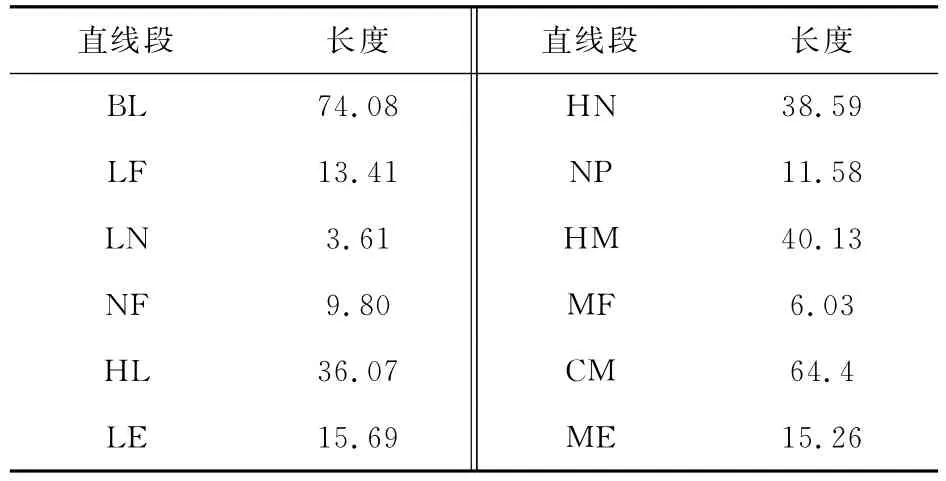
表3 图7中各直线段长度
以1 0 0 0k g组成为F点的母液作为计算基准。
1)F点母液配制所需各组分量
根据F点的成分,将1 3k g小苏打、3 0 7k g纯碱加入6 8 0k g水中,溶解后即得到1 0 0 0k g组成为F点的母液。
2)F中加入小苏打量
由杠杆规则:

WB=1 0 0 0×1 3.4 1/7 4.0 8=1 8 1.0 2k g,即往母液F中加入小苏打1 8 1.0 2k g,体系总质量为1 1 8 1.0 2k g。
3)加小苏打后分离出倍半碳酸钠量
解下列方程:
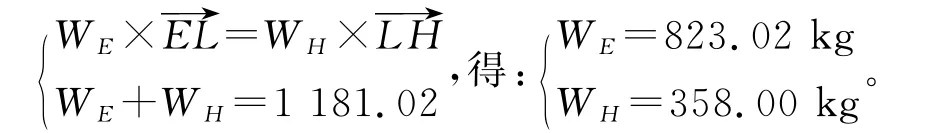
第一次结晶可析出倍半碳酸钠3 5 8k g,得到母液E 8 2 3.0 2k g。
4)E中加入纯碱量
由杠杆规则:
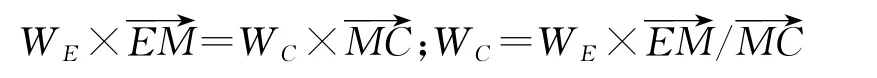
WC=8 2 3.0 2×1 5.2 6/6 4.4=1 9 5.0 2k g,即往母液E中加入纯碱1 9 5.0 2k g,体系总质量为8 2 3.0 2+1 9 5.0 2=1 0 1 8.0 4k g。
5)加纯碱后分离出倍半碳酸钠量
解下列方程:

第二次结晶可析出倍半碳酸钠1 3 2.9 9k g,得到母液F 8 8 5.0 5k g。经过一次循环后,母液F萎缩了1 0 0 0-8 8 5.0 5=1 1 4.9 5k g。这是正常的,因为加入的是无水的小苏打和纯碱,而产品倍半碳酸钠中含两分子水。下一次循环要补充母液F 1 1 4.9 5k g,以保证第二次循环产量不变。
6)计算结果
可见,1 0 0 0k g母液F经过一次循环,加入小苏打1 8 1.0 2k g;加入纯碱1 9 5.0 2k g;萎缩母液F 1 1 4.9 5k g;得到产品倍半碳酸钠3 5 8+1 3 2.9 9=4 9 0.9 9k g。在计算误差范围内,1 8 1.0 2+1 9 5.0 2+1 1 4.9 5≈4 9 0.9 9k g。
小苏打收入量:
1 8 1.0 2+1 1 4.9 5×1.3 0%=1 8 2.5 1k g。
纯碱收入量:
1 9 5.0 2+1 1 4.9 5×3 0.7 0%=2 3 0.3 1k g。
水分收入量:
1 1 4.9 5×6 8%=7 8.1 7k g。
小苏打支出量:
4 9 0.9 9×3 7.1 7%=1 8 2.5 0k g。
纯碱支出量:
4 9 0.9 9×4 6.9 0%=2 3 0.2 7k g。
水分支出量:
4 9 0.9 9×1 5.9 3%=7 8.2 2k g。
各组分收入和支出量都在误差范围内,说明物料是平衡的。
7)N点的情况

[1] 吕秉玲,林志祥.纯碱生产相图分析[M].北京:化学工业出版社,1 9 9 1
[2] 牛自得,程芳琴,李宝存,陈侠.水盐体系相图及其应用[M].天津:天津大学出版社,2 0 0 2
T Q 1 1 4.1
C
1 0 0 5-8 3 7 0(2 0 1 2)0 5-0 3-0 5
2 0 1 2-0 2-2 4
尹小春,1 9 8 9年毕业于上海华东理工大学化学工程专业。注册化工师,青岛海湾设计研究院院长,主要从事设计工作。
