吸附剂对豆浆中嘌呤物质的吸附
2012-09-07毛玉涛王明力
毛玉涛 王明力 张 洪 和 岳
(1.贵州大学化学与化工学院,贵州 贵阳 550003;2.贵州省发酵工程与生物制药重点实验室,贵州 贵阳 550003;3.贵州大学喀斯特山地果树研究所,贵州 贵阳 550003)
豆浆中含有丰富的植物蛋白,磷脂,维生素B1、B2,烟酸和铁、钙等矿物质[1],长期以来备受国人青睐,被誉为21世纪“餐桌明星”,在欧美享有“植物奶”的美誉[2]。尽管豆浆和豆制品属于高营养低价位的食物,但患有消化性溃疡和痛风病的患者[3]却因大豆中嘌呤含量较高(180mg/100g左右)而不宜长期食用[4,5],因为嘌呤有促进胃液分泌的作用,且在人体内最终代谢为尿酸,若嘌呤代谢紊乱使得过多尿酸沉积在体内就会引起痛风及其并发症。因此去除豆浆中的嘌呤类物质,使其适合特殊人群食用,具有重要的研究意义。
嘌呤是一类带碱性有两个相邻碳氮环的含氮有机大分子物质,含有极性基团,可被某些吸附剂作用[6]。食品工业中常见的吸附剂有硅藻土、活性炭、沸石、壳聚糖和分子筛等。前人[7-9]曾分别成功应用活性炭和壳聚糖吸附饲料和啤酒中的嘌呤类物质,取得了较为显著的成果。但是对于豆浆中嘌呤物质脱除的研究却未见报道。本试验比较了不同的吸附剂对嘌呤物质的吸附性能,筛选出效果最佳的吸附剂,并深入研究其对豆浆中嘌呤类物质的吸附效果。
1 材料与方法
1.1 材料与仪器
黄豆:产地安徽蚌埠;
腺嘌呤标样、鸟嘌呤标样、黄嘌呤标样、次黄嘌呤标样:色谱纯,鼎国生化试剂有限公司;
食品级硅胶、硅藻土、尼龙66(聚己二酰己二胺)、PVPP(交联聚维酮)、活性炭、壳聚糖、分子筛及人造沸石:天津市科密欧化学试剂开发中心;
甲酸、三氟乙酸、氢氧化钾、磷酸:分析纯,天津市光复精细化工研究所;
甲醇、异丙醇:色谱纯,天津市登科化学试剂有限公司;
高效液相色谱仪:Agilent 1100,美国 Applied Biosystems公司;
超声波清洗器:SG2200HPT,上海冠特超声仪器有限公司;
豆浆机:JYL-B050,九阳豆浆机有限公司;
恒温磁力搅拌器:CJJ-781,江苏省金坛市恒丰仪器厂;
电子精密天平:AL204,奥豪斯仪器有限公司;
精密酸度计:PHS-25B,上海大普仪器有限公司;
数显恒温水浴锅:DF-101S,金坛市正基仪器有限公司;
离心机:TDL-40B型,上海安亭科学仪器厂。
1.2 试验方法
1.2.1 吸附剂的筛选 分别精确称量50mg腺嘌呤、鸟嘌呤、黄嘌呤和次黄嘌呤标准品溶于溶于1 000mL 0.1mol/L的盐酸溶液中,取上述各溶液100mL,加入100mg吸附剂,振荡均匀,静置一定时间,过滤,比较不同吸附剂对4种嘌呤物质的吸附效果。选出效果最佳的吸附剂对豆浆进行嘌呤吸附的研究。
1.2.2 豆浆中嘌呤物质的脱除工艺 取50mL研磨好的豆浆于100mL烧瓶中,加入一定量的吸附剂,搅拌均匀,在一定的pH下吸附一段时间,冷却后离心(2 500r/min),过滤,待分析。
分别考察吸附剂添加量、吸附时间、吸附温度及反应pH值对豆浆嘌呤物质吸附率的影响,并通过正交试验优化工艺条件。
1.2.3 分析方法 利用高效液相色谱[10,11]对豆浆中嘌呤的含量进行测定。色谱分离条件:Zorbax C18反相柱(4.6mm×250mm,5.0μm)色谱柱,以0.02mol/L磷酸二氢钾缓冲液(pH 3.6)作为流动相,流速0.8mL/min,柱温25℃,进样量10μL,检测波长 (λ1)为254nm[11,12]。
取10mL样品于50mL烧瓶中,加入10mL三氟乙酸与甲酸1∶1的混合液,在98~101℃油浴锅中水解1h,然后冰浴冷却,并用15mol/L KOH溶液中和,直至pH调至7,再用H3PO4调pH至3,定容至50mL,用0.22μm滤膜过滤,在254nm波长处测定,根据标准曲线求出嘌呤的含量[13-16]。
根据 GB 5009.5——2010《食品中蛋白质测定方法》,利用半微量凯氏定氮法分别对吸附处理前后的豆浆进行蛋白质含量的测定,并与QB/T 2132——2008《植物蛋白饮料 豆奶(豆浆)和豆奶饮料》标准进行对照。
1.2.4 嘌呤吸附率的计算 据报道[3]大豆中含腺嘌呤0.732 3mg/g,鸟嘌呤0.821 2mg/g,黄嘌呤0.020 2mg/g,次黄嘌呤0.031 8mg/g。由此可见大豆中的嘌呤物质主要以腺嘌呤和鸟嘌呤为主,黄嘌呤和次黄嘌呤的含量微乎极微,因此本试验主要考察处理前后腺嘌呤和鸟嘌呤的含量变化。
吸附处理前后腺嘌呤和鸟嘌呤含量总和的变化量称为嘌呤吸附率。根据样品中腺嘌呤和鸟嘌呤的峰面积,从标准曲线上查出其浓度,豆浆中嘌呤物质的吸附率按式(1)计算:

式中:
X——豆浆中嘌呤物质的吸附率,%;
C0—— 处理前豆浆中嘌呤的浓度,mg/mL;
C——处理后豆浆中嘌呤的浓度,mg/mL。
2 结果与讨论
2.1 不同吸附剂对4种嘌呤的吸附结果
8种吸附剂对4种嘌呤的吸附效果见表1。
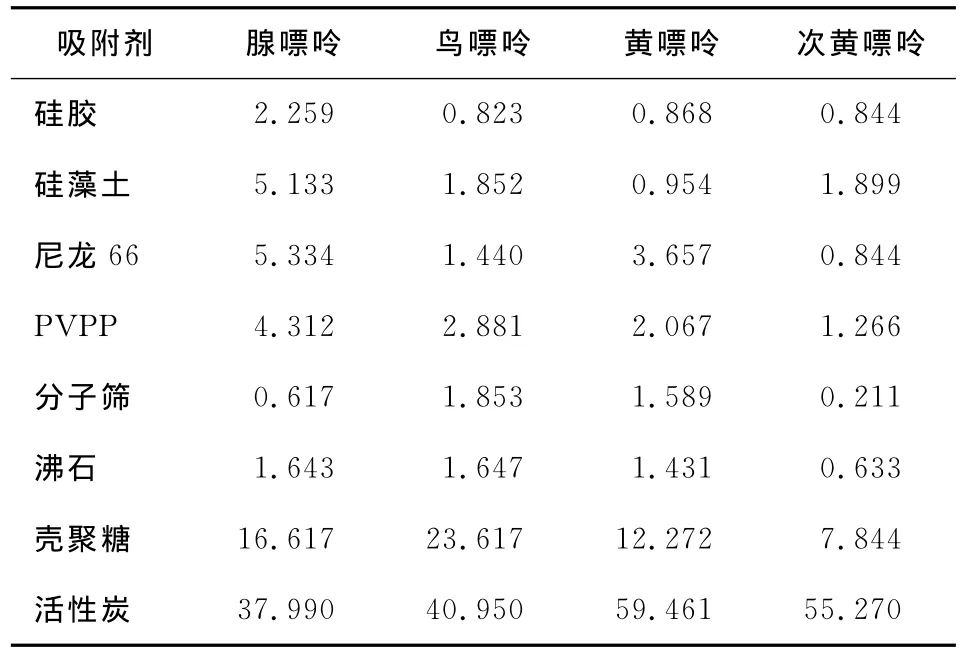
表1 不同吸附剂对4种嘌呤的吸附效果Table 1 Different types of sorbments on the removal of purine /%
由表2可知,8种吸附剂对4种嘌呤都具有一定的吸附效果,活性炭的吸附效果尤其显著,特别是对黄嘌呤和次黄嘌呤的吸附效果更加明显,吸附效果次于活性炭的是壳聚糖。其它6种吸附剂对4种嘌呤物质的吸附效果都不理想。故选择活性炭作为豆浆嘌呤物质的吸附剂,进行深入研究。
2.2 活性炭添加量对豆浆嘌呤吸附率的影响
活性炭的添加量对豆浆中嘌呤吸附率的影响见图1。
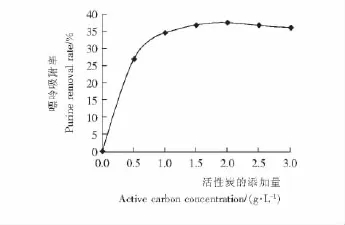
图1 活性炭的添加量对豆浆中嘌呤脱除率的影响Figure 1 Effect of removal yield of purine in Soya bean milk on the addition of activated carbon
由图1可知,随着活性炭加入量的不断增大,嘌呤的去除率逐渐增大,当活性炭浓度达到1.5g/L时,去除效果达到最大。
2.3 反应温度对豆浆嘌呤吸附率的影响
反应温度对豆浆中嘌呤吸附率的影响见图2。
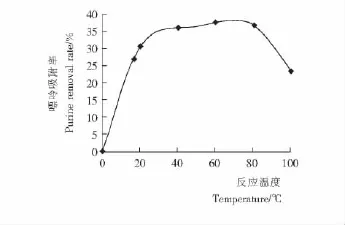
图2 反应温度对豆浆中嘌呤吸附率的影响Figure 2 Effect of removal yield of purine in Soya bean milk on temperature
由图2可知,随着温度的不断升高,豆浆中嘌呤的去除率呈现先增加后减少的状态,在70℃时达到最高,继续升高温度,吸附率反而下降。这是由于活性炭吸附为物理吸附,吸附过程是放热过程,温度过高反而不利于吸附,因此,70℃时吸附效果最好。
2.4 反应pH对豆浆嘌呤吸附率的影响
反应pH对豆浆中嘌呤吸附率的影响见图3。
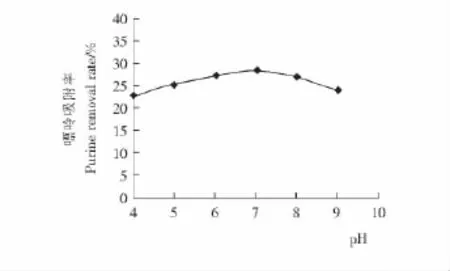
图3 反应pH对豆浆中嘌呤吸附率的影响Figure 3 Effect of removal yield of purine in Soya bean milk on pH
由图3可知,随着pH的逐渐增大,嘌呤的吸附率先增大后减小,在pH为8时达到最大,但趋势并不是很明显,考虑到豆浆本身的pH为6.8左右,与最大值间差距不大,因此在深入活性炭对豆浆嘌呤进行去除的探索中,可维持反应pH值在豆浆本身pH值(6.8)左右来进行研究。
2.5 反应时间豆浆嘌呤吸附率的影响
反应时间对豆浆中嘌呤吸附率的影响见图4。
由图4可知,随着反应时间的增加,嘌呤吸附率呈现先上升后下降的趋势,在50min时达到最大。
2.6 正交试验结果
选择活性炭作为豆浆嘌呤物质的吸附剂,分别考察活性炭的添加量、反应温度、pH值和反应时间4个因素对豆浆中嘌呤物质吸附率的影响。根据单因素试验结果,确定各因素对应水平见表2。
根据表2确定的各个因素,进行正交试验,得到结果见表3。
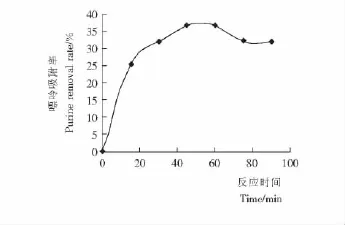
图4 反应时间对豆浆中嘌呤吸附率的影响Figure 4 Effect of removal yield of purine in Soya bean milk on time
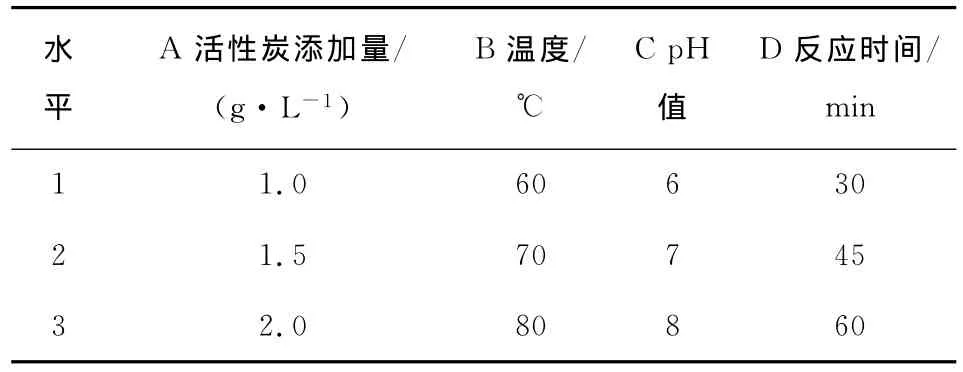
表2 因素水平表Table 2 Different Levels of Fators

表3 正交试验结果与分析Table 3 Orthogonal experiment and results analysis
由表3可知,影响豆浆中嘌呤去除率的因素主次为D>A>B>C,最佳配比为A3B1C1D3,但由单因素试验可知,当活性炭的添加量大于1.5g/L时,嘌呤吸附率的增加趋势已不明显,且考虑到活性炭浓度越高,其对豆浆的品质影响也越大,所以确定最佳添加量为1.5g/L,pH值为6.0,60℃恒温静置60min。在此条件下进行3次验证实验,最终得到豆浆中嘌呤的平均去除率为48.878%。经过凯氏定氮测得未经处理的豆浆蛋白质含量为6.826%,处理过的豆浆蛋白质含量为5.122%,仅降低了1.135%。
3 结论
通过吸附作用的机理,采用不同的吸附剂对4种嘌呤物质进行吸附,活性炭的吸附效果远远大于其它吸附剂。选择活性炭作为吸附剂,对豆浆中的嘌呤类物质进行吸附研究。结果表明,在活性炭添加浓度为1.5g/L,pH值为6.0,60℃恒温静置60min时,能有效去除豆浆中的嘌呤物质,吸附率达到48.878%。经过凯氏定氮测得处理过的豆浆蛋白质含量仅降低了1.135%。可考虑采用该方法,为痛风及其并发症患者研制低嘌呤保健豆浆,并扩大豆制品的消费市场,创造更大的经济效益。
1 夏光辉,刘振春,陈丽安.菠萝味豆浆的制作工艺研究[J].安徽农业科学,2010,38(10):5 204~5 305.
2 黄敏璋,程裕东,周颖越,等.豆浆饮料的微波杀菌特性初步研究[J],食品科学,2006,27(12):152~155.
3 刘少林.大豆中嘌呤含量的测定及分离研究[D].安徽:安徽农业大学,2009.
4 张春珍,郑亚丽.低嘌呤饮食对痛风性关节炎疗效的影响[J].浙江预防医学,2004,16(9):64~65.
5 卢味,詹玉云,邱秀娉.合理饮食对痛风病人治疗作用的观察[J].中外健康文摘,2010,7(27):27~28.
6 林先军,董建军,单连菊,等.吸附剂吸附啤酒中嘌呤类物质的初步研究[J].中国酿造,2006(6):39~41.
7 Fujino Yokoham S,Ohkochi M.Development of new beers and happou-shu for health conscious consumers[R].USA:MBAA 116thAnniversary Convention,1999.
8 胡金德,李德超,曹又新.低嘌呤啤酒及其酿酒工艺技术[J].啤酒科技,2004(11):10~11.
9 Stewart G G,Martin S A.Wort clarity:effects on fermantation[J].Mbaa TQ,2004,41(1):18~26.
10 李景梅,金丽虹,翁占坤.鸟嘌呤,腺嘌呤,胸腺嘧啶和胞嘧啶的紫外吸收谱研究[J].长春理工大学学报,2008,31(2):74~76.11 凌云,王新宴,雍炜.高效液相色谱法检测肉类食品中4种嘌呤碱[J].分析化学,2008(6):724~728.
12 刘少林,李梅青,丁之恩.HPLC法测定大豆中嘌呤含量的研究[J].安徽农业大学学报,2009,36(4):674~676.
13 刘春凤,李崎,李永仙,等.固相萃取-反相高效液相色谱法测定小麦中的嘌呤类物质[J].食品与生物技术学报,2008,27(5):120~123.
14 尤玉如,张艳萍,刘士旺.HPLC法测定啤酒中嘌呤含量的方法研究[J].中国酿造,2008(3):76~78.
15 凌育赵,曾满枝.HPLC法测定广东南昆山白毛茶中的嘌呤碱[J].食品研究与开发,2006,27(7):155~157.
16 商曰玲,杜金华.啤酒发酵过程中嘌呤含量的变化研究[J].酿酒,2009,36(5):43~46.
