大豆小分子肽生物学功能效果评价
2012-09-05李茂辉李硕郭红阎萍
李茂辉,李硕,郭红,阎萍
(1.沈阳医学院预防医学系卫生检验中心,辽宁沈阳 110034;2.昆明理工大学生物技术研究中心,云南昆明 650224;3.沈阳二四二医院,辽宁沈阳 110034)
自1902年英国科学家Buyliss和Starling在动物的胃肠内第一次发现活性多肽物质以来,到现在人们已发现和分离出100多种存在于生物体内的多肽。特别是近30年,随着生物医学的发展和分离检测水平的提高,对于多肽研究取得巨大的进展。人们发现,多肽物质除了具有一般蛋白质的营养作用外,对人体还具有非常重要的不可替代的调节作用,这种作用几乎涉及到人体的所有生理活动。例如:神经、消化、吸收、代谢、循环、生长、生殖、内分泌等等[1]。
近年来,大豆蛋白产品的开发利用已受到食品工业的高度重视。大豆蛋白的乳化性及吸油性等功能特性,已被人们广泛地接受和认识。为了进一步提高大豆产品的营养功能和加工特性,提高大豆蛋白产品的利用价值与附加值,大豆肽的开发研究已成为国内外研究的热点[2]。
大豆多肽是大豆蛋白经水解而制成的低分子肽混合物,无论是理化特性、营养特性还是功能特性都优于大豆蛋白质。研究表明这些低分子肽具有调节血压、降低胆固醇、促进脂肪代谢、提高机体免疫力、延缓衰老等功能,其应用前景非常广泛,市场潜力巨大[3]。我们采用来源广泛廉价的粗胰酶预处理脱脂大豆饼粕后,再用中性微生物蛋白酶做酶源,研究完成了大豆小分子多肽的实验室制备工艺和质量检测标准方面的工作,取得了无蛋白质变性,无豆腥味,无残渣,分子量小,易溶于水,在酸性条件下也不产生沉淀,溶液粘性小和受热不凝固等特性,它是一种活性小分子肽(分子量300 u~700 u)。本实验采用实验室自己研制的大豆小分子肽,通过动物实验模型来探讨其抗疲劳和抗氧化的生物学功能。为更好地开发大豆小分子肽提供理论依据。
1 材料与方法
1.1 材料
大豆饼粕(蛋白质含量55.55%):辽宁省昌图县。
粗胰酶(1.93 kat):由沈阳医学院预防医学系卫生检验中心自制,工艺流程:采用新鲜胰脏一加2倍水→磨成胰浆→pH5.5的氯化钙激活剂激活胰浆→乙醇沉淀→室温干燥→粗胰酶粉→回收乙醇
根据国家药典中的测定方法以酪蛋白为底物(1.5%),用硼酸盐缓冲液稀释配成相应浓度,采用氯化钙激活,在40℃下酶促反应30 min,以三氯醋酸(5%)沉淀,在257 nm处测定吸收,以确定胰蛋白酶的活力单位[4]。
中性蛋白酶(枯草杆菌蛋白酶10.00 kat):北京奥博星生物工程公司。其它生物与化学试剂均为本地化学试剂公司生物纯和分析纯,大豆小分子多肽液经浓缩→喷雾干燥→大豆小分子肽粉→用去离子水配成透明溶液以备灌胃用。该工艺制成大豆小分子肽采用高效凝胶过滤色谱法(HPGFC)测定:小分子多肽峰值分子量范围为300 u~700 u之间。
1.2 实验动物
实验动物昆明种小白鼠,Wister种大白鼠由本学院实验动物中心提供。昆明种小白鼠200只,雌雄各半,体重(18±2)g,按性别、体重随机分为1个对照组和3个试验组。分组后饲养观察3 d,剔除不合格个体后灌胃,空白对照组灌胃适量去离子水,各实验组灌胃大豆小分子肽溶液,剂量分别为每天3、6、9 g/kg。连续25 d,实验期间,小鼠自由摄食及饮水[4]。
取(200±20)g Wister大白鼠 40只,按性别、体重随机分为1个对照组和3个剂量组。分组后饲养观察3 d后灌胃,对照组灌胃去离子水5 mL/d,试验组灌胃大豆小分子肽溶液,3个剂量分别为每天3、6、9 g/kg。饲养50 d,实验期间,大鼠自由摄食及饮水[5]。Wister种老龄大白鼠。取鼠龄为20个月,体重为(381.75±39.23)g Wister老龄雄性大白鼠20只,按体重随机分为1个对照组和1个实验组。分组后饲养观察3 d后灌胃,对照组灌胃生理盐水5 mL/d,试验组灌胃大豆小分子肽溶液6.0 g/kg/d。饲养60 d,实验期间,大鼠自由摄食及饮水[5]。
1.3 对小鼠游泳时间的影响
给样第25 d后,小鼠灌胃0.5 h后,进行负重游泳实验。小鼠右侧臀负重6%,放入水温(25±1)℃、水深40 cm的水槽中游泳,记录小鼠从入水至运动疲劳发生时的游泳时间。小鼠头部没入水面以下7 s不再上浮判定为疲劳。记录疲劳时间[6]。
1.4 对大白鼠各组SOD活性的影响[7]
大鼠连续给样50 d后,分别剪断股动脉,血用肝素抗凝,取肝脏用冰生理盐水冲洗,滤纸吸干,精确称重,加入冰生理盐水,玻璃匀浆器制成10%的组织匀浆,离心后吸取上清液备用。按微量邻苯三酚快速测定红细胞,肝脏的SOD活性。
1.5 对大白鼠各组SOD;GSH-Px活性和脂质过氧化产物丙二醛(MDA)含量的影响[8]
大鼠连续给样60 d后,分别剪断股动脉,血用肝素抗凝,取肝脏用冰生理盐水冲洗,滤纸吸干,精确称重,加入冰生理盐水,玻璃匀浆器制成10%的组织匀浆,离心后吸取上清液备用。按微量邻苯三酚快速测定红细胞,肝脏的SOD活性。而GSH-Px活性和脂质过氧化产物丙二醛(MDA)含量测定采用南京建成生物工程研究所生产的试剂盒。
1.6 统计学处理
所有数据输入计算机,用SPSS 10.0 For Windows统计软件进行单因素方差分析,统计处理数据用±s表示。组间比较用t检验,显著性水平为(P<0.05)。
2 结果
2.1 大豆小分子肽对游泳时间的影响
大豆小分子肽实验组中高剂量组与对照组(生理盐水组)相比,力竭游泳时间明显延长,差异显著(P<0.05)。
表1 大豆小分子肽对游泳时间的影响Table 1 Effect of soybean minor peptides on mice exhaustive swimming time(±s)

表1 大豆小分子肽对游泳时间的影响Table 1 Effect of soybean minor peptides on mice exhaustive swimming time(±s)
组别 动物数 游泳时间(±s)/min对照组 15 41.7±6.3剂量组3.0 15 40.2±11.9 6.0 15 54.9±10.9*9.0 15 52.4±9.3*
2.2 大豆小分子肽对大白鼠各组SOD活性的影响
大豆小分子肽实验组中的3个剂量组与对照组相比,中高剂量组的红细胞(Hb)的SOD活性显著增加(P<0.05),但两组没有剂量相关性。而肝脏的SOD活性有增加趋势,但两组没有统计学意义(P>0.05)。
表2 大豆小分子肽对的红细胞(Hb)肝脏的SOD活性影响nkatal(±s)Table 2 Effect of soybean minor peptides on activities of superoxide dismutase(SOD)of Hb and liver in the mice(±s)
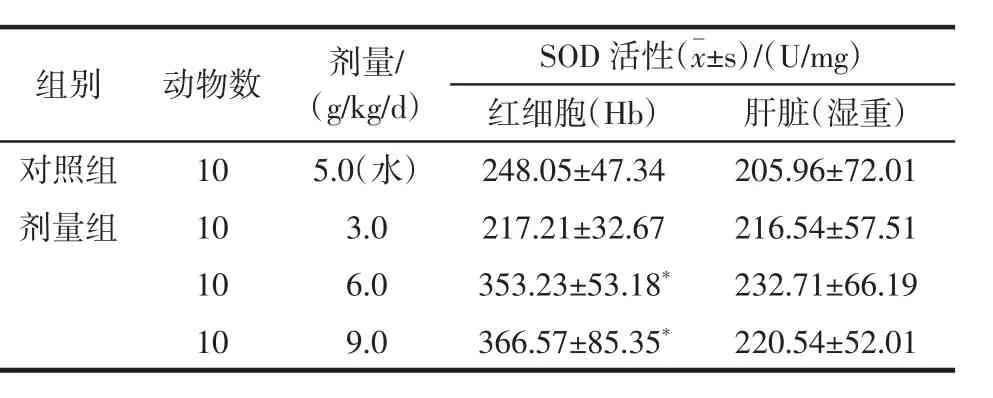
表2 大豆小分子肽对的红细胞(Hb)肝脏的SOD活性影响nkatal(±s)Table 2 Effect of soybean minor peptides on activities of superoxide dismutase(SOD)of Hb and liver in the mice(±s)
红细胞(Hb) 肝脏(湿重)对照组 10 5.0(水) 248.05±47.34 205.96±72.01剂量组 10 3.0 217.21±32.67 216.54±57.51 10 6.0 353.23±53.18* 232.71±66.19 10 9.0 366.57±85.35* 220.54±52.01组别 动物数 剂量/(g/kg/d)SOD活性(±s)/(U/mg)
2.3 大豆小分子肽对老年大白鼠SOD活性的影响
大豆小分子肽实验组与对照组相比,实验组的红细胞(Hb)SOD活性显著增加(P<0.05),而肝脏的SOD活性有增加趋势,但两组没有统计学意义(P>0.05)。
2.4 大豆小分子肽对老年大白鼠谷胱甘肽过氧化物酶(GSH-Px)活性的影响
大豆小分子肽实验组与对照组相比,实验组的红细胞(Hb)GSH-Px活性显著增加(P<0.05),而肝脏的
表3 大豆小分子肽对的红细胞(Hb)肝脏的SOD活性影响nkatalTable 3 Effect of soybean minor peptides on activities of superoxide dismutase(SOD)of Hb and liver in old rats(±s)
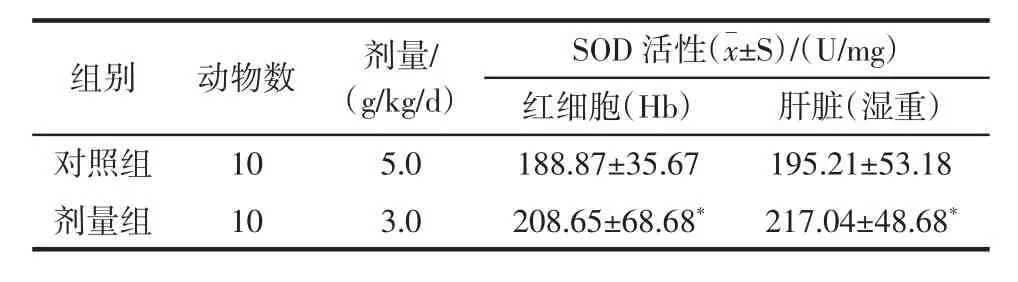
表3 大豆小分子肽对的红细胞(Hb)肝脏的SOD活性影响nkatalTable 3 Effect of soybean minor peptides on activities of superoxide dismutase(SOD)of Hb and liver in old rats(±s)
红细胞(Hb) 肝脏(湿重)对照组 10 5.0 188.87±35.67 195.21±53.18剂量组 10 3.0 208.65±68.68* 217.04±48.68*组别 动物数 剂量/(g/kg/d)SOD活性(±S)/(U/mg)
表4 大豆小分子肽对的红细胞(Hb)肝脏的GSH-Px活性影响nkatalTable 4 Effect of soybean minor peptides on activities of peroxidase(GSH—Px)of Hb and liver in old rats(±s)

表4 大豆小分子肽对的红细胞(Hb)肝脏的GSH-Px活性影响nkatalTable 4 Effect of soybean minor peptides on activities of peroxidase(GSH—Px)of Hb and liver in old rats(±s)
组别 动物数 剂量/(g/kg/d)GSH-Px活性(±s)红细胞(Hb) 肝脏(湿重)对照组 10 5.0 266.38±51.34 310.91±63.51剂量组 10 6.0 215.23±66.51* 329.90±49.01*
GSH-Px活性有增加趋势,但两组没有统计学意义(P>0.05)。
2.5 大豆小分子肽对老年大白鼠的血红细胞与肝脏组织中丙二醛含量的影响
表5 大豆小分子肽对的红细胞(Hb)肝脏的丙二醛含量影响μmol/LTable 5 Effect of soybean minor peptides on the concentration of malondialdehyde(MDA)of Hb and liver in old rats(±s)
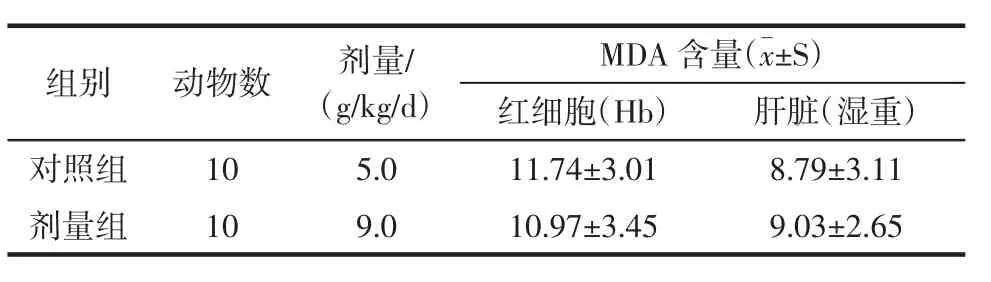
表5 大豆小分子肽对的红细胞(Hb)肝脏的丙二醛含量影响μmol/LTable 5 Effect of soybean minor peptides on the concentration of malondialdehyde(MDA)of Hb and liver in old rats(±s)
组别 动物数 剂量/(g/kg/d)MDA 含量(±S)红细胞(Hb) 肝脏(湿重)对照组 10 5.0 11.74±3.01 8.79±3.11剂量组 10 9.0 10.97±3.45 9.03±2.65
大豆小分子肽实验组与对照组相比,实验组的红细胞(Hb)和肝脏中的MDA含量虽有降低的趋势,但两组没有统计学意义(P>0.05)。
3 讨论
疲劳是由运动引起机体一系列生化改变而导致的肌肉力量的降低。评价疲劳的方法包括耐力试验和生化指标的检测。耐力试验通过测定机体持续运动至力竭的时间可以反映机体的耐力[9]。标志疲劳发生的生化指标有以下几类:(1)能量物质,如血糖、肝糖原、肌糖原;(2)代谢调节物质,如酶、激素;(3)代谢产物,如血和肌肉中的乳酸、血尿素氮、丙酮酸等。只有运动时变化明显,其变化程度与运动负荷及强度一致的指标才能作为疲劳的评价指标。储存在肌肉中的糖原和葡萄糖,在无氧的条件下分解,终产物是乳酸。乳酸经扩散进入血液,称为血乳酸。然而在剧烈活动时,糖酵解供能系统成为供能的主要途径。导致大量乳酸生成,血乳酸的浓度随之增加。血液乳酸的含量与运动强度关系密切,血乳酸可作为评定运动强度的生化指标。糖是主要供能物质。随着负荷时间延长,能量供应平衡遭到破坏;对糖能量储备的需要越高,工作肌内糖元储备下降或不足,同时使蛋白质水解酶活性升高,又促进蛋白质分解代谢加强,合成速度明显下降,其分解产物氨通过肝和肾转变为尿素,流经血液,使血中尿素浓度越来越高,故负荷越大,持续时间越长,血中尿素氮的浓度亦越高。同时当肌肉剧烈运动时,机体内氧化作用大大加强,产生一系列氧自由基可导致肌肉和肝脏中脂质过氧化产物增多而引起细胞或组织损伤,也是机体疲劳的原因之一[10]。
实验结果表明:大豆小分子肽(分子量300 u~700 u)的中;高剂量组能明显延长小鼠负重游泳时间,高剂量组具有明显耐缺氧能力。并且高剂量组小鼠运动后血乳酸含量与对照组相比明显降低。肝糖原;和血尿素氮含量与对照组相比差异不明显(数据未列出),无统计学意义(P>0.05)。而中;高剂量组的大鼠的血红细胞的超氧化物歧化酶(SOD)活力明显高于对照(P<0.05),而肝脏组织SOD酶活性有升高的趋势,但无统计学意义(P>0.05)。说明大豆肽具有一定的抗疲劳作用。有关活性肽的抗疲劳机制还不清楚,尚需进一步的研究。
目前一般认为,机体的衰老与自由基有很大的关系。机体在正常代谢过程中可以产生多种活性氧,如超氧阴离子(·O2-),羟自由基(·OH)、过氧化氢 H2O2)等,其中·OH与机体中的多不饱和脂肪酸(LH)作用,可以产生LPO。LPO的最终代谢产物,如小分子的醛、酮等可以与生物大分子作用,使其失去生理功能,最终导致机体损伤。生物体内的抗氧化物酶,如SOD、GSH-Px可以清除活性氧,对生物体起保护作用,因此SOD、GSH—Px活性大小,LPO浓度的高低可反映出机体被氧化损伤的程度[11]。
丙二醛(MDA)是脂质过氧化(脂褐素)LPO代谢物,其含量高低可反映体内自由基的反应程度,脂质过氧化物可引起细胞代谢及功能障碍甚至死亡,故丙二醛(MDA)的含量常可间接反映出机体受自由基攻击程度[12]。
实验表明:大豆小分子肽可明显增加血红细胞(Hb)SOD、GSH—Px活性,而对肝组织中二酶的活性却不明显,对MDA含量的抑制作用亦不明显。
有关活性肽的抗氧化机制还不清楚,可能是通过增加SOD,GSH-Px的活性,加快体内自由基的清除,从而抑制肝脏内过氧化脂质的二级分解产物MDA的含量,有利于保护细胞免受过氧化损伤,对自由基有关的疾病有一定的防治作用。但具体是哪种物质对抗氧化起主要作用,尚需进一步的研究[13]。
本实验大豆小分子肽只能增加血红细胞(Hb)SOD、GSH—Px活性,而对肝组织的活性却不明显,并对MDA含量几乎没有抑制作用。仍需进一步实验研究来解释。
肽类功能性食品被国内外专家称为21世纪食品。功能性食品是高附加值产品,关系到各年龄段人们的健康保健,市场潜力巨大。东北地区又是大豆的主产区,大豆小分子肽的开发可为食品工业提供了更为优质的食品辅料,同时为功能性食品的开发,提供了强大的物质基础。在实现经济和社会效益同时,又拉动了大豆种植业,激活了大豆初加工工业,也会促进交通运输、水、电、煤等基础产业的发展。
:
[1]Mendal Friedman,David L.Brandon.Nutritional and Health Benefits ofSoyProteins[J].AgriFoodChem,2001,49(3):1069-1086
[2]Hellerstein M.Antimitotic peptide characteres from soybean:role in protection from cancer[J].Nutr Rev,1999,57(11):359-361
[3]崔凌飞,王遂.蛋白质及其水解物的分析应用[J].哈尔滨商业大学学报,2002,18(1):117-120
[4]李茂辉,金山,孟玉玲.东北油松花粉酶法提取液抗疲劳作用的实验[J].中国公共卫生,2002(5):610
[5]李茂辉,叶丽杰,卢桂华,等.心肌多肽抗疲劳效应的实验研究[J].现代预防医学,2006,33(7):1097-1099
[6]何来英,严卫星,楼密密,等.保健食品抗疲劳作用试验方法研究[J].中国食品卫生杂志,1997,9(4):1-7
[7]徐国栋,刘方,龚辉,等.运动时骨骼肌组织血氧与血乳酸浓度的关系[J].航天医学与医学工程,2003,16(1):41
[8]张雪琳.关于运动性疲劳的氧自由基一脂质过氧化理论概述[J].河北体育学院学报,2003,14(3):68
[9]赵芳芳,张日俊.大豆肽的研究进展[J].中国饲料,2004(1):22-24
[10]李茂辉,金山,孟玉玲.东北油松花粉酶法提取液抗疲劳作用的实验[J].中国公共卫生,2002(5):610
[11]陈勤主.抗衰老研究实验方法[M].北京:中国医药科按出版社,1996:499-500
[12]凌智群,谢笔钧.莲房原花青素对氧自由基和脂质过氧化的作用[J].营养学报,2002,24(2):121-125
[13]庞战军,周玫,陈瑗.自由基医学研究方法[M].北京:人民卫生出版社,2000:118-120
