酸菜乳酸菌分离鉴定及共轭亚油酸含量分析
2012-09-05刘海霞郑婷赵国芬包秋华张和平
刘海霞,郑婷,赵国芬,*,包秋华,张和平
(1.内蒙古农业大学生命科学学院,内蒙古呼和浩特010018;
2.内蒙古农业大学食品科学学院,内蒙古呼和浩特 010018)
近年来,共轭亚油酸由于其重要的生理功能受到人们的重视[1],乳酸菌微生物合成共轭亚油酸是一种经济高效的途径[2],而酸菜是世界性大众化蔬菜腌制品,在我国历史悠久[3],其自然发酵的主要菌群是乳酸菌[4]。本实验从自然发酵的酸菜汁分离鉴定乳酸菌并用紫外法测定共轭亚油酸含量,并得到一株高产共轭亚油酸的菌株,为酸菜制品研究和共轭亚油酸工业化生产提供理论和实验参考。
1 材料与方法
1.1 材料
自然发酵的酸菜汁;牛肉膏、蛋白胨:广东环凯微生物科技有限公司;磷酸氢二钾:北京益利粗细化学品有限公司;无水乙酸钠:天津市永大化学试剂开发中心;柠檬酸铵:天津市凯通化学试剂有限公司;硫酸镁、硫酸锰:天津市科盟化工工贸有限公司;吐温80:广东环凯微生物科技有限公司;溴甲基酚紫培养基:上海博微生物科技有限公司;琼脂、亚油酸:美国sigma公司。
1.2 实验主要设备
PYX-DHS电热恒温培养箱:上海一恒科技有限公司;SW-CJ-1FD超净工作台:苏州安泰空气技术公司;LS-B50L高压蒸汽杀菌锅:上海医用核子厂;UV-1800PC紫外分光光度:计北京普析通用仪器有限责任公司;GS00001PCR 仪:Gene Technologies,Geldoc 2000凝胶成像系统:Bio-Rad Laboratories,核酸电泳仪:Power pac Bio-Rad Laboratories。
1.3 方法
1.3.1 乳酸菌的分离纯化
酸菜汁用无菌水梯度稀释,稀释度分别为10-1、10-2、10-3、10-4、10-5,各取 200 μL 倒入含溴甲基酚紫的平板培养皿中,用涂布棒将其涂匀,涂干;涂菌后放入37℃培养箱培养48 h。从培养基长势较好,菌落易分辨的培养基平板上挑起单菌落进行革兰氏染色、显微镜镜观察形态[5]。将革兰氏阳性菌涂在MRS固体培养基中(涂Z型),随后放入37℃培养箱,培养48 h。挑选大的球菌反复在MRS固体培养基上几次纯化筛选。进行3次后,菌落基本纯化。将纯化的菌接到MRS液体培养基中培养,进行扩大培养[6]。培养48 h进行DNA提取和16S rDNA鉴定。并取适量菌种加甘油于-70℃备用。
1.3.2 乳酸菌的鉴定
1.3.2.1 乳酸菌形态的观察
乳酸菌属在MRS培养基上的菌落大致呈现乳白色,湿润,杆菌边缘不整齐,球菌边缘整齐,直径在1 mm~3 mm左右。乳酸菌为一类革兰氏阳性球菌或杆菌[7]。
1.3.2.2 16 S rDNA菌种鉴定[8]
1)引物设计
根据细菌16 S rDNA一端长为1 225 bp保守序列,设计一对细菌的通用引物,用于PCR扩增,引物由上海生工生物工程技术服务有限公司合成。引物序列如下:
引物 1:5′-CCG GAT CCAGAG TTT GAT CAT GGC TCAGCA-3′
引 物 2:5′-CGG GAT CCTACG GCTACC TTG TTACGACTT-3′
2)乳酸菌DNA的提取
参照细菌提取方法提取乳酸菌DNA[9]。
3)PCR反应体系
按表1将下列成分加入PCR管中。
4)PCR扩增程序
按表2进行16 SrDNA PCR扩增。
5)PCR产物的克隆
将PCR产物经10 g/L琼脂糖凝胶电泳后,用胶回收试剂盒回收特异性目的片段。将回收的PCR产物与pMD19-T载体进行连接,反应采用10 μL反应体系,即:加入 pMD19-T 载体 0.5 μL,PCR 产物 5.0 μL,Ligation solution 4.5 μL,16℃连接过夜。用连接的产物转化DH5α感受态细胞,涂布含有AMP的培养基平板,37℃培养12 h~16 h后,挑取白色菌落,进行PCR鉴定。

表116 SrDNA PCR MixTable 1 16S rDNA PCR Mix

表2 16 S rDNA PCR程序Table 2 Procedure of 16 S rDNA PCR
6)16 SrDNA的序列测定及与标准序列的比较
将经过鉴定的含重组质粒的菌种送华大基因公司进行序列测定。序列测定结果通过Internet网(http://www.ncbi.nlm.nih gov/blast.cgi), 将 所 测 序 列 与Genbank数据库中已报到的序列进行相似性比较。
1.4 产生共轭亚油酸能力的测定
共轭亚油酸在233 nm处有最大吸收峰。用色谱纯的正已烷为溶剂,将CLA标样稀释成不同浓度的溶液,以正已烷为参照,在紫外233 nm处测定CLA(共轭亚油酸)标样溶液的吸光值,以CLA浓度为横坐标,吸光值为纵坐标,绘制标准曲线。线性回归方程为y=0.094 6x-0.004 8[10]。
取0.2 mL活化好的菌液,接菌于装有10 mL筛选培养基的试管中,37℃静置培养36 h。发酵结束后,置于50 mL三角瓶中,加入25 mL正己烷,210 r/min萃取1 h,10 000 r/min离心20 min,以未接种的筛选培养基为参照,取正己烷层,233 nm处测定吸光值,根据标准曲线计算出共轭亚油酸的生成量[11]。
2 结果与分析
2.1 酸菜汁中乳酸菌的筛选结果
2.1.1 溴甲基酚紫培养基培养
通过培溴甲基酚紫培养基初步筛选发现,10-5稀释度试管中的菌长势最好,生长情况如图1。说明有产酸的细菌产生。

2.1.2 革兰氏染色、电镜观察
将上述产酸的细菌进行电镜观察,为革兰氏阳性杆菌,图2和图3的菌分别命名为L菌和S菌,均为为短棒状。
2.1.3 MRS固体培养基培养
纯化后的L菌落和纯化后的S菌落,见图4,图5。
2.2 16 S rDNA鉴定结果2.2.1 DNA的电泳结果
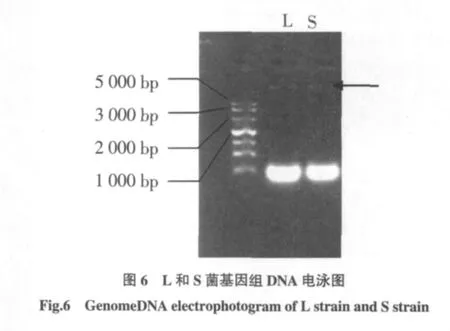
对筛选出的L菌和S菌提取DNA电泳检测结果如图6,图6表明L、S菌的DNA提取成功。
2.2.2 PCR的电泳结果
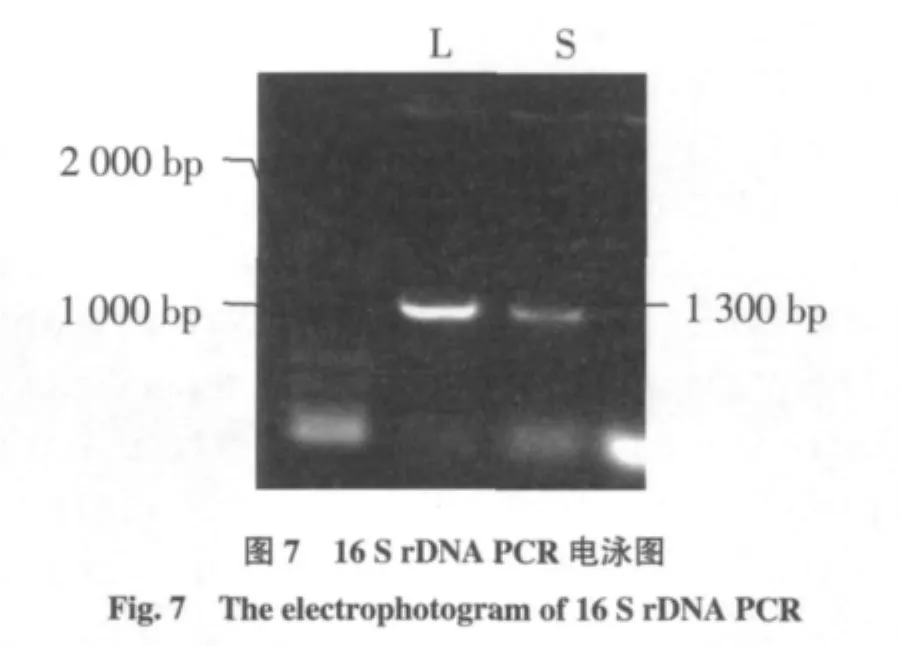
以筛选出L、S菌基因组DNA为模板,以特异性引物扩增16 S rDNA片段,结果如图7。从图7可以看出各菌均扩增出约1 300 bp片段,大小与预期的16Sr-DNA片段一致。
2.2.3 菌落PCR鉴定
菌落PCR电泳图,见图8。

菌落PCR结果如图8所示,两个菌株均得到了1.3 kb左右大小的片段,均为阳性克隆,与预期相符,表明两株菌株的16 S rDNA均与pMD19-T载体连接成功。
2.2.4 菌株16SrDNA序列测定结果与比对
将扩增出L、S菌的16 S rDNA片段,送华大基因测序,序列结果如下:




表3 各菌测序比对结果Table 3 The sequencing alignment results of the strains
从表3可以看出L、S菌与棒状乳杆菌的同源性均在99%,初步判断L、S菌均为棒状乳杆菌。
2.3 亚油酸异构酶酶活测定结果
发酵检测L和S菌株的CLA浓度分别为0.004 4 mg/mL和0.010 7 mg/mL,CLA的转化率分别是1.03%和2.51%。
3 结论
从自然发酵酸菜汁中用含溴甲基酚紫培养基只分离出两株乳酸菌,说明这两株菌为酿制酸菜过程中的优势菌株。该菌株经过革兰氏染色、电镜观察和16 S rDNA菌种鉴定为棒状乳杆菌(Lactobacillus coryniformis subsp.torquens strain30),经测定L和S菌株产CLA分别为0.004 4 mg/mL和0.010 7 mg/mL,CLA转化率分别为1.03%和2.51%;S菌共轭亚油酸的能力较高,在以后的研究中对所选取的反应条件和时间进行改进和优化,以进一步提高底物的转化率和产物得率,为食品、医药、工业上的进一步应用提供参考。
:
[1]王月囡,曹键,曾实,等.共轭亚油酸生物合成的研究[J].食品研究与发,2006,27(4):4-8
[2]张浩,曹键,常共宇,等.亚油酸异构酶研究进展[J].中国油脂,2004,29(10):38-42
[3]李凤梅,王晓,张双灵,等.自然发酵酸菜汁中乳酸菌分离鉴定[J].中国造,2008,5:32-35
[4]毕金峰,刘长江,赵明,等.自然发酵酸菜汁中乳酸菌的分离、鉴定及发酵剂的筛选[J].沈阳农业大学学报,2000,31(4):346-349
[5]布坎南R E,吉本斯N E,等.伯杰细菌手册[M].8版.北京:科学出版社,1984:1-200
[6]凌代文.乳酸细菌分类鉴定及实验方法[M].北京:中国轻工业出版社,1999:1-184
[7]中国科学院微生物研究所细菌分类组.一般细菌常用鉴定方法[M].北京:科学出版社,1978:111-187
[8]Fox G E,Wisotzkey J D,Jureshuk P.How close is close 16sr RNA sequence identity may not be sufficient to guarantee species identity.Int J Syst Bacteriol,1992(42):166-170
[9]F.奥斯伯,R.布伦特,R.E.金斯顿,等.精编分子生物学实验指南(颜子颖,王海林译)[M].北京:科学技术出版社,1998:13-50
[10]曹健,王月囡,王红军,等.嗜酸乳杆菌亚油酸异构酶活力测定的研究[J].食品科学,2007,28(1):155-158
[11]张中义,胡锦蓉,刘萍,等.产共轭亚油酸乳酸菌的筛选及产物分析[J].中国农业大学学报,2004,9(3):5-8
