腹泻性贝类毒素(DSP)的两种快速检测方法比较
2012-09-05胡雪莲俞漪曲勤凤顾文佳
胡雪莲,俞漪,曲勤凤,顾文佳
(上海市质量监督检验技术研究院,上海 200233)
贝类毒素(Shellfish toxin)是一类由浮游藻类或微生物合成,通过食物链传给贝类,并在其体内富集而形成的脂溶性次生代谢生物高分子化合物[1-3]。它的形成与海洋中有毒藻类赤潮密切相关。常见的贝类毒素包括腹泻性贝类毒素(DSP)、麻痹性贝类毒素(PSP)、神经性贝类毒素(NSP)和健忘性贝类毒素(ASP)等。其中,腹泻性贝类毒素的存在比较普遍,海产双壳类、棘皮类、腹足类等软体动物中都曾有检出该毒素的报道[4]。近年来对中国沿海部分海域贝类毒素的调查显示[5-7],中国沿海部分海域赤潮活动平凡,赤潮一旦产生,海产双壳贝类易受到贝类毒素的威胁。腹泻性贝类毒素的主要中毒症状包括腹泻(92%)、恶心(80%)、呕吐(79%)、下腹疼痛(53%)[8]。尽管目前还没有因DSP中毒致死的报道,但由于DSP中毒症状与细菌性胃肠炎类似,极易混淆,且发作时间短,目前尚无有效的治疗药物,若是延误治疗,会对健康造成较大的伤害。
目前国内外对于DSP的检测方法以经典的小鼠法为主,该方法是AOAC(美国官方化学家协会)的标准方法,同时也是目前唯一被大多数国家所普遍接受的统一方法。我国国标GB/T 18406.4-2001《农产品安全质量无公害水产品安全要求》及2011年5月17日我国卫生部刚公布的《食品安全国家标准贝类中腹泻性贝类毒素的测定》(征求意见稿)中的检测方法也都是小鼠法。但该方法存在着很多不足和缺陷,如:仅能指出毒性的大小,无法确定毒素的组成和含量;所测得的毒性和小鼠品系有关,可比性较差,必须进行标准毒素校准才有可能相比;毒性测试所需时间长,重复性差;需要受过专门训练的操作人员;小鼠维持费用较高,对实验场地要求较高等[9]。这些不足使得人们希望能有另外一些操作简便、可比性强、易于普及、对实验人员和检测场地要求相对较低的检测手段来替代小鼠法。
本文在前期研究的基础上[10],着重比较了两种贝类毒素DSP的快速筛选检测方法——酶联免疫法和蛋白磷酸酶抑制法,旨在较短时间内对贝类样品中是否含有DSP进行快速筛查,以满足当前食品安全实时监控的需要。
1 材料与方法
高纯度DSP单标OA标准溶液购自瑞士ALEXIS公司,质量为50 μg。将OA标准品以1 mL 100%甲醇(分析纯)溶解,制成OA母液并分装,-18℃保存待用。使用时,将母液以1 mL 100%甲醇(分析纯)稀释成OA 浓度为 2 μmol/L(约 1 610 ppb)的中间液,作为标准品稀释液及加标添加液。
用100%甲醇(分析纯)将上述母液配制成浓度分别为 80、100、160、200、240、300 μg/kg 的 OA 标准液,分别以酶联免疫法及蛋白磷酸酶抑制法进行检测,每个浓度的标准品重复检测3次。以市售新鲜海产贝类为基质,将贝类洗净后去除贝壳,取出所有组织。用滤纸吸干贝肉上的水分,充分捣碎混匀,5.0 g/管分装至50 mL离心管并高温灭活。向离心管中添加OA标准品添加液,使 OA 终浓度分别为 80、100、120、140、160、200、240、300 μg/kg,分别以酶联免疫法及蛋白磷酸酶抑制法进行检测。每个模拟样品重复检测5次。
蛋白磷酸酶抑制法检测选用TOXINLINE-DSP腹泻性贝类毒素试剂盒(上海千慕生物科技有限公司),样品前处理及检测步骤匀按照试剂盒使用说明书进行。使用TECAN M200型全波长多功能微孔板分析系统进行读数,激发波长(360±15)nm,发射波长(455±20)nm。以试剂盒中标准品OA浓度的对数值为X轴,荧光读数值为Y轴绘制标准曲线,再由标准曲线计算得出所测样品中的OA含量。
酶联免疫法检测选用ABRAXIS OKADAIC ACID(DSP)ELISA试剂盒,使用TECAN M200型全波长多功能微孔板分析系统于450 nm处进行读数。以试剂盒中标准品OA浓度为X轴,试剂盒中标准品BX与第一个标准品B0的百分比吸光度值B/B0(%)为Y轴绘制标准曲线,再由标准曲线计算得出所测样品中的OA含量。
2 结果与讨论
2.1 筛选检出限的提出
腹泻性贝类毒素是一类成分十分复杂的聚醚类或大环内酯类化合物,一般可分为:酸性成分OA(大田软海绵酸)及其天然衍生物DTX 1~3;中性成分聚醚内酯(PTXs);其它成分,如 YTX 等[1-3]。目前已经证实与腹泻有关的组分是其中的酸性成分OA及其衍生物DTX-1和DTX-3[3]。因此,选择OA作为腹泻性毒素的标准溶液进行加标回收或制备模拟染毒样品具有较强的代表性。
目前已有13个国家或组织制定了贝类中DSP的限量标准,各国对于DSP的限量标准多数基于OA及其衍生物的小鼠i.v.LD50和i.p.LD99量而制定。如FDA、日本、加拿大、澳大利亚、新西兰、朝鲜等制定的DSP 限量为 20 μg/100 g(200 μg/kg);EU、德国、葡萄牙、爱尔兰、英国等制定的DSP中主要毒性成分OA限量为 16 μg/100 g(160 μg/kg)[11]。我国 GB/T 18406.4-2001《农产品安全质量无公害水产品安全要求》规定DSP的限量为 60 μg/100 g(600 μg/kg)。参考国内外对贝类中DSP的限量要求,并考虑到本文所涉及两种方法的实际检出限以及该两种方法主要应用于筛选检测的特点,将贝类产品中DSP的阳性检出限暂定为200 μg/kg。即将筛查结果低于200 μg/kg的样品视为DSP阴性,而检测结果高于这一数值的样品视为可疑阳性。
2.2 标准溶液检测结果
配制一系列不同浓度的OA标准液,使用上述所述两种方法进行检测。结果如表1、表2所示。
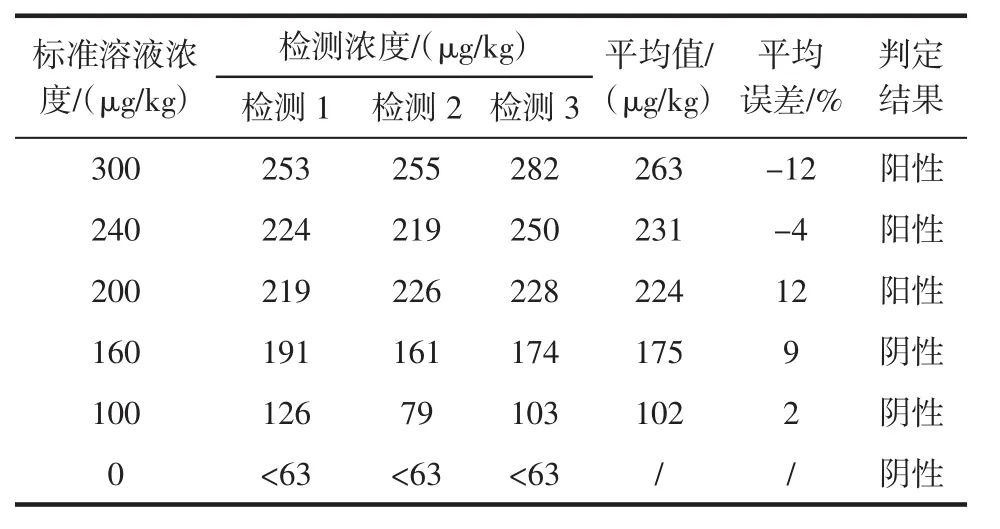
表1 蛋白磷酸酶抑制法对OA标准溶液检测结果Table 1 The dictation result of OA standard solution by protein phosphatase inhibition assay
由表1、表2可见,分别使用蛋白磷酸酶抑制法和酶联免疫法对同一浓度的OA标准溶液进行三次测试,结果具有较好的重复性。检测所得出的判定结果与标准溶液浓度一致,即:标准溶液浓度≥200 μg/kg的,检测结果均为阳性;标准溶液浓度低于200 μg/kg的,检测结果为阴性,未出现阴阳性颠倒错判的情况。三次检测平均值与实际浓度之间的误差在±13%之间,即本方法的检测准确率高于85%。当OA浓度在200 μg/kg附近时,判定结果可能出现假阴性或假阳性的情况。
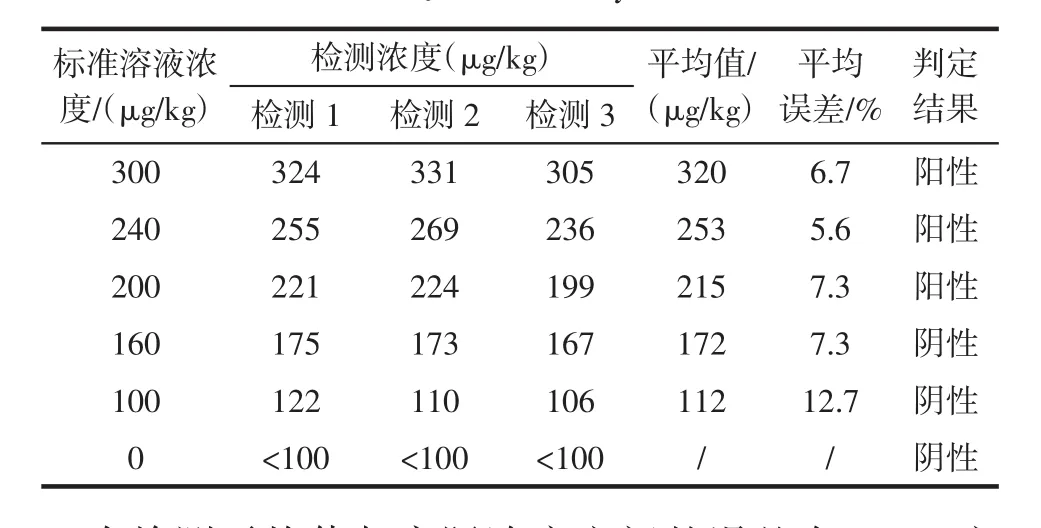
表2 酶联免疫法对OA标准溶液检测结果Table 2 The dictation result of OA standard solution by ELISA assay
2.3 模拟阳性样品检测结果
考虑到实际检测的对象为贝类样品,标准溶液与实物贝类样品可能会有一定差异。因此选用市售贻贝贝肉,经高温灭活后添加OA标准溶液,配制成不同浓度的模拟阳性样品,使用上述所述两种方法进行检测。结果如表3、表4所示。
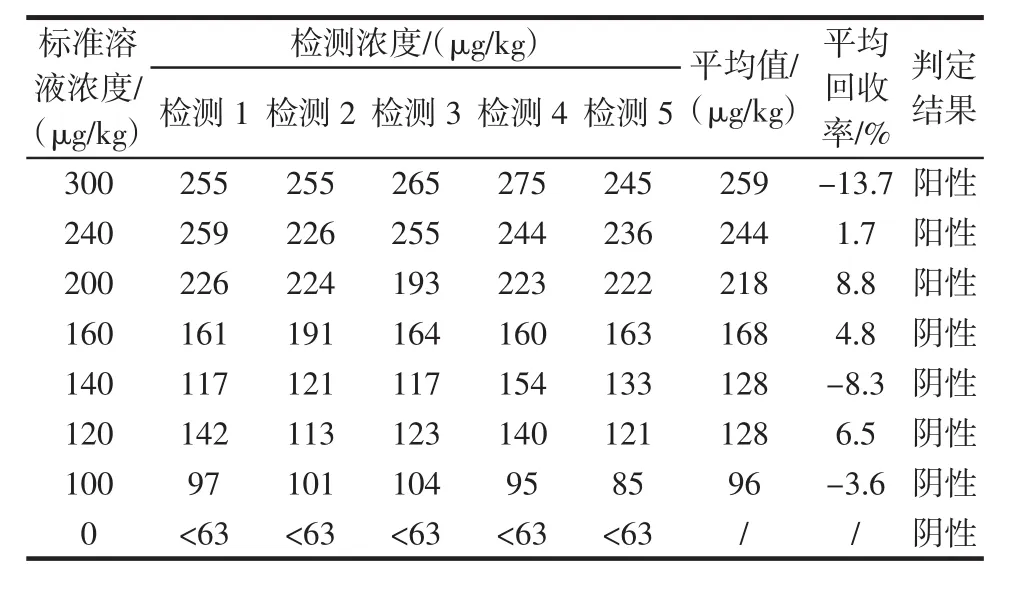
表3 蛋白磷酸酶抑制法对模拟阳性样品检测结果Table 3 The dictation result of man-made poisonous samples by protein phosphatase inhibition assay
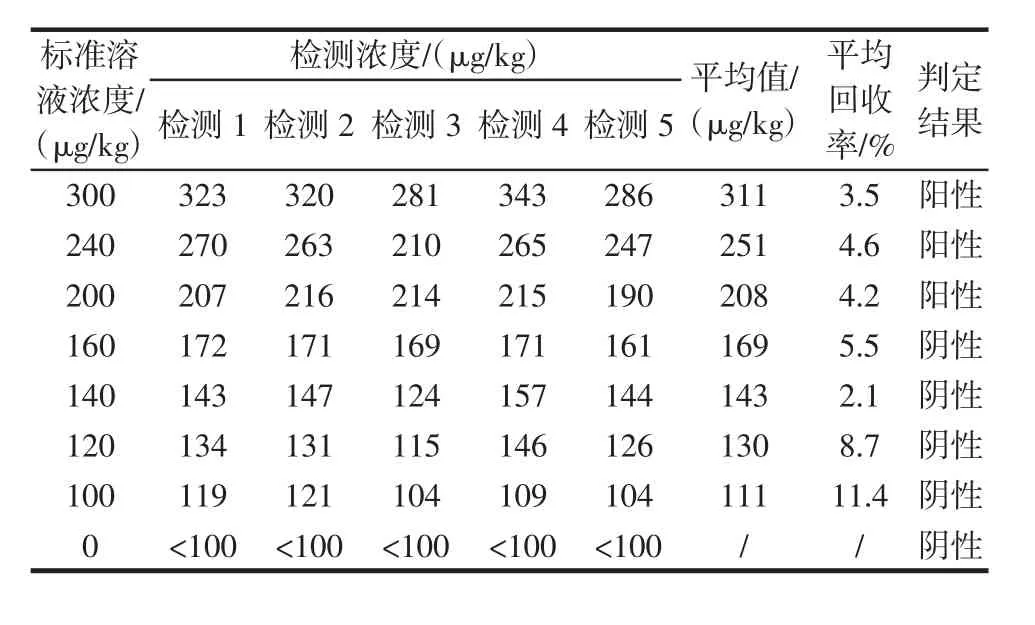
表4 酶联免疫法对模拟阳性样品检测结果Table 4 The dictation result of man-made poisonous samples by ELISA assay
由表3、表4可见,分别使用蛋白磷酸酶抑制法和酶联免疫法对同一浓度的模拟阳性样品重复5次检测,结果显示了良好的重复性。两种方法的检测的平均加标回收率在±14%之间。检测的阴阳性判定结果与加标情况相一致,即:加标浓度在200 μg/kg及以上的,检测结果均为阳性;加标浓度低于200 μg/kg的,检测结果为阴性,未出现阴阳性颠倒错判的情况。
以3种不同市售贝类为基质,经灭活处理后,制成OA浓度为100、240 μg/kg的模拟样品,分别交由3名检验人员在盲样的情况下使用蛋白磷酸酶抑制法和酶联免疫法分别进行检测。结果如表5、6所示。
由表5、表6可见,两种方法对3种盲样样品的检测结果均显示出良好的重复性与较高的回收率。在因阳性判断方面,3名检验人员的检测结果完全一致,即:对于加标浓度为100 μg/kg的样品,判定结果均为阴性;加标浓度为240 μg/kg的样品,判定结果均为阳性。此结果证明,对于DSP含量明显高于或低于筛选检出限(200 μg/kg)的样品,无论使用蛋白磷酸酶抑制法或是酶联免疫法检测,判定结果都是完全正确的。
综合表1~表6的结果显示,使用蛋白磷酸酶抑制法和酶联免疫法都可以对样品中是否含有腹泻性贝类毒素(DSP)进行定性检测,并可对样品中贝类毒素的大致含量进行测定。这两种方法的判定准确率高,仅当DSP浓度在(200±20)μg/kg时,才有可能出现假阴性或假阳性,因此都不失为行之有效的快速筛选方法。使用这两种筛选方法,以200 μg/kg为阳性筛选检出限,可以做到将大批量的样品快速筛查,检测结果≤200 μg/kg的样品,可直接判定为DSP阴性;而检测结果>200 μg/kg的样品应判定为DSP可疑阳性,显示该水产品可能受到腹泻性贝类毒素DSP的污染。这样,就可以在尽可能短的时间内排除绝大部分的阴性样品,并筛选出可能受到污染的可疑阳性样品,送交有条件的实验室用其他方法进行进一步确认。从而在最大范围内节省检测时间与人力成本,提高检测效率。
2.4 检验原理及优势比较
蛋白磷酸酶抑制法检测腹泻性贝类毒素DSP的基本原理是:蛋白磷酸酶可以水解为一种特殊的酶作用物并产生荧光反应,而DSP毒素的主要活性成分OA、DTX是蛋白磷酸酶的有效抑制剂[12],能不同程度地抑制磷酸酶的活性,其抑制程度与含量相关。由于该检测原理基于DSP的生物毒性机理,测定的是DSP中的毒性活性成分总量,能较真实地反映出样品的毒性大小,检测所产生的假阳性率低。值得指出的是,有研究表明,有些种类的贝类中可能含有某种成分能降低DSP的水解效率,使得本检验方法未必适合所有的贝类样品[13]。就检测时间与成本而言,使用商业试剂盒,蛋白磷酸酶抑制法对于单个样品的检测时间低于4 h,每个样品的检测成本为150元左右。但检测中所使用的磷酸酶、底物等试剂均为一次性现配现用,从某种程度上提高了该方法的检测成本。此外,该检测方法需要用到价格昂贵的荧光酶标仪(全波长多功能微孔板分析系统),这也限制了该方法在基层检验机构的开展。
酶联免疫法检测DSP的基础是抗原抗体反应,微孔板包被有针对DSP抗体的捕捉抗体,加入标准品或样品提取液及DSP酶标记物,游离DSP与DSP标记物竞争DSP抗体,同时DSP抗体与捕捉抗体连接。再经洗涤、发色、孵育显色等步骤,最后于450 nm处测量样品与标准品的吸光度值,通过绘制标准曲线进行定量计算。目前,只有OA有商用的配套系列试剂盒出售,所采用的抗体仅与OA反应,但不与其他毒物如DTX、PTX、YTX反应,因此专一性较强。酶联免疫法适用于所有的贝类样品。该方法的检测时间为4 h~6 h,单个样品的检测成本低于100元,且对检测仪器要求较低。但由于方法的局限性,在实际检测过程中,检验结果易受到样品基质的影响而产生较多的假阳性。
3 结论
综上所述,使用蛋白磷酸酶抑制法及酶联免疫法可以对样品中是否含有腹泻性贝类毒素(DSP)进行定性检测,并可以对样品中贝类毒素的大致含量进行测定。与传统的小鼠法相比,这两种方法都具有耗时较短,重复性较好的优点。本文所提出的阳性筛选检出限(200 μg/kg)远低于我国相关标准的规定(600 μg/kg),说明该二方法均可作为较理想的筛选方法,在尽可能短的时间内排除绝大部分的阴性样品,并筛选出可能受到污染的可疑阳性样品,可以用于满足世博会等重大场合对食品安全保障的需求。此外,由于天然含腹泻性贝类毒素DSP样品不易获得,缺乏由天然阳性样品中得出的检测数据,还需要在后期检测过程中对本检测方法进行完善与补充。
:
[1]陈则玲,付云娜,巩宁.腹泻性贝毒及其高效液相色谱检测方法.海洋通报,2000,19(1):73-78
[2]丁君.赤潮毒素中腹泻性贝毒和麻痹性贝毒的研究及进展[J].大连水产学院学报,2001,25(3):212-218
[3]Burgess V,Shaw G.Pectenotoxins-an issue for public health(A review oftheircomparative toxicology and metabolism)[J].Environment international,2001,27:275-283
[4]杨维东,彭喜春,刘洁生,等.腹泻性贝毒研究现状[J].海洋科学,2005,29(5):66-72
[5]李伟才,栾刚,李立,等.我国沿海部分海区贝毒毒素的调查[J].海洋科学,2000,24(9):19-22
[6]刘宁,潘国伟,李春盛,等.辽东湾赤潮污染海区贝类软海绵酸的染毒情况调查分析[J].中国公共卫生,1999,15(3):209-210
[7]周名江,朱明远,张经.中国赤潮的发生趋势和研究进展[J].生命科学,2001,13(2):54-59
[8]Yasumoto T,Oshima Y,Yamaguchi M.Occurrence of a new shellfish poisoning in the Tohoku District[J].Bull Jpn Soc Sci Fish,1978,44:1249-1255
[9]曹际娟,卫锋,马惠蕊,等.贝类毒素检测技术及研究进展[J].检验检疫科学,2004,14(1):53-56
[10]胡雪莲,曲勤凤,顾文佳.腹泻性贝类毒素DSP的磷酸酶抑制检测法研究[J].食品工业科技,2011,247(11):437-440
[11]赵晓芳,计融.国内外腹泻性贝类毒素管理控制措施的比对分析[J].中国热带医学,2006,6(2):350-354
[12]Burgess V,Shaw G.Pectenotoxins-an issue for public health(A review of their comparative toxicology and metabolism)[J].Environment International,2001,27:275-283
[13]Villar-González,Rodríguez-Velasco M L,Ben-Gigirey B,et al.Assessment of the hydrolysis process for the determination of okadaic acid-group toxin ester:Presence of okadaic acid 7-0-acyl-ester derivates in Spanish shellfish[J].Toxion,2008,51(5):765-773
