天然水溶性甲壳素溶液的性质
2012-09-05刘廷国李斌
刘廷国,李斌
(1.华中农业大学食品科技学院,湖北武汉 430070;2.池州学院材料与化学工程系,安徽池州 247100)
壳聚糖(chitosan)是甲壳素(chitin)的部分N-脱乙酰产物。甲壳素在自然界中的生物合成量仅次于纤维素,估计每年自然界生物合成量将近1011t[1]。是迄今发现的唯一带正电荷的天然碱性多糖,具有多种特殊生物活性,安全无毒,对环境无公害。广泛应用于农业、工业、畜牧业、环境保护、日用化工、化学分析以及食品、医药卫生、生物工程等领域[2-3]。
由于分子内、分子间存在强氢键相互作用,甲壳素和壳聚糖均不溶于普通溶剂,限制了其广泛应用[4-5]。通过均相脱乙酰化或均相乙酰化控制脱乙酰度在50%左右制备的半脱乙酰甲壳素能溶于水中[6-7],但对其性质研究不够深入,目前仅限于实验室少量制备,尚不能大规模用于生产。利用冻融循环处理制备高浓度甲壳素均相溶液,通过温和条件下的均相脱乙酰反应,制备天然水溶性甲壳素,研究其溶液性质,为天然水溶性甲壳素的制备积累基础数据。
1 材料与方法
1.1 材料与设备
甲壳素(食品级,DDA=21.11%,Mη=1.20×106,过80目筛):购自浙江金壳生物化学有限公司。除特别说明外,实验用水均为双蒸水,所用化学试剂均为分析纯。
冰柜(BC/BD-190S,控温范围:4℃~-37℃,上下波动0.5℃):青岛海尔特种电冰柜有限公司;冷冻离心机(BC-010_TY2265):美国 Beckman公司;紫外光谱仪(UV-1700):日本Shimadzu公司;圆二色谱仪(J810):日本Jasco公司。
1.2 水溶性甲壳素的制备
参照文献[8]方法制备天然水溶性甲壳素(Water SolubleChitin,WSC),脱乙酰度(DDA)=(51.68±0.12)%;利用非均相脱乙酰法制备半脱乙酰甲壳素(Half Deacetylated Chitin,HDC),DDA=(49.51±0.16)%。
1.3 WSC的紫外光谱研究
WSC分别溶于0.01 mol/L乙酸(HAc)、HCl和去离子水中,分别配成1.0 mg/mL溶液,室温平衡12 h,使用1 cm石英比色皿上机测定样品溶液在190 nm~400 nm的紫外吸收光谱,考察溶剂对紫外光谱的影响。分辨率1 nm,扫描速率very slow,重复扫描3次。按相同方法配置样品溶液分别考察放置时间和样品脱乙酰度对紫外光谱的影响。
1.4 圆二色谱(Circular Dichroism,CD)
WSC分别溶于去离子水和0.01 mol/L HAc中,HDC溶于0.01 mol/L HAc中,配成1.0 mg/mL溶液,以溶剂为参比,使用0.1 mm 400 μL石英比色池测定样品溶液在190 nm~300 nm的圆二色谱。仪器先通N2(3L/min~5L/min)预热5min,测试中继续通N2(10L/min~15 L/min),温度 18℃,分辨率 0.1 nm,扫描速度200 nm/min,累加 10次。
2 结果与分析
2.1 紫外光谱
一般多糖分子结构中不存在生色团,更没有共轭基团,很少用紫外光谱研究其结构。甲壳素却是1种特殊的多糖,每个糖残基的C2位置上有1个乙酰氨基,是生色团,具有紫外吸收。壳聚糖的乙酰基虽然被脱除,但残存的少量乙酰基仍然会在紫外区产生吸收。研究者根据壳聚糖的这种特性,建立了紫外光谱法测定壳聚糖脱乙酰度的方法。直接用UV法测定壳聚糖脱乙酰度简便、快捷,可以测定脱乙酰度60%以上的壳聚糖。刘长霞等人在此基础上发展了一阶导数紫外光谱法、多波长回归紫外光谱法等测定壳聚糖脱乙酰度的方法,比直接测定重现性好、准确度高、干扰少[9-10]。
图1给出了WSC在3种溶剂中的紫外光谱,在250 nm~800 nm范围内无任何吸收。在208 nm~270 nm溶剂对紫外光谱几乎无影响,在190 nm~208 nm对其影响较大,HAc与H2O的吸收极其相似,仅仅在吸光度大小上有差异,而HCl对其影响更为明显,峰值不变、峰型变窄,这可能与溶剂极性不同有关。在208 nm~212 nm,吸光度值与波长呈线性关系,在水溶液中的拟合方程为:A=-0.328 6λ+71.119(R2=0.996 6)。刘长霞等人报道,不同浓度的N-乙酰基-D-葡萄糖胺溶液在波长200、201、202、203 nm处的吸光度值对波长作图得到线性关系良好的1组直线,其斜率与对应溶液的浓度成正比,可以根据斜率确定壳聚糖的脱乙酰度[9]。也就是说,如果样品脱乙酰度确定,则斜率应该与样品浓度呈线性关系。
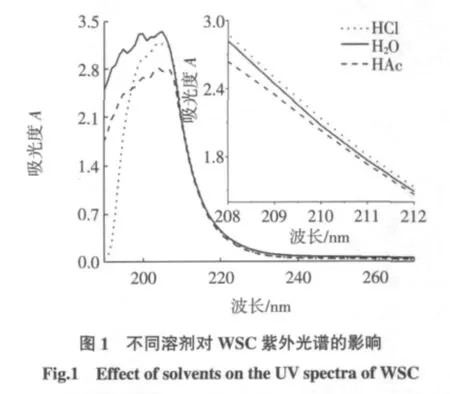
温度在20℃~30℃时,壳聚糖水溶液放置不同时间的吸光度值与波长的关系基本不变(见表1)。实验选择在室温条件下放置12 h后测定。

表1 时间对WSC溶液吸光度的影响Table 1 Effect of time on the absorption of WSC solution
水溶性样品的DDA在50%左右,实验选定的样品脱乙酰度为46%~54%,在此范围内乙酰氨基含量差别极小,因此由DDA引起的吸光度值与波长的拟合方程的斜率变化极小,可以忽略不计。
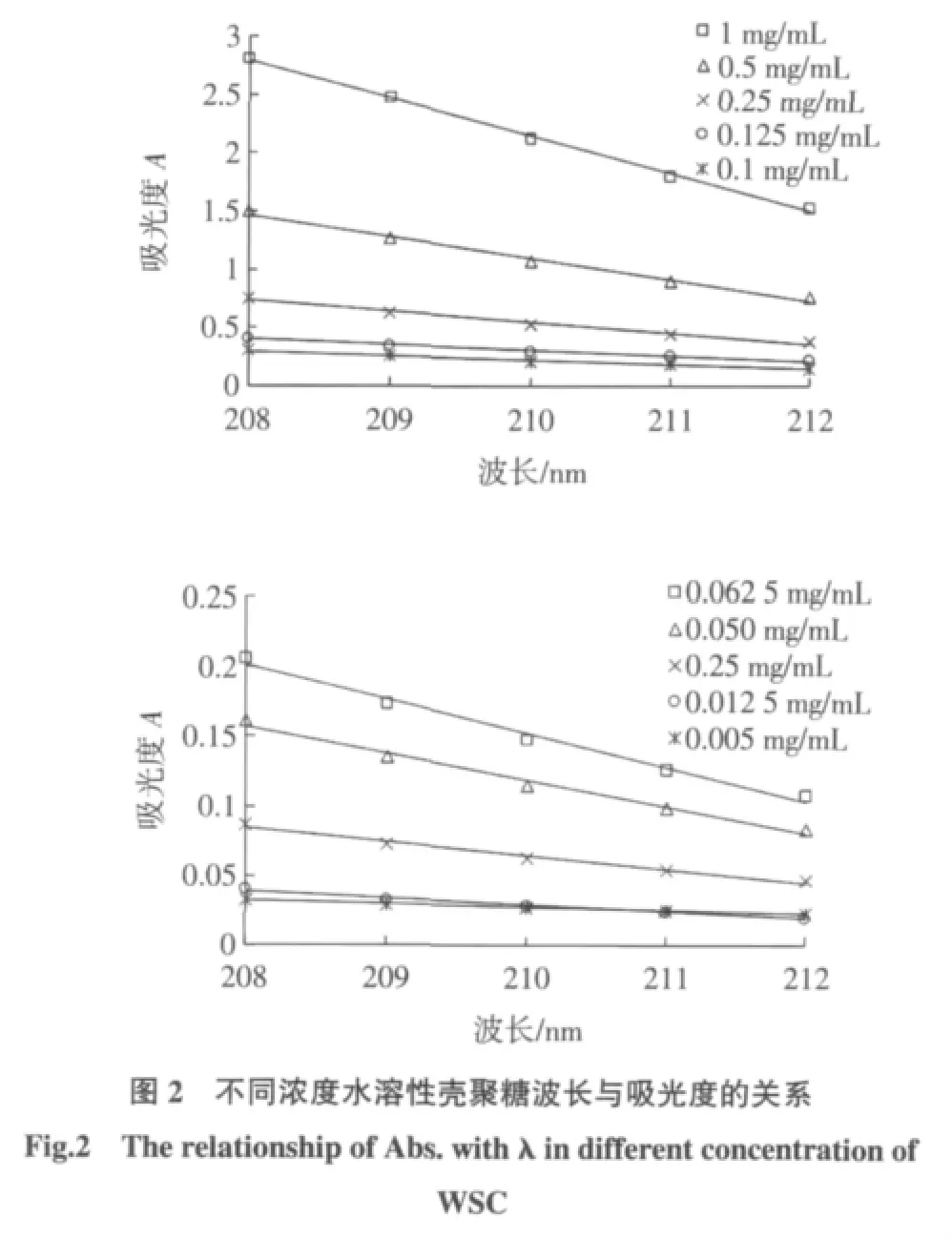
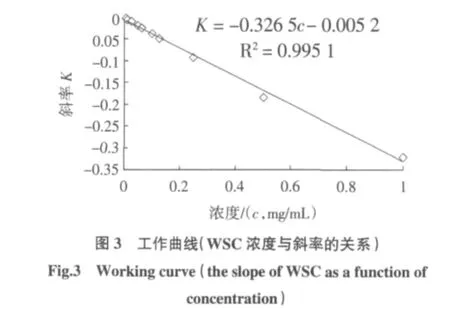
按照上述实验方法进行操作,绘制工作曲线,准确配置1.0 mg/mL的WSC水溶液,并逐步稀释成不同浓度的待测溶液,室温静置平衡12 h后上机测定,在选定波长处的吸光度值对波长作图得到线性关系良好的1组直线,见图2,线性相关系数大于0.990 0(n=5)。利用其斜率与对应溶液的浓度成正比绘制工作曲线。工作曲线的回归方程为K=-0.326 5c-0.005 2,相关系数R2=0.995 1(n=10),线性范围为0.005 mg/mL~1.000 mg/mL,如图3所示。然而当样品浓度低于0.025 mg/mL时,选定波长范围内的吸光度值小于0.1,而浓度高于0.25 mg/mL时,吸光度值又大于1,所以最佳线性范围为0.025 mg/mL~0.250 mg/mL。
2.2 圆二色谱分析
当单色左旋与右旋的圆偏振光通过某种手性样品时,该样品对左、右旋圆偏振光的吸收不同,这种现象叫做圆二色性。其差值△A=△AL-△AR称为圆二色值,按波长扫描就得到了圆二色谱(CD谱)。圆二色光谱仪通过测量生物大分子的圆二色光谱从而得到生物大分子的二级结构,或者确定某些基团如羰基等在手性分子中的位置,是简便和快捷的获得生物大分子结构的手段之一,而且在某些情况下是其它光谱所无法替代的。
甲壳素分子中含有乙酰基团,其中的羰基是发色团,虽然其本身是对称的,但处在不对称的环境中也会产生Cotton效应,通常在近紫外区会发生n→π*跃迁,产生1个弱吸收带,属R带吸收。
图4是WSC和HDC在0.01 mol/L乙酸溶液中的圆二色谱图,两者均在190 nm~240 nm间形成1负Cotton效应(长波方向为负峰,短波方向为正峰),两者峰形、峰位置不变,但WSC的正、负峰强度均小于HDC的。这个Cotton效应是由于羰基吸收产生的,曾有研究者认为吸收峰强度与乙酰基含量有关,而与α、β异头碳构型、分子链长度、离子强度和pH无关[11]。然而实验条件下的2个样品DDA无显著差异,也就是说乙酰基含量无显著差异,导致二者吸收峰强弱不同的主要原因可能是由于二者在溶液中的构象不同,WSC在HAC溶液中分子链更为伸展一些,而HDC可能存在更多的螺旋结构或氢键相互作用[12]。
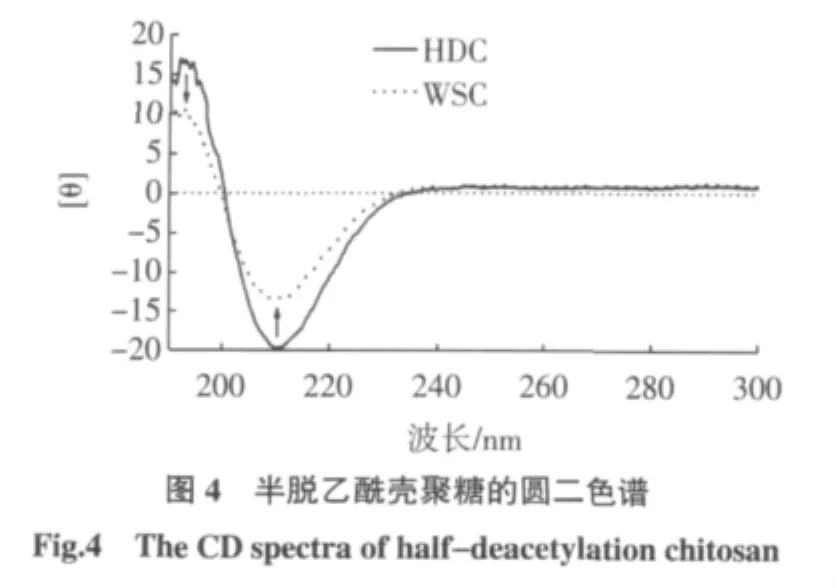
图5给出的是WSC分别在水溶液和0.01 mol/L HAc溶液中的圆二色谱,在2种溶剂中都产生了相同的负Cotton效应,与HDC相比波长没有发生偏移,但是在水溶液中的Cotton效应却弱于酸溶液中的。可能原因是WSC在水中氢键相互作用更少,更多的以伸展的高分子链形式存在;而其在酸溶液中则以聚电解质形式存在,聚电解质在溶液中的自组装会形成一定螺旋结构,因而产生Cotton效应较强的现象。说明冻融循环和均相脱乙酰打破了分子间强氢键相互作用,使WSC的空间结构更为舒展而更易溶于水中,且较少呈现螺旋结构和无规卷曲[12]。

3 结论
利用冻融循环处理结合均相脱乙酰制备了天然水溶性甲壳素,研究了样品在不同溶剂中的紫外吸收光谱和圆二色谱。3种溶剂中,在208 nm~212 nm范围内样品溶液吸光度值与波长呈线性关系,样品脱乙酰度确定时,直线斜率与样品浓度呈线性关系。圆二色谱显示,在稀酸溶液中水溶性样品比脱乙酰度相当的非水溶性样品,分子链更加伸展而易溶于水中。
:
[1]董炎明,黄训亭,赵雅靑,等.甲壳类液晶高分子研究——低分子量壳聚糖溶致液晶性及分子量对液晶临界浓度的影响[J].高分子学报,2006(1):16-20
[2]Baxter S,Zivanovic S,Weiss J.Molecular weight and degree of acetylation of high-intensity ultrasonicated chitosan[J].Food hydrocolloids,2005,19:821-830
[3]No H K,Park N Y,Lee S H,et al.Antibacterial activity of chitosans and chitosan oligomers with different molecular weights[J].Int J Food Microbiol,2002,74:65-72
[4]康斌,常树全,汤晓斌,等.壳聚糖辐射降解产物的水溶性研究[J].化学工程,2007,35(4):49-52
[5]刘廷国,陈艳,李斌,等.冻融循环对甲壳素凝聚态结构和脱乙酰反应的影响[J].农业机械学报,2009,40(10):140-145
[6]Sannan T,Kurita K,Iwakura Y.Studies on chitin 2:Effect of deacetylation on solubility[J].Macromol Chem,1976,177(12):3589-3593
[7]Kurita K,Kamiya M,Nishimura S.Solubilization of a rigid polysaccharide:controlled partial N-acetylation of chitosan to develop solubility[J].Carbohyd Polym,1991,16(1):83-88
[8]刘廷国,査萍萍,杨凌霄,等.冻融循环制备天然水溶性甲壳素及其特性[J].华中科技大学学报:自然科学版,2011,39(1):70-74
[9]刘长霞,陈国华,孙明昆,等.多波长线性回归——紫外分光光度法测定壳聚糖的脱乙酰度[J].青岛海洋大学学报,2003,33(1):148-154
[10]Tan S C,Khor E,Tan T K,et al.The degree of deacetylation of chitosan:advocating the first derivative UV-spectrophotometry method of determination[J].Talanta,1998,45(4):713-719
[11]Farooqahamed S K,Acharya B,Rudrapatnam N T.Low molecular weight chitosans-preparation by depolymerization with Aspergillus nigerpectinase,andcharacterization[J].CarbohydrRes,2003,338(12):1283-1290
[12]王艳丽,张静.白术多糖的溶液构象及其变化[J].陕西师范大学学报:自然科学版,2012,40(3):98-103
