利用重组人α乳清蛋白和油酸大量快速制备高活性的HAMLET肿瘤杀伤复合物
2012-09-05张轶博曾瑞霞郑少鹏贾弘禔
张轶博 曾瑞霞 牛 静 郑少鹏 贾弘禔 丁 卫*
(1.首都医科大学生物化学与分子生物学系,北京100069;2.辽宁医学院免疫与病原生物学教研室,辽宁锦州121001;3.辽宁医学院人体解剖教研室,辽宁锦州121001)
可致肿瘤细胞死亡的人α乳清蛋白(human αlactalbumin made lethal to tumor cells,HAMLET)是一种以人源α乳清蛋白为主要成分、可导致肿瘤大量死亡的复合物。HAMLET最初在人乳抑菌效应的研究被偶然发现,继而被证实为一种对肿瘤细胞有强烈杀伤作用的效应分子[1]。在使用不同细胞系的研究[2]中发现HAMLET具有选择性诱导转化细胞、部分胚胎细胞和淋巴细胞发生凋亡的效应,而对成熟的分化细胞没有显著的毒性作用。进一步的研究[3]表明HAMLET具有广谱的抗肿瘤作用,能够杀伤超过40种不同组织来源的肿瘤细胞系。在动物在体模型和临床预试验[4]中,HAMLET对人神经胶质瘤,皮肤乳头状瘤[5]及膀胱癌[6]等均有较好的疗效,且无明显的不良反应[7]。鉴于HAMLET在肿瘤治疗中的潜在临床应用前景,当前对HAMLET的研究开始关注其结构特点,诱导肿瘤细胞死亡的机制以及其规模化生产流程的优化等方面。
HAMLET[8]或 BAMLET[9](bovine α-lactalbumin made lethal to tumors)的基本组成为人或牛源的α乳清蛋白(human or bovine α-lactalbumin,HLA or BLA)与油酸(oleic acid,OA)按一定比例复合形成的不均一性分子。Svensson M等[8]通过体外离子交换层析方法获得了HAMLET,并且明确了其作为人乳中的抗肿瘤活性成分。该层析制备方法可得到结构稳定的HAMLET复合物,其活性可在真空干燥后长期保存。但是这种方法制备过程比较繁琐,材料和设备需求复杂,且耗时较长。此后,多个研究小组尝试建立更简易的HAMLET制备方法,多采用脱钙后的apo-HLA与OA在不同的条件下进行共同孵育或直接混合。虽然这些改进的方法也能够产生有活性的HAMLET或BAMLET,但是无一例外对α乳清蛋白的用量和质量需求提出了更高的要求,同时也面临对进一步量产的挑战。
本课题组通过高效原核表达含His标签的重组人HLA蛋白,经NTA金属镍螯合柱一步纯化后,将EDTA除钙离子后的apo-rHLA与油酸水溶悬液直接混合,得到了具有高活性肿瘤细胞杀伤效应的HAMLET复合物;同时对其理化特性和生物学活性进行了较为全面的分析,并且与同类产物BAMLET进行了对比。
1 材料与方法
1.1 主要试剂
牛α-乳清蛋白纯品、异丙基-β-D-硫代吡喃半乳糖苷(isopropyl β-D-thiogalactoside,IPTG)购于 Sigma-Aldrich公司;8-苯胺基萘-1-磺酸(8-anilinonaphtalene-1-sulfonic acid,ANS)购自上海生工公司;镍离子亲和层析柱料购自GE公司;BCA蛋白质定量分析试剂盒购于Novagen公司;碘化丙啶(propidium iodide,PI)染料、DeadEndTMFluorometric TUNEL System、MTS试剂盒均为Promega公司产品;鼠抗人His标签抗体购于碧云天公司;IRDye800CW标记的羊抗鼠IgG购于LICOR公司;DAPI细胞核染料购于中杉金桥公司。反转录试剂盒 PrimeScript®RT reagent Kit购自大连TaKaRa公司;Trizol等其余试剂为分析纯产品,购于北京鼎国生物技术有限公司。
1.2 主要仪器设备
紫外凝胶成像分析系统(Bio-Rad公司);Odyssey红外荧光扫描成像系统(LI-COR Biosciences公司);Spectra Max M2多功能分光光度仪(Molecular Devices公司);DM 5000B荧光显微镜以及Leica DMIRB倒置荧光显微成像系统,(Leica公司)。
1.3 人α乳清蛋白的pET30a(+)原核表达载体的构建
MCF-7乳腺癌细胞的总RNA由经典的Trizol法提取,经反转录后获得MCF-7细胞的cDNA文库。通过PCR扩增编码人α乳清蛋白成熟肽链的核酸序列,引物的设计序列为 F:5'-GGGAATTCcatatgAAGCAATTCACAAAATGTGAGCTG-3';R:5'-CCGctcgag-CAACTTCTCACAAAGCCACTGTTCC-3',小写序列为酶切位点。扩增片段纯化后经NdeⅠ和XhoⅡ双酶切连接入pET30a(+)质粒,完成带His融合C端标签的人α乳清蛋白原核表达载体的构建,经双酶切鉴定和DNA测序分析证实其序列完全正确。
1.4 重组人α乳清蛋白的表达和纯化
用重组质粒转化BL21大肠杆菌,经IPTG(0.5 g/L)在37℃诱导2 h后,离心收集细菌,并重悬于PBS中。超声裂菌后,高速离心分别得到上清和沉淀。以Gu-MCAC变性缓冲液 (20 mmol/L Tris-HCl,0.5 mol/L NaCl,6 mol/L guanidine hydrochloride,pH 8.0)溶解富含目的蛋白的沉淀,通过逐滴加入复性缓冲液(20 mmol/L Tris-HCl,0.5 mol/L NaCl,1 mmol/L CaCl2,1.6 mol/L guanidine hydrochloride,5 mmol/L reduced glutathione,0.5 mmol/L oxidized glutathione,pH 8.0)并混匀至500 mL,得到可溶性的复性蛋白。复性蛋白加载至镍离子亲和层析柱,用梯度咪唑缓冲液洗脱,分段收集蛋白样品。定性和定量分析后,将含目的蛋白的洗脱液合并,以ddH2O透析,浓缩后真空冷冻干燥,于-20℃保存备用。
经15%SDS-PAGE蛋白凝胶电泳和考马斯蓝染色分别对有/无IPTG诱导菌在裂解前/后的不同组分,以及不同纯化阶段的蛋白产物进行检测,确定目的蛋白分布及纯度。
1.5 重组人α乳清蛋白和油酸复合物(rHAMLET)的制备与结构指标分析
重组HLA或BLA溶于1 mmol/L EDTA,20 mmol/L Tris-HCl,pH 8.0溶液中,4℃过夜以去除Ca2+。经蛋白超滤管浓缩至2 mg/mL,制成Apo-HLA溶液。在此溶液中逐滴加入OA储存液(210 mmol/L),并不断涡旋至HLA和OA的摩尔比为1∶15,然后在60℃加热10 min,冷却至室温后离心去除多余OA。溶液经0.22 μm的滤器过滤后为HAMLET,分装保存于-80℃。HAMLET使用前解冻,在60℃预热10 min。
将100 μL 0.2 g/L rHLA,rHAMLET,BAMLET和0.088 g/L OA的0.9%NaCl溶液,分别加入96孔板中,于37℃孵育1 h后,用分光光度计在250~300 nm的紫外谱段下读取扫描A值,并且绘制曲线。
将100 μL浓度为0.1 g/L上述不同样品与超过50倍摩尔浓度的疏水染料ANS混合,在37℃避光结合反应1 h,与蛋白结合后的ANS可在365 nm下被荧光激发,其在400~600 nm区间的发射光谱由Spectra Max M2分光光度计记录,并且通过Soft Max 5.2软件处理绘制光谱曲线。
1.6 细胞培养与形态观察
人乳腺癌MCF-7细胞系,人宫颈癌HeLa细胞系为本实验室冻存,并常规传代。MCF-7细胞和HeLa细胞在5%CO2,37℃条件下,于含10%胎牛血清的高糖DMEM培养基中培养至对数生长期的细胞用于接种和后续实验。
HeLa细胞接种2×104个/孔于12孔培养板(预先加入包被处理的圆形盖玻片),经5%CO2,37℃过夜培养至细胞贴壁。更换无血清的DMEM继续培养30 min后,加入终浓度为1 g/L BLA,rHLA,0.2 g/L BAMLET,rHAMLET或0.088 g/L OA,1 h后补充加入FBS至终浓度10%,继续培养6 h。在倒置荧光显微镜下观察各处理组的细胞形态变化并采集数字图像。小心将细胞以PBS清洗2次,然后以4%多聚甲醛固定20 min,用PBS重复漂洗2次。用含有DAPI染料的封片剂将铺有细胞的盖玻片安置于载玻片上,在荧光显微镜下观察细胞及细胞核的形态并采集图像。
1.7 细胞活力试验
HeLa细胞经胰酶消化后,以105个/孔接种于96孔板中,经5%CO2,37℃过夜培养至细胞贴壁。更换无血清的DMEM培养基孵育30 min后,分别将前述不同的处理或对照试剂加入各组样品并混匀。1 h后加入FBS至终浓度为10%。继续培养5 h后,加入MTS试剂,于37℃孵育4 h后,溶解并稀释样本,在波长490 nm下检测光度吸收值(A490)。
1.8 Western blotting分析
超声裂解菌液中原核表达蛋白通过BCA实验进行蛋白定量后,将等量的蛋白由15%SDS-PAGE凝胶电泳分离,电转至0.22 μm的PVDF膜上。经1.5%BSA室温封闭1 h后,将滤膜与鼠抗His标签的一抗4℃孵育过夜,然后与IRDye800CW标记的羊抗鼠IgG荧光二抗室温孵育1 h。充分漂洗后,经Odyssey成像系统扫描800 nm红外荧光图像并进行分析处理。
1.9 细胞凋亡实验
HeLa细胞接种2×104个/孔于12孔培养板,过夜5%CO2,37℃培养至细胞贴壁。换无血清的DMEM培养30 min,分别加入0.1,0.4 g/L rHAMLET和0.2 g/L BAMLET,1 h后添加FBS至终浓度10%,继续孵育6 h。以4%多聚甲醛固定细胞后,用propidium iodide进行预染色,然后采用Dead EndTMFluorometric TUNEL System试剂盒对处理后的HeLa细胞进行染色,检测细胞的凋亡,具体步骤参照供应商推荐的标准流程。
2 结果
2.1 pET30a-HLA-6×His原核表达载体的构建及鉴定
HLA是一种结合钙离子球形蛋白(图1A),其种属间的同源物高度保守,并且多种属的晶体结构已经解析。鉴于HLA在人乳腺细胞中高表达,我们从构建的MCF-7细胞cDNA文库中,针对HLA成熟肽编码序列设计引物,利用PCR扩增HLA编码片段,用以构建了pET30a-HLA-6×His原核表达载体(图1B)。所得到的PCR特异性扩增产物大小为392 bp(图1C)。利用限制性核酸内切酶(Nde I和Xhol I)双酶切及T4连接酶反应,将PCR产物克隆到pET30a(+)多克隆插入位点,转化宿主细菌后得到的质粒经酶切鉴定(图1D)和上海生工公司测序分析,插入序列与GenBank中HLA的cDNA编码序列完全一致。
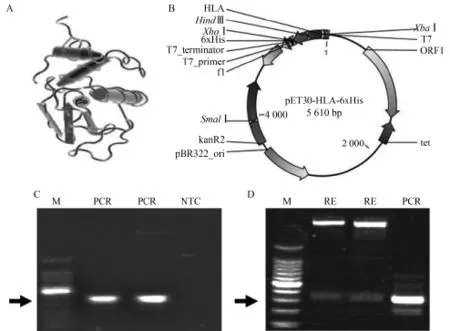
图1 人α-乳清蛋白pET30a(+)原核表达质粒的构建及鉴定Fig.1 Construction and characterization of prokaryotic expression plasmid of human α-lactalbumin using pET30a(+)plasmid vector
2.2 重组人α乳清蛋白的表达和纯化
将pET30a-HLA-6×His质粒转化大肠杆菌BL21后,通过对裂解菌液的蛋白电泳分析,可见在预期相对分子质量处有明显的条带,并且经过IPTG诱导后预期的条带显著增强(图2A)。为进一步确认外源质粒编码蛋白的表达,我们利用抗His标签的单克隆抗体进行了Western blotting检测,从而确定了HLA C端His标签融合蛋白的表达,特别是在IPTG诱导之后(图2B)。结果同时还显示大量表达的HLA融合蛋白定位于不溶性的包涵体,因而在纯化前需要经过变性-复性的过程。通过体外复性,可得到高丰度天然折叠(native fold)的重组蛋白。蛋白复性后经过镍离子亲和层析,我们从原核表达菌裂解产物中获得高纯度的重组HLA(图2C)。

图2 重组HLA(rHLA)的分离和纯化Fig.2 Isolation and purification of recombinant HLA
2.3 rHAMLET的制备和生化特征分析
通过对 HLA,apo-HLA和 BLA(PDB accession 1a4v,1f6s和1b9o)蛋白结构进行比较(图3A),发现HLA和BLA空间结构相似,因此我们选择BLA作为HAMLET制备和结构鉴定的阳性对照样品。在rHAMLET制备过程中,通过对37℃加热1 h处理后的rHAMLET及其各组对照样品进行蛋白电泳分析,我们发现rHLA,rHAMLET和apo-rHLA的蛋白组分无明显降解,除了单体蛋白(14~17 000)以外,与BAMLET相比,在25~30 000处可见更多的二聚体形成(图3B)。此结果表明我们制备HAMLET的方法具备较好的质量,并且提示可以通过自身的聚合现象介导针对细胞的活性功能。
通过对rHAMLET在250~300 nm下光谱曲线的变化分析,我们发现在0.9%NaCl中经37℃孵育1 h后的rHAMLET和BAMLET有相似光谱特征,并且与单纯的OA和复性后的rHLA存在显著不同(图3C)。通过进一步的ANS结合实验发现,rHAMLET和BAMLET的ANS结合活性显著增加,使ANS最大发射波长迁移至450 nm(图3D),而OA和rHLA则无此现象。结果显示rHAMLET、BAMLET与rHLA相比结构更为松散,可暴露出更多的疏水区域与OA结合并且与ANS作用,从而进一步表明了我们所制备的rHAMLET具有与BAMLET相似的结构基础,并参与发挥类似的生物学活性。
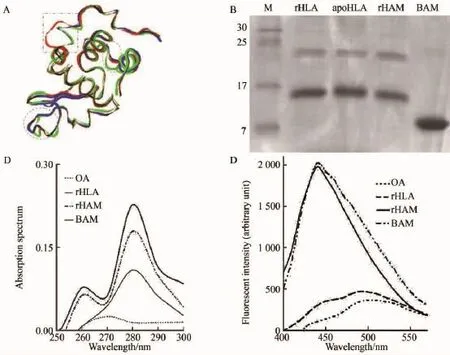
图3 重组HAMLET(rHAMLET)结构及生化性质与BAMLET的比较Fig.3 Biochemical analyses of rHAMLET in comparison with BAMLET produced by the classical method
2.4 rHAMLET对肿瘤细胞的杀伤活性检测
HeLa细胞经rHAMLET作用6 h后,通过MTS实验检测rHAMLET对肿瘤细胞的杀伤作用。结果显示rHAMLET和BAMLET作用的HeLa细胞的存活率(10~25%)显著低于高浓度的HLA,BLA以及OA处理组(80~90%)(图4A),同时,rHAMLET对HeLa细胞的杀伤作用呈现出与BAMLET处理组相似的剂量依赖性(图4B),表明我们用重组HLA制备的rHAMLET与用BLA纯品制备的BAMLET同样具有较强的肿瘤杀伤活性。
对rHAMLET和BAMLET处理后的HeLa细胞分别进行形态学观察,可见显著的细胞病变表现,胞体变圆、体积缩小、贴壁能力下降;同时由于部分细胞死亡,与HLA、BLA以及OA对照组相比细胞数显著减少。在rHAMLET和 BAMLET处理后,HeLa细胞经DAPI复染的细胞核与对照组相比,出现细胞核皱缩、形态变小、致密度增强、且部分细胞核出现碎裂等,提示细胞凋亡作用可能在很大程度上参与了rHAMLET和BAMLET的杀伤效应(图4C)。
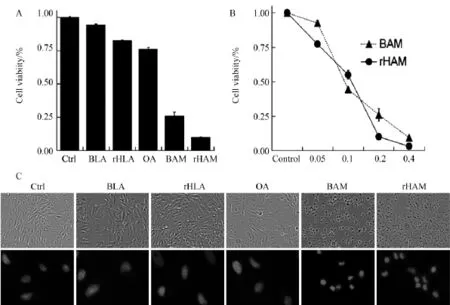
图4 rHAMLET对HeLa细胞的杀伤活性与BAMLET相似Fig.4 rHAMLET induced cell death in HeLa cells
2.5 rHAMLET可引起肿瘤细胞的凋亡
我们采用TUNEL染色法检测了rHAMLET和BAMLET处理后细胞的凋亡指标改变。TUNEL染色法在DNA的双链断裂产生缺口而出现的3'-OH末端,经脱氧核糖核苷酸末端转移酶(TdT)催化,将其末端标记上绿色荧光衍生物。实验过程中我们同时以PI的红色荧光复染视野中的全部细胞核,因而可以通过绿色与红色荧光的比例判断细胞出现凋亡的程度。结果如图5所示,HeLa细胞经rHAMLET和BAMLET作用6 h后,绿色荧光阳性的细胞显著增多,且与红色荧光的比例增加;同时,rHAMLET高浓度组比低浓度组相比,上述现象更加明显,表明rHAMLET和BAMLET都可以引起HeLa细胞的凋亡,细胞的凋亡随着rHAMLET浓度的升高而增多。
3 讨论
HAMLET作为一种体外形成的蛋白/脂类复合物,却可以选择性的杀伤肿瘤细胞,其作用机制一直受到人们的关注。在恶性胶质瘤细胞中,HAMLET可以吸附肿瘤细胞,迅速进入细胞核内并聚集,而在成熟的正常细胞中,HAMLET只有少量在细胞质中存在,主要在细胞膜上[4]。HAMLET在细胞内的聚集可导致线粒体膜通透性增强等细胞内的变化,引起细胞的凋亡[10-11],但是也有报道[12]显示细胞的死亡并未激活经典的凋亡途径。近来研究[13-14]发现原癌基因c-Myc和黏附分子 α-Actinin等[14]可以作为 HAMLET作用肿瘤细胞的靶点,为揭示HAMLET选择性杀伤肿瘤细胞的机制提供了线索。

图5 rHAMLET通过激活细胞凋亡诱导HeLa的细胞死亡Fig.5 Cell death of HeLa cells induced by rHAMLET treatments involved the activation of apoptosis as determined by TUNEL assays
HLA(人α乳清蛋白,相对分子质量142 000)为123氨基酸组成的酸性钙结合蛋白,主要有2个结构域:包括一个α-螺旋结构域包含4个α-螺旋(氨基酸残基5-11,23-34,86-98和106-110)和一个由3个β-折叠组成的结构域(41-43,48-50和55-56)(图1A)。HLA的C端游离,未参与其功能结构的形成和稳定。因此,在C末端引入His标签,如本研究所证实,没有影响HLA的结构复性以及形成活性rHAMLET的能力。
HLA肽链在乳腺细胞的内质网中折叠(folded)生成具有三级结构的蛋白。原核表达细胞中的人,牛等[15-16]种属的α乳清蛋白因折叠异常而主要存在于包涵体中,与本研究HLA-His融合蛋白表达的情况表现一致。HLA球形蛋白结构的稳定主要依赖于钙离子结合环(K79,D82,D84,D87和D88)和4个分子内二硫键(6-12,61-77,73-91 和28-111)[17-18],只有失去Ca2+后转变成熔球态结构的apo-HLA,才具有结合油酸并形成HAMLET的能力[15]。所幸的是,HLA可在合适的含Ca2+电解质中完成体外复性并恢复其天然结构,使得本研究中的rHLA依然能够用于HAMLET的制备,并表现出与天然蛋白相仿的细胞杀伤活力[8]。
我们的实验结果显示融合His标签的HLA能够在37℃条件下部分形成二聚体,多聚体形式的HLA,称为 MAL(multimers of α-lactalbumin),被认为很可能是HAMLET的活性组成,引起肿瘤细胞的凋亡[19]。OA的存在使rHAMLET暴露更多疏水结构,与Atri等[20]报道的LA-OA-60复合物结构变化相似,本研究中紫外光谱分析和ANS结合实验结果表明rHAMLET和BAMLET比rHLA形成更多的稳定二聚体。因此,虽然由rHLA和油酸所制备的rHAMLET复合物具有与经典的BAMLET相似的肿瘤杀伤活性[12],可以引起HeLa细胞的凋亡样的死亡,但在其细胞内代谢、生物学效应和作用机制等方面可能存在些微的不同。
HAMLET作为肿瘤细胞的选择性杀伤制剂逐渐引起越来越多的兴趣和重视,改善其制备策略和方法成为近年来相关研究的重点之一[21]。本研究所完成的通过融合His标签HLA制备HAMLET的方法,有效地解决了HLA在天然原料中丰度较低,高纯度纯化步骤复杂和困难等问题;同时与传统的离子交换层析方法相比更为简单,且生产成本更加经济。所得到的纯化rHLA,可以规模化用于apo-HLA的制备,并且非常适合在OA混合加热法[22-23],这一迄今为止最为简便的HAMLET生产方法中应用。本研究所提供的rHAMLET制备方法和产品,为HAMLET的规模化生产提供了可靠的依据,为HAMLET在更多、更广泛的使用,包括在大型动物模型中的应用等,奠定了重要的基础。与此同时,rHAMLET还可以帮助对HAMLET及其类似物的作用机制研究,如可通过anti-His抗体pull-down和后续的蛋白相互作用实验研究其在肿瘤细胞中的作用靶点等。因此,本研究在HAMLET功能机制探讨和在肿瘤临床前期应用中均有可观的潜在价值。
[1]Hakansson A,Zhivotovsky B,Orrenius S,et al.Apoptosis induced by a human milk protein[J].Proc Natl Acad Sci U S A,1995,92(17):8064-8068.
[2]Gustafsson L,Hallgren O,Mossberg A K,et al.HAMLET kills tumor cells by apoptosis:structure,cellular mechanisms,and therapy[J].J Nutr,2005,135(5):1299-1303.
[3]Hallgren O,Aits S,Brest P,et al.Apoptosis and tumor cell death in response to HAMLET(human alpha-lactalbumin made lethal to tumor cells)[J].Adv Exp Med Biol,2008,606:217-240.
[4]Fischer W,Gustafsson L,Mossberg A K,et al.Human alpha-lactalbumin made lethal to tumor cells(HAMLET)kills human glioblastoma cells in brain xenografts by an apoptosis-like mechanism and prolongs survival[J].Cancer Res,2004,64(6):2105-2112.
[5]Gustafsson L,Leijonhufvud I,Aronsson A,et al.Treatment of skin papillomas with topical alpha-lactalbumin-oleic acid[J].N Engl J Med,2004,350(26):2663-2672.
[6]Mossberg A K,Wullt B,Gustafsson L,et al.Bladder cancers respond to intravesical instillation of HAMLET(human alpha-lactalbumin made lethal to tumor cells)[J].Int J Cancer,2007,121(6):1352-1359.
[7]Mok K H,Pettersson J,Orrenius S,Svanborg C.HAMLET,protein folding,and tumor cell death[J].Biochem Biophys Res Commun,2007,354(1):1-7.
[8]Svensson M,Hakansson A,Mossberg A K,et al.Conversion of alpha-lactalbumin to a protein inducing apoptosis[J].Proc Natl Acad Sci U S A,2000,97(8):4221-4226.
[9]Svensson M,Fast J,Mossberg A K,et al.Alpha-lactalbumin unfolding is not sufficient to cause apoptosis,but is required for the conversion to HAMLET(human alpha-lactalbumin made lethal to tumor cells)[J].Protein Sci,2003,12(12):2794-2804.
[10]Kohler C,Gogvadze V,Hakansson A,et al.A folding variant of human alpha-lactalbumin induces mitochondrial permeability transition in isolated mitochondria[J].Eur J Biochem,2001,268(1):186-191.
[11]Zhang M,Yang F,Jr.,Yang F,et al.Cytotoxic aggregates of alpha-lactalbumin induced by unsaturated fatty acid induce apoptosis in tumor cells[J].Chem Biol Interact,2009,180(2):131-142.
[12]Hallgren O,Gustafsson L,Irjala H,et al.HAMLET triggers apoptosis but tumor cell death is independent of caspases,Bcl-2 and p53[J].Apoptosis,2006,11(2):221-233.
[13]Storm P,Aits S,Puthia M K,et al.Conserved features of cancer cells define their sensitivity to HAMLET-induced death;c-Myc and glycolysis[J].Oncogene,2011,30(48):4765-4779.
[14]Trulsson M,Yu H,Gisselsson L,et al.HAMLET binding to alpha-actinin facilitates tumor cell detachment[J].PLoS One,2011,6(3):e17179.
[15]Pettersson-Kastberg J,Mossberg A K,Trulsson M,et al.alpha-Lactalbumin,engineered to be nonnative and inactive,kills tumor cells when in complex with oleic acid:a new biological function resulting from partial unfolding[J].J Mol Biol,2009,394(5):994-1010.
[16]Ishikawa N,Chiba T,Chen L T,et al.Remarkable destabilization of recombinant alpha-lactalbumin by an extraneous N-terminal methionyl residue[J].Protein Eng,1998,11(5):333-335.
[17]Iyer L K,Qasba P K.Molecular dynamics simulation of alpha-lactalbumin and calcium binding c-type lysozyme[J].Protein Eng,1999,12(2):129-139.
[18]Pettersson J,Mossberg A K,Svanborg C.alpha-Lactalbumin species variation,HAMLET formation,and tumor cell death[J].Biochem Biophys Res Commun,2006,345(1):260-270.
[19]Hakansson A,Andreasson J,Zhivotovsky B,et al.Multimeric alpha-lactalbumin from human milk induces apoptosis through a direct effect on cell nuclei[J].Exp Cell Res,1999,246(2):451-460.
[20]Atri M S,Saboury A A,Moosavi-Movahedi A A,et al.Structure and stability analysis of cytotoxic complex of camel alpha-lactalbumin and unsaturated fatty acids produced at high temperature[J].J Biomol Struct Dyn,2011,28(6):919-928.
[21]Zhang Y B,Wu W,Ding W.From HAMLET to XAMLET:The molecular complex selectively induces cancer cell death[J].Afri J Biotech 2010,9(54):9270-9276.
[22]Knyazeva E L,Grishchenko V M,Fadeev R S,et al.Who is Mr.HAMLET?Interaction of human alpha-lactalbumin with monomeric oleic acid[J].Biochemistry,2008,47(49):13127-13137.
[23]Tolin S,De Franceschi G,Spolaore B,et al.The oleic acid complexes of proteolytic fragments of alpha-lactalbumin display apoptotic activity[J].Febs J,2010,277(1):163-173.
