结肠癌中MMP-11和Moesin mRNA的表达与肿瘤转移及预后的关系
2012-09-05张丽萍蒲红伟李晓梅竞花兰刘小山
张丽萍 蒲红伟 陈 晓 李晓梅 竞花兰 刘小山*
(1.新疆医科大学基础医学院生化教研室,乌鲁木齐830011;2.新疆医科大学高职学院中心实验室,乌鲁木齐830011;3.中山大学中山医学院法医学教研室,广州510080)
结肠癌(colorectal carcinoma,CRC)是胃肠道中常见的恶性肿瘤之一,其发生率在我国居全部恶性肿瘤的第4位,且近20年来发生率在持续上升[1]。结肠癌的发生、发展是一个多步骤、多阶段的过程,研究[2-4]表明基质金属蛋白酶(matrix metalloproteinases,MMP)和膜突蛋白(Moesin)在这个过程中起着非常重要作用,参与了肿瘤演进的多种病理过程。本研究通过检测结肠癌组织中MMP-11和Moesin基因的表达情况,并探讨二者在结肠癌发生、发展过程中的作用。
1 资料和方法
1.1 组织标本
选取新疆医科大学第一附属医院病理科1998~2004年手术切除的结肠癌石蜡包埋组织68例,其中男性35例,女性33例,患者年龄28~81岁,平均年龄62岁;正常组织40例为手术切端距癌组织5cm以上、经组织学检查证实的正常结肠黏膜。所有病例手术前均未接受化疗、放射治疗或免疫治疗,术后予以辅助化疗,临床资料完整。
1.2 方法
采用原位杂交法检测MMP-11和Moesin mRNA的表达,检测试剂盒购自武汉博士德生物工程有限公司;所有手术切除标本经10%甲醛固定,常规石蜡包埋后行4 μm连续切片,HE染色;原位杂交染色按试剂盒说明书操作,光镜观察时用已知阳性结肠癌切片作阳性对照,0.01 mol/L PBS(pH7.4)代替一抗作阴性对照。
1.3 结果判断
MMP-11和Moesin mRNA表达均以细胞胞质内呈棕黄色或棕褐色颗粒为阳性,且其着色强度高于背景非特异性染色。每例切片随机选取5个高倍视野进行结果判断,按染色强度及阳性细胞占肿瘤细胞总数的百分比综合计分。结肠癌癌细胞阳性判定标准参照,分级方法如下:染色强度:不着色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分;阳性细胞数:小于5%为0分,5% ~25%为1分,26%~50%为2分,大于50%为3分。染色强度得分与阳性细胞数得分相乘,0分记为阴性(-),1~3分记为弱阳性(+),4~5分记为中度阳性(++),大于或等于6分记为强阳性(+++),进行统计学分析时(+~+++)皆为阳性。随访采取电话问询,生存时间从手术日开始计算,末次随访为2009年9月。
1.4 统计学方法
应用SPSS13.0软件包进行分析,采用 Kaplan-Meier法评估患者术后5年生存率,率的比较用χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 MMP-11和Moesin mRNA在结肠癌组织和正常肠黏膜中的表达
MMP-11 mRNA在结肠癌组织中的阳性表达率为69.1%(47/68),高于在正常结肠黏膜中的阳性表达率12.5%(5/40)(表1);Moesin mRNA在结肠癌组织中的阳性表达率60.3%(41/68)亦高于正常结肠黏膜中的阳性表达率10%(4/40)(图1、2)。

图1 MMP-11 mRNA在结肠癌细胞胞质中的表达Fig.1 Expression of MMP-11 mRNA in the cytoplasm of colorectal cancer

图2 Moesin mRNA在结肠癌细胞胞质中的表达Fig.2 Expression of Moesin mRNA in the cytoplasm of colorectal cancer
2.2 MMP-11和Moesin mRNA在结肠癌组织中的表达与临床病理的关系
对68例患者结肠癌组织中MMP-11和Moesin mRNA表达和临床病理特征分析发现,Moesin mRNA在性别、年龄、民族、肿瘤大小、Dukes'分期、浸润深度的表达差异无统计学意义(P>0.05);在组织分化程度、淋巴结转移、临床分期的表达差异有统计学意义(P<0.05);MMP-11 mRNA在性别、年龄、民族、肿瘤大小、Dukes'分期的表达差异无统计学意义(P>0.05);在组织分化程度、浸润深度、淋巴结转移、临床分期的表达差异有统计学意义(P<0.05),见表2。
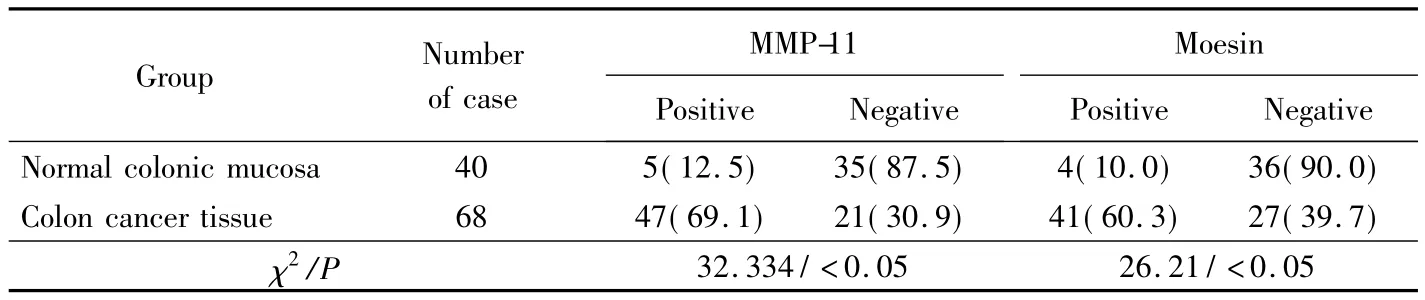
表1 MMP-11和Moesin mRNA在正常结肠黏膜及结肠癌组织中的表达Tab.1 Expression of MMP-11 and Moesin mRNA in the normal colorectal mucosa and in colorectal cancer tissue n(%)

表2 MMP-11和Moesin mRNA在结肠癌组织中的表达与临床病理的关系Tab.2 Relationship between expression of MMP-11 and Moesin mRNA in colorectal cancer tissue and the clinical pathology n(%)
2.3 MMP-11和Moesin mRNA在结肠癌中的表达与预后的关系
在对68例结肠癌患者随访中因电话变更,有9例失访,其余59例中MMP-11 mRNA阳性表达的患者5年生存率为46.8%,阴性者5年生存率75%,2者差异有统计学意义(P<0.05)。
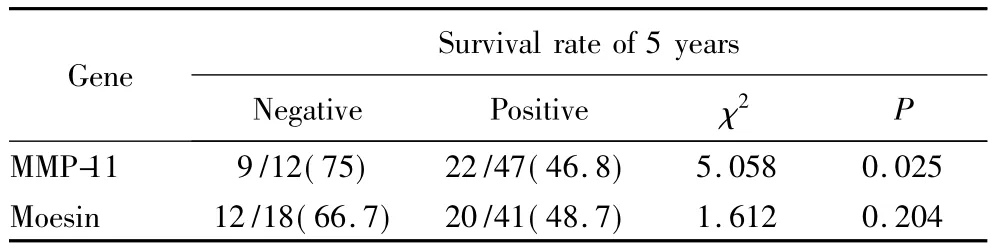
表3 MMP-11和Moesin mRNA在结肠癌中的表达与预后的关系Tab.3 Relationship between expression of MMP-11 and Moesin mRNA in colorectal cancer and the prognosis n(%)
MMP-11阳性表达组与阴性表达组相比,前者5年生存率较高且差异有统计学意义(P<0.05);Moesin阳性表达组平均生存时间和中位生存时间都高于阴性表达组,但差异无统计学意义(P>0.05)(见图5,6)。
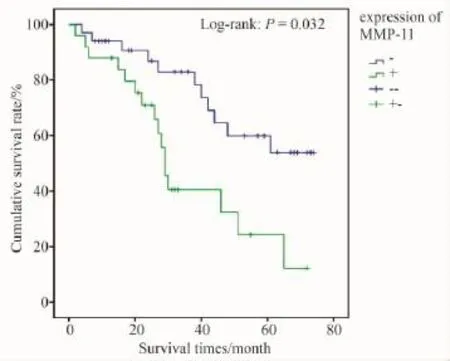
图5 MMP-11 mRNA表达组生存曲线Fig.5 Survival curves of the positive and negative expression groups of MMP-11 mRNA

图6 Moesin mRNA表达组生存曲线Fig.6 Survival curves of the positive and negative expression groups of Moesin mRNA
3 讨论
浸润和转移是恶性肿瘤最重要的生物学特征,肿瘤的转移是一个比较复杂的过程,涉及肿瘤细胞的脱落、新生血管的长入及对细胞外基质的降解等[5]。在组织学上,细胞基底膜完整性的破坏被认为是恶性肿瘤浸润开始的一个标志。基质金属蛋白酶(MMPs)是一类生物活性依赖于锌离子、有降解细胞外基质能力的内肽酶家族[6],在体内主要参与细胞外基质的降解或重构、炎性反应、缺血缺氧损伤等各种生理及病理过程[7]。MMP-11是基质金属蛋白酶(MMPs)家族的成员之一,定位于染色体22q11.23,其作用底物主要是基质中的蛋白多糖和糖蛋白,能降解细胞外基质和基底膜,可以导致细胞外基质代谢平衡的失调,从而引发肿瘤的浸润和转移[8]。对人体多种肿瘤进行的研究[9]表明,在不同实体瘤中MMP-11有不同程度的增高,与肿瘤进展及预后相关。Schuetz C S等[10]通过配对分析9例乳腺原位癌和浸润性癌,认为MMP-11是乳腺癌浸润相关基因之一。Gonzalez L O等[11]证实MMP-11过表达与乳腺癌的发生、发展有重要关系。Deng H等[12]通过质粒转染的方法证实了MMP-11在胃癌中参与肿瘤细胞的增生和肿瘤的发展。Zhao Z S等[13]研究结果证实MMP-11 mRNA和蛋白水平在胃癌组织中均呈现出高表达,在进展期胃癌患者中表达更明显。严冬等[14]对130例胃癌患者血清,采用RT-PCR及酶联免疫技术检测MMP-11 mRNA及蛋白表达情况,结果显示MMP-11 mRNA在胃癌患者外周血清中阳性表达率(68.4%)高于正常人群(5%),尤其在根治术后转移和(或)复发的晚期患者的外周血中,推测其可能作为胃癌诊断、复发及转移的分子标志物。
膜突蛋白(Moesin)属 ERM(Ezrin,Radixin,Moesin)家族成员,表达Moesin分子的cDNA核苷酸长度为3 835个碱基,开放读码框内有1 731个碱基编码577个氨基酸。Moesin蛋白存在两种构象,激活的Moesin蛋白(磷酸化)作为桥梁分子,介导肌动蛋白与质膜的交联从而引发肌动蛋白骨架的重构,促进细胞生长、迁移,所以Moesin蛋白在肿瘤发生、浸润及转移过程中扮演着重要角色。已有研究[15]证明Moesin的表达程度与乳腺癌的临床分期、淋巴结转移和分化程度有关。Kim C Y等[16]也证实Moesin在结肠癌侵袭与转移过程起重要作用,可作为结肠癌的诊断与判断预后的生物标志。周勤等[17]采用免疫组化法检测31例正常宫颈组织(NCE)、48例宫颈上皮内瘤样变(CIN)及66例宫颈鳞癌组织(SCC)中Moesin表达,其表达水平显著升高,在CIN组Moesin的表达随病变程度加重而升高,且SCC组中与分期、浸润深度、盆腔淋巴转移有关。刘畅等[18]认为甲状腺乳头状癌组织中Moesin的高表达与肿瘤的侵袭和转移有关。
本研究利用原位杂交方法对结肠癌组织中Moesin和MMP-11 mRNA表达情况进行了研究,实验结果显示Moesin和MMP-11 mRNA在结肠癌阳性表达率分别为60.3%和69.1%,明显高于正常结肠黏膜组织,差异有统计学意义。其中Moesin mRNA表达与性别、年龄、民族、肿瘤大小、Dukes'分期、浸润深度无关,与组织分化程度、淋巴结转移、临床分期表达有关,该结果与李莹杰等[19-20]在胃癌中的研究结果相符。MMP-11 mRNA表达与性别、年龄、民族、肿瘤大小、Dukes'分期差异无统计学意义(P>0.05),与组织分化程度、浸润深度、淋巴结转移、临床分期表达有统计学意义,组织分化差、有淋巴结转移和临床分期高者MMP-11 mRNA表达率高,提示MMP-11在结肠癌中的表达随Dukes分期增高而增加,在结肠癌的进展和分化过程中,分化程度越低,肿瘤细胞分泌MMP-11越多,其浸润和转移能力也越强,在肿瘤的浸润及转移中发挥着至关重要的作用,研究结果与Gonzalez L等[21]结果一致,因此本研究认为 MMP-11和 Moesin可以作为结肠癌浸润和转移的预测指标;此外研究通过生存率分析结果显示MMP-11 mRNA阳性表达的肿瘤患者5年生存率明显低于阴性者,差异有统计学意义,提示MMP-11可以作为结肠癌判断预后的生物学指标,而Moesin对结肠癌的预后影响还有待进一步研究。
综上所述,Moesin和MMP-1 mRNA在结肠癌中均高表达且与临床病理相关,提示上述生物学指标与临床病理学指标相结合可能为结肠癌的诊断、病情监测、预后判断以及治疗提供了崭新的思路。
[1]Gellad Z F,Provenzale D.Colorectal cancer:National and international perspective on the burden of disease and public health impact[J].Gastroenterology,2010,138(6):2177-2190.
[2]Takeuchi T,Adachi Y,Nagayama T,et al.Matrix metalloproteinase-11 overexpressed in lobular carcinoma cells of the breast promotes anoikis resistance[J].Virchows Arch,2011,459(3):291-297.
[3]Schlecht N F,Brandwein-Gensler M,Smith R V,et al.Cytoplasmic ezrin and moesin correlate with poor survival in head and neck squamous cell carcinoma[J].Head Neck Pathol,2012,6(2):232-243.
[4]Yan D,Dai H,Liu J W.Serum levels of mmp-11 correlate with clinical outcome in chinese patients with advanced gastric adenocarcinoma[J].BMC Cancer,2011,11:151-157.
[5]Chan A O,Chu K M,Lam S K,et al.Early prediction of tumor recurrence after curative resection of gastric carcinoma by measuring soluble e-cadherin[J].Cancer,2005,104(4):740-746.
[6]Wang X,Li K F,Adams E,et al.Matrix metalloproteinase inhibitors:A review on bioanalytical methods,pharmacokinetics and metabolism[J].Curr Drug Metab,2011,12(4):395-410.
[7]Pearce E,Tregouet D A,Samnegard A,et al.Haplotype effect of the matrix metalloproteinase-1 gene on risk of myocardial infarction[J].Circ Res,2005,97(10):1070-1076.
[8]Roy R,Yang J,Moses M A.Matrix metalloproteinases as novel biomarkers and potential therapeutic targets in human cancer[J].J Clin Oncol,2009,27(31):5287-5297.
[9]Orlichenko L S,Radisky D C.Matrix metalloproteinases stimulate epithelial-mesenchymal transition during tumor development[J].Clin Exp Metastasis,2008,25(6):593-600.
[10]Schuetz C S,Bonin M,Clare S E,et al.Progression-specific genes identified by expression profiling of matched ductal carcinomas in situ and invasive breast tumors,combining laser capture microdissection and oligonucleotide microarray analysis[J].Cancer Res,2006,66(10):5278-5286.
[11]Gonzalez L O,Pidal I,Junquera S,et al.Overexpression of matrix metalloproteinases and their inhibitors in mononuclear inflammatory cells in breast cancer correlates with metastasis-relapse[J].Br J Cancer,2007,97(7):957-963.
[12]Deng H,Guo R F,Li W M,et al.Matrix metalloproteinase 11 depletion inhibits cell proliferation in gastric cancer cells[J].Biochem Biophys Res Commun,2005,326(2):274-281.
[13]Zhao Z S,Chu Y Q,Ye Z Y,et al.Overexpression of matrix metalloproteinase 11 in human gastric carcinoma and its clinicopathologic significance[J].Hum Pathol,2010,41(5):686-696.
[14]严冬,沈琳,吕尤勇,等.MPP-11在胃癌患者血清中的表达及临床意义[J].中国癌症杂志,2007,17(12):968-972.
[15]Wang C C,Liau J Y,Lu Y S,et al.Differential expression of moesin in breast cancers and its implication in epithelialmesenchymal transition[J].Histopathology,2012,61(1):78-87.
[16]Kim C Y,Jung W Y,Lee H J,et al.Proteomic analysis reveals overexpression of moesin and cytokeratin 17 proteins in colorectal carcinoma[J].Oncol Rep,2012,27(3):608-620.
[17]周勤,邓婷.宫颈鳞癌中膜突蛋白及CD105的表达及其临床意义[J].实用妇产科杂志,2011,27(2):106-109.
[18]刘畅,高政南,刘忠,等.Ezrin和 Moesin在甲状腺乳头状癌中的相关性研究[J].中国耳鼻咽喉头颈外科,2011,18(10):559-560.
[19]李莹杰,陶晓峰,贺岩,等.Ezrin和Moesin在胃癌中的表达及其临床意义[J].中国肿瘤,2007,6(7):550-552.
[20]任庆华.膜一细胞骨架连接分子Ezrin及CD44v6对胃癌生长和转移的影响[D].沈阳:中国医科大学,2010.
[21]Gonzalez L,Eiro N,Gonzalez L O,et al.Effect of the expression of matrix metalloproteases and their tissue inhibitors on survival of patients with resectable colorectal cancer[J].Dig Dis Sci,2012,57(8):2063-2071.
