超声引导下麦默通微创切除乳腺良性肿块96例分析
2012-09-03李冠乔钟晓捷
李冠乔,汤 鹏,钟晓捷,王 梅
(海南省人民医院乳腺外科,海南 海口 570311)
近年来女性乳腺肿瘤的发病率逐年增高。越来越多的乳腺病灶,尤其是临床不可触及病灶,通过影像学检查被检出。广大女性对乳腺健康和外观的需求日益强烈,传统手术治疗瘢痕明显,甚至导致乳房畸形,难以切除不可触及病变,已不能满足广大女性审美和健康要求。超声引导下麦默通微创旋切术既能消除病灶,又能最大程度保持乳房美观,效果良好。本文总结我科自2011年6月至2011年8月对96例乳腺良性肿块的乳腺病灶行超声引导下麦默通微创旋切术结果,报告如下:
1 资料与方法
1.1 一般资料 共96例乳腺良性肿块患者,均为女性,年龄19~66岁,平均37岁。纳入标准:临床拟诊良性肿块BI-RADS评级Ⅲ级,最大径小于3 cm。患者中:单发31例,多发65例。222个乳腺肿块中:临床可触及肿块65个,临床不可触及肿块157个。单侧乳腺最多7个肿块,双侧乳腺最多8个肿块;肿块最大径为26 mm。
1.2 仪器设备 超声诊断系统:迈瑞公司,迈瑞DC-6彩色多普勒超声诊断系统(频率为5.0 MHz、7.5 MHz、10.0 MHz)。麦默通微创旋切系统:美国强生公司,麦默通微创旋切活检系统(旋切刀外径为8 G,切割刀槽长20 mm)。
1.3 手术方法 所有患者治疗前均行双乳彩色多普勒超声及肿块定位检查,大于35岁患者加做双乳钼靶片。患者取仰卧位或斜侧卧位,术前在本科室再行超声检查核对,对肿块的位置、数量、大小及周边血流情况进行检测,设定穿刺点。术区常规消毒,铺巾。超声引导下于进针点和肿块周围采用0.25%的利多卡因及少量肾上腺素局部麻醉。使用前检查Mammotome系统和旋切刀连接并进行系统自检,系统设置为Position模式。于进针点用尖刀片做一个3~5 mm的皮肤切口,在B超声像图引导下将Mammotome穿刺针从切口引入,准确置于乳腺肿块深面,尽量紧贴肿块,将穿刺针的活检凹槽向上对准肿瘤。选择Sample切割取样模式,针内的管状旋切刀退出,同时负压系统将活检槽上方的肿瘤吸入刀槽。按前进键,开始切割,管状旋切刀高速旋转前进,将槽内瘤体切除,继而后退吸引取出标本而无需退出穿刺针,助手用镊子拾取组织。调整穿刺针方向及深度,反复操作直至在超声声像图中肿瘤被完全切除,肉眼肿物至正常组织边界。整个切除过程在超声声像图监视下完成。切口以5个零带针缝线缝合,撤针后立即局部压迫5~10 min,再行弹力绷带加压包扎48 h。所有患者均未使用抗生素。术后4~6个月在门诊进行复查。患者于门诊行常规临床体检,如发现肿块切除部位临床触诊疑似仍有肿块或瘢痕明显的患者行双乳腺超声检查,排除肿块残留及未完整切除可能。血肿吸收欠佳的患者可局部热敷及口服活血化瘀药物待血肿充分吸收后复查。
2 结果
96 例222 个病灶均一次完全切除,每个肿块切除的组织条数最少5条,最多28条,平均15条。切除组织条每条直径约2~3.5 mm,长15~20 mm(图1),所有标本均能做出明确的病理诊断。222个乳腺肿块中,乳腺癌2个,2例乳腺癌患者之后均行乳腺癌改良根治手术,术中行包含原来穿刺路线切口;良性肿块220个。良性肿块中,纤维腺瘤95个,增生结节38个,腺病28个,腺瘤样增生37个,旺炽型腺病3个,分叶状肿瘤2个(良性1个,良性到交界性1个),囊肿17个。222个肿块术中均显示完全切除,单个肿块切除最短时间5 min,最长时间20 min,平均8 min。单个肿块最大径2.6 cm,肿块平均最大径为1.2 cm。6例术中出现负压管阻塞,更换探针或清洗负压吸引管后二次进针。7例术中出血较多,超过40 ml,其中5例均发生在外上象限,压迫包扎后血止。皮下瘀斑14例,术后血肿9例,术后随访4~6个月,随访过程中逐渐消散。1例于术后2个月出现复发。给予再次切除,复发率为1%。局部轻微凹陷6例,表面手术瘢痕不明显。96例中94例效果满意,满意率达97.9%。
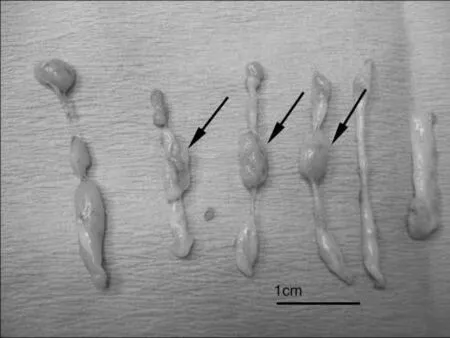
图1 纤维腺瘤(箭头所示膨大部位为肿块)
3 讨 论
随着生活水平的提高和女性自我保健意识的增强以及影像学技术的不断进步,越来越多的女性乳腺肿块患者通过影像学检查被发现。其中不乏多发和病灶微小者,部分临床不能触及,影像学诊断难以定性。鉴于患者对外观和健康的要求,多发肿块常规手术更难保证乳房美观,或者病灶微小,常规手术难以找到。虽然可以通过立体定位穿刺活检、超声引导穿刺、钢丝定位活检等获得部分病理信息,但对于癌前病变和乳腺癌存在一定的低估率[1]。由于不能切除全部病灶,不能确诊,有潜在恶性的危险,给患者带来不安与焦虑。麦默通微创旋切系统最早也用于乳腺疾病穿刺活检[2],但对较小的病灶可以完全切除[3],既不影响乳房外形,又能确诊肿瘤性质,对良性肿块切除又可达到治疗目的,有着明显的优势。
3.1 麦默通手术的优势 麦默通手术可达到切除肿块的目的,尤其是临床不可触及肿块:随着影像学技术(钼靶、超声等)的发展,越来越多的乳腺微小病灶被检出。许多肿块临床触诊阴性,常规手术难以准确定位切除。超声引导下麦默通旋切系统,具备实时显像、动态观察、操作灵活、定位简便准确、真空负压吸引等特点,更有利于准确切除此类肿物,对良性肿块同时也达到了治疗目的[4]。Wang等[5]对162例245个肿块行麦默通旋切术,其中220个术后彩超证实完全切除。本组患者222个病灶术后彩超也证实完全切除。麦默通手术可以能够提供足够病理需要量的标本:虽然空芯针穿刺已广泛应用于临床并能够取得组织提供病理诊断,但是由于获取的标本量少,小肿块固定困难,不易取材,不能取得全部肿块,影响病理检查的准确性。超声引导下麦默通旋切系统肿块活检标本单条可达2 cm长度,3 mm直径,能满足病理检查包括免疫组化所需的样本量。本组患者均为临床诊断良性肿物患者,发现2例乳腺癌,术后病理证实恶性,减少了乳腺癌漏诊的机会。Takahashi等[6]对1 000例患者采用麦默通微创技术进行活检,13%患者发现为恶性,其中17%为侵袭性。也证实了该系统对乳腺癌的早期诊断和治疗价值。麦默通手术可以最大程度的保证乳房的美观:麦默通微创旋切术在B超定位下精确操作,一个穿刺孔可切除多个乳腺肿块[7],尤其对临床不可触及肿块[3],手术创伤小,术后缝合少,或可不缝合,瘢痕小,愈合快,皮肤上仅有3~5 mm的穿刺孔,可尽可能减少术后对乳腺美观的影响。Povoski[8]曾以麦默通微创手术同时处理14处孤立病变,而不影响乳房原有美观,避免了常规手术后的进一步乳房美容手术。
3.2 麦默通手术的问题和处理办法
3.2.1 肿块残留 由于刀槽长度有限,切除大于3 cm肿块或分叶状肿块效果或不理想。肿块较大或分叶时,需反复调整探针方向与角度对肿块分割切除,手术时间延长,出血增多,残腔大,肿块分隔为多个部分,不易切取干净,故直径>30 mm的肿块,不建议该手术。1.5 cm以上的肿块可考虑扇形推进法切除,不易残留。杨露等[10]研究也指出:最大径大于3 cm肿物的完整切除率低于最大径小于或等于3 cm组。另外,乳头下或乳晕旁肿块,周围大乳管集中,有哺乳需求患者亦应慎重切除。而对乳腺边缘或紧贴皮下的浅表肿块因可能伤及皮肤,应慎重,如需要切除,可考虑在病灶或皮肤间注入生理盐水,增宽间隙,以免损伤皮肤。
3.2.2 恶性细胞的针道播散与血行转移 麦默通穿刺活检系统是否能造成癌细胞针道种植和转移是普遍关注的安全性问题。对乳腺多发性病变,尤其双乳病灶,使用多个穿刺针势必增加患者经济负担,而反复使用一把旋切刀,可能引起肿瘤种植。与其他活检方法一样,Hoorntje等[11]研究发现,麦默通微创手术确实存在针道种植转移的可能。Knight[12]研究表明保乳术后局部复发率并无明显增高。Diaz[13]研究也发现,核芯针活检后癌细胞转移的发生率和数量与活检到手术切除的时间间隔负相关,暗示种植的癌细胞不能存活。目前也尚没有恶性肿瘤因行麦默通活检导致肿瘤复发远处转移影响患者预后的证据。
3.2.3 假阴性或病情低估 良性肿块切除因全部切除肿块,一般不存在病情低估问题,但用于乳腺可疑恶性肿块局部活检时,由于乳腺癌组织具有一定的异质性或取样失误或不足,麦默通微创旋切活检系统也可能出现假阴性的情况,或浸润性癌误判为原位癌。但就标本量而言,麦默通穿刺标本仍然远大于普通穿刺活检。提高操作熟练程度,适当增加样本量也可进一步减少上述情况的发生。
3.2.4 出血和血肿 麦默通微创旋切系统无凝血功能,存在术中术后出血及血肿形成的可能。因此,连续切除多个肿块时,对术后残腔需立即压迫止血后,才可对余下肿块进行切除。术后局部压迫5-10 min,再使用棉垫和弹力绷带加压包扎24 h,注意棉垫是否移位。本组患者7例术中损伤了较大血管,其中5例均发生在外上象限,处理外上象限肿块时更应小心。
3.2.5 肿块多切或遗漏 麦默通手术需要外科医生和B超科医生的密切配合,我们工作中偶尔有患者实际切除肿块大于B超定位数目的情况,因此应做好与B超科医师和患者的沟通,以避免不必要的矛盾。
综上所述,超声引导下的Mammotome微创旋切术适用于大部分的乳腺占位性病变,具有安全可靠、手术直观、定位精确、并发症少、术后美观等特点,可进一步普及推广。
[1]Carpentier E,Maruani A,Michenet P,et al.Can US-guided vacuum-assisted biopsies be an alternative to diagnostic surgery in cases of non-diagnostic core needle biopsy?[J].J Radiol,2005,86(5Pt 1):475-480.
[2]Burbank F,Parker SH,Fogarty TJ.Stereotactic breast biopsy:improved tissue harvesting with the Mammotome[J].Am Surg,1996,62(9):738-744.
[3]Luo HJ,Chen X,Tu G,et al.Therapeutic Application of Ultrasound-Guided 8-Gauge Mammotome System in Presumed Benign Breast Lesions[J].Breast J,2011,17(5):490-497.
[4]何劲松,王先明,朱国献,等.高频超声引导下Mammotome旋切系统在乳腺微小钙化灶切取活检中的价值[J].中国微创外科杂志,2006,6(9):667-668.
[5]Wang ZL,Li JL,Su L,et al.An evaluation of a 10-gauge vacuum-assisted system for ultrasound-guided excision of clinically benign breast lesions[J].Breast,2009,18(3):192-196.
[6]Takahashi K,Gomi N,Iwase T,et al.The role and efficacy of mammotome biopsy(vacuum-assissted breast biopsy)[J].Nihon Rinsho,2006,64(3):469-474.
[7]Fine RE,Pat W,Whitworth JA,et al.Low-risk palpable breast masses removed using a vacuum-assisted hand-held device[J].Am J Surg,2003,186(4):362-367.
[8]Povoski SP.The utilization of an ultrasound-guided 8-gauge vacuum-assisted breast biopsy system as an innovative approach to accomplishing complete eradication of multiple bilateral breast fibroadenomas.[J].World J Surg Oncol,2007,29(5):124.
[9]高学忠,王西悦,张 荣,等.麦默通扇形推进法旋切较大良性乳腺肿块的可行性研究[J].中华乳腺病杂志(电子版),2011,5(1):35-40.
[10]杨 露,孙治君.麦默通微创旋切手术在治疗良性乳腺肿物中的应用[J].重庆医学,2010,39(7):810-811.
[11]Hoorntje LE,Schipper ME,Kaya A,et al.Tumour cell displacement after 14G breast biopsy[J].Eur J Surg Oncol,2004,30(5):520-525.
[12]Knight R,Horiuchi K,Parker SH,et al.Risk of needle-track seeding after diagnostic Image-guided core needle biopsy in breast cancer[J].JSLS,2002,6(3):207-209.
[13]Diaz LK,Wiley EL,Venta LA.Are malignant cells displaced by large-gauge needle core biopsy of the breast?[J].AJR Am J Roentgenol,1999,173(5):1303-1313.
