葡萄糖酸替代饲用抗生素对黄羽肉鸡免疫器官指数及小肠黏膜免疫的影响
2012-09-03李海英
新 疆 农 业 大 学 李 虎 李海英 崔 彪
新疆肉乳用草食动物营养实验室 翟卫爽 李晓斌 杨开伦*
葡萄糖酸是葡萄糖在葡萄糖杆菌的作用下发生不完全氧化的产物。葡萄糖酸很难被单胃动物小肠吸收,因此,其能顺利到达肠后段,发酵最终产生丁酸(Deppen meier等,2002;Tsuka-hara 等,1994)。丁酸是大肠上皮细胞主要能量的来源(Roediger,1980)。因此,葡萄糖酸可以间接刺激肠后段上皮细胞的生长(Biagi等,2006)。研究表明,葡萄糖酸在生产性能和屠宰性能指标方面可以替代黄羽肉鸡饲用抗生素,但作用机制仍不清楚(许芸等,2011)。本试验旨在研究基础日粮中添加不同水平的葡萄糖酸替代饲用抗生素对黄羽肉鸡免疫器官指数、小肠黏膜蛋白质中溶菌酶含量、十二指肠黏膜蛋白质中SIgA含量、小肠内容物中细菌数量及回肠内容物中有机酸浓度的影响,为葡萄糖酸替代肉鸡饲用抗生素提供试验依据。
1 材料与方法
1.1 试验设计 将180只1日龄体重相近的健康黄羽肉鸡随机分为5个处理组,每个处理3个重复,每个重复12只鸡。阴性对照组饲喂基础日粮,阳性对照组在基础日粮基础上添加0.3 g/kg那西肽和0.25 g/kg硫酸粘杆菌素,试验I、II、III组分别在基础日粮基础上添加1、2、3 g/kg葡萄糖酸。试验鸡在笼上公母混养,按常规免疫和饲养管理。分别在45 d和77 d,每组选取6只黄羽肉鸡采集样品。
1.2 样品采集 在45 d和77 d时,每组选取6只试验鸡,进行称重、采血、颈部放血屠宰,分别摘取胸腺、脾脏、法氏囊并称重,记录数据,用于计算免疫器官指数;然后依次剥离十二指肠、空肠、回肠,分别收集各肠段内容物,装入封口袋中用液氮迅速冷冻,于-20℃冰箱保存,用于测定肠道内容物中细菌数量及回肠内容物有机酸浓度;各肠段分别用20 mL生理盐水冲洗,称重、记录重量;将各肠段均一分为二,做好记录、标记;取各肠段的后段装入封口袋中用液氮冷冻,于-20℃冰箱保存,用于测定肠黏膜蛋白质、肠黏膜蛋白质中溶菌酶含量和十二指肠黏膜蛋白质中SIgA含量。
1.3 样品制备 黏膜待测液的制备:将冷冻于-20℃冰箱中的各段肠道的后段,于室温下解冻,称重并记录重量;刮取肠黏膜,按黏膜重:体积为1∶2的比例加入0.01 mol/L pH 7.2的磷酸盐缓冲液,4℃冰箱中静置30 min,悬浮于盛有冷水的超声波清洗器中超声5 min,4℃,12000 r/min离心20 min,取上清液于4℃冰箱放置,当天用于测定肠黏膜蛋白质含量、肠黏膜蛋白质中溶菌酶含量和十二指肠黏膜蛋白质中SIgA含量。
细菌数量测定样品液的制备:将冷冻于-20℃冰箱中的各肠段肠道内容物在室温下解冻,充分混匀后准确称取0.1 g左右于10 mL离心管中,加入5 mL灭菌的生理盐水稀释,悬浮于盛有冷水的超声波清洗器中超声5 min,混匀,静置5 min进行染色测定。
有机酸测定样品的制备:充分混匀已解冻的回肠内容物,准确称取0.5 g左右于10 mL离心管中,加入2.0 mL蒸馏水、混匀,悬浮于盛有冷水的超声波清洗器中超声15 min,吸取0.5 mL上清液于1.5 mL离心管中,加入0.5 mL甲醇、混匀,4℃,12000 r/min离心10 min,取上清液于4℃冰箱放置,当天用高效液相色谱仪测定回肠内容物中有机酸的浓度。
1.4 测定指标及方法
1.4.1 免疫器官指数测定 免疫器官指数用采集样品时记录的试验鸡体重、胸腺重、脾脏重、法氏囊重计算,用免疫器官的重量(g)与屠宰前试验鸡活重(kg)的比值表示。
1.4.2 小肠黏膜蛋白质中溶菌酶含量测定 本试验条件下,一个FTP溶菌酶单位定义为:在规定条件下于450 nm处每分钟使吸光度降低0.001时所需的酶量。在一定浓度的浑浊菌液中,由于溶菌酶水解细胞壁粘多糖使细菌裂解浓度降低,透光度增强,故可以根据浊度变化来推测溶菌酶的含量。
对照管、测试管中分别加入2.5 mL的溶壁微球菌悬浮液(2.5 g/L),空白管中加入2.5 mL的磷酸盐缓冲液(1/15 mol/L,pH 6.2),均在 37 ℃电热恒温水浴箱中保温5 min,对照管加入0.02 mL的蒸馏水,测试管、空白管分别加入0.02 mL的待测样品液,均在37℃电热恒温水浴箱中反应2 min,分别加入0.15 mL氢氧化钾溶液(5 mol/L)终止反应,于450 nm波长处测定吸光度值。为了消除待测样品溶液颜色和浊度对试验结果的影响,本试验随机选取了12个待测样品溶液测得的样品空白OD值为0.4248,变异系数为1.52%,蒸馏水12次重复测得的水空白OD值为0.4080,变异系数为1.21%,均小于5%,故本试验中样品空白值取0.4248,水空白值取0.4080。吸光度变化值△OD=(对照管的OD值-水空白管OD值)-(测试管OD值-样品空白管OD值),本试验条件下,溶菌酶浓度的线性范围为0~100 μg/mL,线性关系为Y=310.8X+0.37(Y表示溶菌酶浓度,X表示吸光度变化值,R2=0.9994)。用100mg肠黏膜蛋白中含比活力为70000 U/mg的溶菌酶微克数表示小肠黏膜蛋白质中溶菌酶的含量。
1.4.3 十二指肠黏膜蛋白质中SIgA含量测定用上海华壹生物科技有限公司生产的鸡分泌型免疫球蛋白A (SIgA)ELISA检测试剂盒于450 nm处测定,严格按试剂盒使用说明书进行操作。十二指肠黏膜蛋白质中SIgA含量,用100 mg肠黏膜蛋白质中含SIgA的毫克数表示。肠黏膜中蛋白质含量用Brandford法测定,用1 g肠黏膜中含蛋白质的毫克数表示(Brandford,1976)。
1.4.4 肠道内容物中细菌数量测定 细菌数量测定用带有万能视频成像装置的生物显微镜测定。结果以1 g内容物中细菌数量(N)的对数值(lgN)表示。
1.4.5 回肠内容物中有机酸浓度测定 回肠内容物中有机酸的浓度用高效液相色谱仪测定。色谱条件:流动相 A∶甲醇(色谱纯),流动相 B:50 mmol/L NaH2PO4溶液(pH 2.7);柱温:30 ℃;进样量:5 μL;检测波长:214 nm;洗脱方式:二元梯度洗脱。结果以1L回肠内容物溶液中含有机酸的毫摩尔数表示。
1.5 数据处理与分析 试验数据以 “平均数±标准差”表示,采用SPSS16.0软件ONE-WAY ANOVA进行方差分析,各组平均数多重比较采用 Duncan’s法。
2 结果与分析
2.1 葡萄糖酸对黄羽肉鸡免疫器官指数的影响由表 1可知,45 d时, 试验 I、II、III组胸腺重、胸腺指数、脾脏重、脾脏指数、法氏囊重、法氏囊指数均与阳性对照组均无显著差异(P>0.05),但脾脏重、脾脏指数均略高于阳性对照组(P>0.05),而低于阴性对照组(P > 0.05)。77 d 时,试验 I、II、III组胸腺重比阳性对照组分别降低19.34%(P>0.05)、58.29%(P < 0.01)、43.78%(P < 0.05);除试验I组,II、III组胸腺重略低于阴性对照组(P>0.05); 试验 I、II、III组胸腺指数比阳性对照组分别降低 27.34%(P > 0.05)、63.08%(P < 0.01)、48.83%(P < 0.01), 除试验 I组外,II、III组胸腺重略低于阴性对照组(P > 0.05);试验 I、II、III组脾脏重、脾脏指数、法氏囊重、法氏囊指数与阳性对照组和阴性对照组均无显著差异(P>0.05)。
2.2 葡萄糖酸对黄羽肉鸡肠黏膜蛋白质中溶菌酶和SIgA含量的影响 由表2可知,除阳性对照组外,其余各组黄羽肉鸡小肠黏膜蛋白质中溶菌酶的含量随着日龄的增加均呈上升趋势。45 d时,试验I、II、III组十二指肠黏膜蛋白质中溶菌酶的含量比阳性对照组分别降低60.54%(P<0.01)、41.80%(P < 0.01)、38.47%(P < 0.01),比阴性对照组分别降低 53.65%(P<0.01)、31.63%(P < 0.01)、27.72%(P < 0.01);试验 I、II组空肠黏膜蛋白质中溶菌酶含量比阳性对照组分别降低 56.70%(P < 0.01)、27.09%(P < 0.05),试验II、III组与阴性对照组均差异不显著 (P>0.05);试验I、II、III组回肠黏膜蛋白质中溶菌酶含量均极显著低于阳性对照组和阴性对照组 (P<0.01),3个试验组之间差异均不显著 (P>0.05)。77 d时,试验I、II、III组十二指肠黏膜蛋白质中溶菌酶含量均高于阳性对照组(P>0.05),均低于阴性对照组(P > 0.05);试验 I、II、III组空肠黏膜蛋白质中溶菌酶含量均高于阳性对照组 (P>0.05)和阴性对照组(P > 0.05);试验 I、II、III组回肠黏膜蛋白质中溶菌酶含量均高于阳性对照组(P>0.05), 试验I、II组均高于阴性对照组 (P>0.05)。 结果表明,45 d 时,试验 I、II、III组黄羽肉鸡肠黏膜蛋白质中溶菌酶的含量均低于阳性对照组和阴性对照组;77 d时,试验 I、II、III组黄羽肉鸡十二指肠、空肠、回肠黏膜蛋白质中溶菌酶的含量均高于阳性对照组。
45 d时,试验I、II、III组十二指肠黏膜蛋白质中SIgA含量比阳性对照组分别提高228.69%(P < 0.01)、207.49(P < 0.01)、227.84(P < 0.01),比阴性对照组分别提高 246.50%(P<0.01)、224.15(P < 0.01)、245.60(P < 0.01)。 77 d 时,试验I、II组十二指肠黏膜蛋白质中SIgA的含量均显著高于阳性对照组和阴性对照组(P<0.05)。结果表明,基础日粮中添加葡萄糖酸替代饲用抗生素提高了黄羽肉鸡十二指肠黏膜蛋白质中SIgA的含量。
2.3 葡萄糖酸对黄羽肉鸡肠道内容物中细菌数量的影响 由表 3可知,45 d时,试验 I、II、III组黄羽肉鸡十二指肠内容物中细菌数量比阳性对照组 分 别 提 高 0.20%(P > 0.05)、1.38%(P <0.01)、1.28%(P < 0.05),比阴性对照组略低(P >0.05);空肠内容物细菌数量比阳性对照组分别提高-0.77%(P > 0.05)、-0.19%(P > 0.05)、0.97%(P<0.05),比阴性对照组分别提高-0.58%(P>0.05)、0.00%(P > 0.05)、1.16%(P < 0.05);回肠内容物中细菌数比阳性对照组分别提高0.58%(P > 0.05)、0.68%(P > 0.05)、0.58%(P > 0.05),比阴性对照组略低(P > 0.05)。77 d 时,试验 I、II、III组黄羽肉鸡十二指肠、空肠、回肠内容物细菌数量大多高于阳性对照组(P>0.05),大多低于阴性对照组(P>0.05)。结果表明,在黄羽肉鸡基础日粮中添加葡萄糖酸替代饲用抗生素能够减少黄羽肉鸡肠道内容物中细菌数量,作用效果不及饲用抗生素。
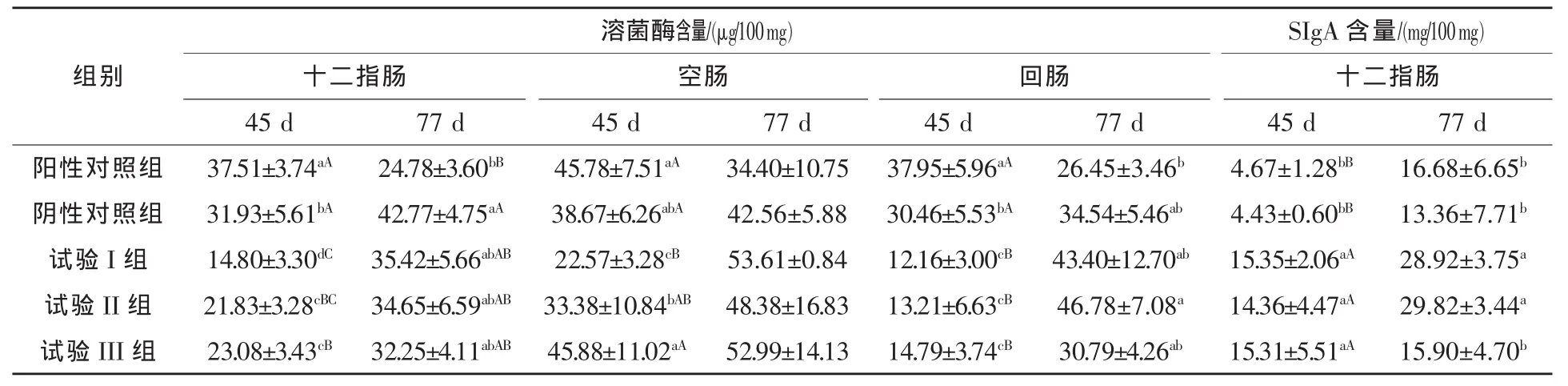
表2 葡萄糖酸对黄羽肉鸡肠黏膜蛋白质中溶菌酶和SIgA含量的影响
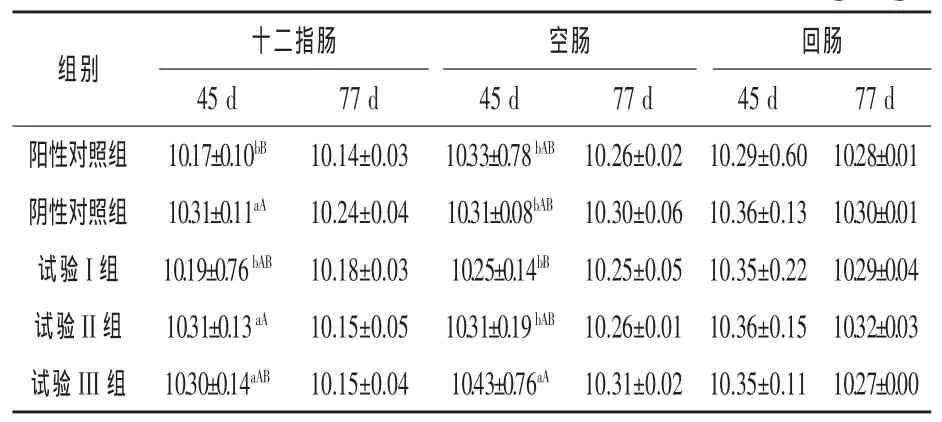
表3 葡萄糖酸对黄羽肉鸡肠道内容物中细菌数量的影响 lgN/g
2.4 葡萄糖酸对黄羽肉鸡回肠内容物中有机酸浓度的影响 由表 4可知,试验 I、II、III组 77 d黄羽肉鸡回肠内容物中苹果酸、乙酸、柠檬酸、总酸浓度均低于阳性对照组(P>0.05),乙酸、柠檬酸、琥珀酸、丙酸、总酸浓度均高于阴性对照组(P>0.05);乳酸浓度比阳性对照组分别提高 14.61%(P>0.05)、43.40%(P > 0.05)、40.99%(P > 0.05), 比阴性对照组分别降低 33.22%(P>0.05)、16.45%(P > 0.05)、17.85%(P > 0.05); 乙酸浓度比阳性对照组分别降低23.77%(P>0.05)、34.42%(P < 0.05)、14.07%(P > 0.05),比阴性对照组分别提高67.73%(P<0.05)、44.30 %(P > 0.05)、89.08%(P < 0.05);柠檬酸浓度比阳性对照组分别降低37.93%(P< 0.05)、50.00%(P < 0.01)、67.82%(P <0.01),比阴性对照组分别提高 111.76%(P> 0.05)、70.59%(P > 0.05)、9.80%(P >0.05);总酸浓度比阳性对照组分别降低17.54%(P > 0.05)、24.37%(P > 0.05)、7.83%(P>0.05),比阴性对照组分别提高27.25%(P > 0.05)、16.72% (P > 0.05)、42.24%(P>0.05)。结果表明,基础日粮中添加葡萄糖酸替代饲用抗生素提高了77 d黄羽肉鸡回肠内容物乙酸、柠檬酸、琥珀酸、丙酸及总酸的浓度。
3 讨论
3.1 葡萄糖酸对黄羽肉鸡免疫器官的影响 动物免疫功能的高低取决于免疫器官的发育状态及机能强弱。胸腺、脾脏、法氏囊的重量可用于评价雏鸡的免疫状态,一般认为免疫器官重量的降低为免疫抑制所致,反之则为免疫增强、生长发育快的表现,免疫器官的生长发育和迅速成熟,可使肉仔鸡的整体免疫机能加强,抵抗各种病原微生物感染的能力和抗各种应激的能力得到提高 (程相朝等,2002;Rivos,1988)。 本试验结果表明,与阴性对照组相比,基础日粮中添加葡萄糖酸替代肉鸡饲用抗生素降低了黄羽肉鸡的胸腺指数、脾脏指数、法氏囊指数,且随葡萄糖酸添加量的增加呈下降趋势。45 d试验I组胸腺指数、脾脏指数、法氏囊指数均高于阳性对照组。原因可能是基础日粮中添加葡萄糖酸替代饲用抗生素改变了黄羽肉鸡肠道菌群结构,微生物对免疫系统的刺激减弱,引起免疫器官功能减弱(朱碧泉等,2007;黄小青等,2005)。
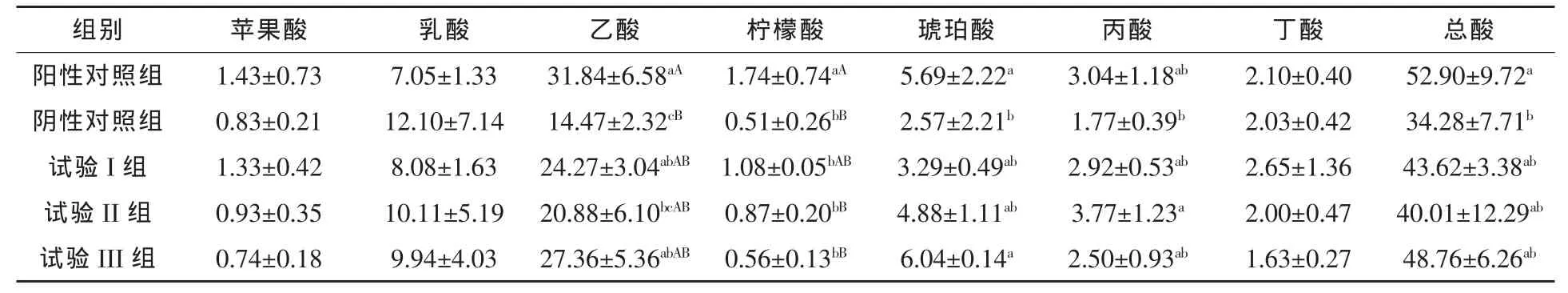
表4 葡萄糖酸对黄羽肉鸡回肠有机酸的影响mmol/L
3.2 葡萄糖酸对黄羽肉鸡小肠黏膜免疫的影响肠道黏膜不仅是消化、吸收营养物质的场所,而且还具有重要的免疫功能。溶菌酶作为动物自身的非特异性免疫因子,参与机体多种免疫反应,可改善和增强巨噬细胞的吞噬和消化功能,增强机体抵抗力,对维持肠道菌群平衡及促进动物生长具有良好的作用。本试验结果表明,基础日粮中添加葡萄糖酸替代饲用抗生素明显降低了45 d黄羽肉鸡肠黏膜蛋白质中溶菌酶含量,而增加了77 d黄羽肉鸡肠黏膜蛋白质中溶菌酶的含量。原因可能是添加葡萄糖酸对黄羽肉鸡肠道菌群结构的改变导致的。
分泌型免疫球蛋白A(SIgA)是肠道黏膜免疫的主要效应分子,是肠上皮抵御毒素和致病微生物侵害的第一道防线,对禽类的黏膜免疫起重要作用(Mantis等,2011)。SIgA 主要功能有,一是抑制肠道内的细菌黏附肠道黏膜表面,SIgA在黏膜表面是通过黏膜内蠕动和绒毛清除来阻止黏膜与病原体的接触,SlgA直接阻止或在空间上干涉微生物与介导上皮黏附的蛋白接触,尤其在上皮细胞泡状间隙内阻止入侵的病原体 (Bomsel等,1998;Lamm,1997;Burns 等 ,1996;Mazanec 等 ,1992;Buke 等,1989;Danielson 等,1989)。 二是中和肠道内的毒素、酶和病毒,并结合抗原形成免疫复合物由吞噬细胞吞噬清除,使已被肠道酶类改变的病原体毒力降低。本试验结果表明,基础日粮中添加葡萄糖酸替代饲用抗生素提高了黄羽肉鸡十二指肠黏膜蛋白质中SIgA的含量,表明十二指肠黏膜的主动免疫功能得到加强。基础日粮中添加葡萄糖酸替代饲用抗生素降低了黄羽肉鸡消化道pH,引起消化道内微生物种群结构发生变化,肠道菌群结构的变化引起肠黏膜分泌SIgA的水平发生变化。
3.3 葡萄糖酸对黄羽肉鸡肠道细菌数量和有机酸浓度的影响 当单胃动物采食的葡萄糖酸很难被小肠吸收,能顺利到达肠后段,发酵最终产生丁酸,丁酸是大肠上皮细胞主要能量的来源,可以间接地刺激肠后段上皮细胞的生长,促进营养物质的吸收(Biagi等,2006;Tsukahara 等,2002;Asano等,1994;Roediger,1980)。 动物消化道内酸性条件有利于乳酸菌的繁殖,且乳酸菌产物-乳酸能阻碍大肠杆菌在肠道内与其受体结合,抑制其生长,促进有益菌增殖。同时,有机酸本身还具有较强的杀菌作用,如延胡索酸对葡萄球菌、链球菌、大肠杆菌等有很强的杀灭活性,而丙酸对沙门氏菌、真菌及革兰氏阳性菌有较强的抑制作用,乳酸对某些病毒、革兰氏阴性菌都有一定的杀灭作用(Danielson等,1989)。本试验结果表明,基础日粮中添加葡萄糖酸替代饲用抗生素提高了77 d黄羽肉鸡回肠内容物中乙酸、柠檬酸、琥珀酸、丙酸及总酸的浓度。有机酸的双重作用,一是为黄羽肉鸡肠道黏膜细胞提供营养;二是调节肠道微生物种群结构及杀菌作用。基础日粮中添加葡萄糖酸替代饲用抗生素造成肉鸡消化道酸度增加,可能抑制了有害细菌繁殖,导致肉鸡肠道菌群结构及内容物有机酸浓度发生变化,从而引起黏膜免疫功能发生变化。
4 小结
本试验条件下,基础日粮中添加葡萄糖酸替代饲用抗生素提高了十二指肠黏膜蛋白质中SIgA含量,增强了十二指肠黏膜主动免疫功能;提高了77 d黄羽肉鸡空场、回肠肠黏膜蛋白质中溶菌酶含量及回肠内容物中乙酸、柠檬酸、琥珀酸、丙酸及总酸的浓度;对鸡免疫器官指数、小肠内容物中细菌总数总体影响不明显。因此,葡萄糖酸替代饲用抗生素改善了黄羽肉鸡肠黏膜免疫功能。
[1]程相朝,春杰,李银聚,等.左旋咪唑对肉仔鸡免疫器官生长发育的影响[J].中国家禽,2002,24(17):14.
[2]黄小春,吴灵英,朱惠玲.二甲酸钾对肉仔鸡抗菌促生长作用研究[J].中国家禽,2005,9(1):80 ~ 82.
[3]许芸,李虎,李海英,等.葡萄糖酸替代饲用抗生素对黄羽肉鸡生产性能和屠宰性能的影响[J].新疆农业科学,2011,48(9):1730 ~ 1735.
[4]朱碧泉,陈代文,丁雪梅,等.不同种类有机酸对肉鸡生长性能、养分利用率和肠道菌群的影响研究[J].中国饲料,2007,14:12~15.
[5]Asano T,Yuasa K,Kunugita K,et al.Effects of gluconic acid on human faecal bacteria[J].Microbial Ecology in Health and Disease,1994,7(5):247 ~ 256.
[6]Bomsel M,Heyman M,Hocini1 H,et al.Intracellular neutralization of HIV transcytosis across tight epithelial barriers by anti-HIV envelope protein dIgA or IgM[J].Immunity,1998,9(2):277 ~ 287.
[7]Burns J W,Siadat-Pajouh M,Krishnaney A A,et al.Protective effect of rotavirus VP6-specific IgA monoclonal antibodies that lack neutralizing activity[J].Science,1996,272(5258):104 ~ 107.
[8]Biagi G,Piva A,Moschini M,et al.Effect of gluconic acid on piglet growth performance,intestinal microflora,and intestinal wall morphology[J].Journal of Animal Science,2006,84(2):370 ~ 378.
[9]Brandford M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Analytical Biochemistry,1976,72(1 ~ 2):248 ~ 254.
[10]Danielson A D,Peo Jr E R,Shahani K M,et al.Anticholesteremic property of Lactobacillus acidophilus yogurt fed to mature boars[J].Journal of Animal Science,1989,67(4):966 ~ 974.
[11]Deppenmeier U,Hoffmeister M,Prust C.Biochemistry and biotechnological applications of gluconobacter strains[J].Applied Microbiology and Biotechnology,2002,60(3):233 ~ 242.
[12]Mantis N J,Rol N,Corthésy B.Secretory IgA's complex roles in immunity and mucosal homeostasis in the gut[J].Mucosal Immunology,2011,4(6):603~611.
[13]Lamm M E.Interactions of antigens and antibodies at mucosal surfaces[J].Annual Review of Microbiology,1997,51(1):311 ~ 340.
[14]Mazanec M B,Kaetzel C S,Lamm M E,et al.Intracellular neutralization of virus by immunoglobulin Aantibodies[J].Proceedings of the National A-cademy of Sciences,1992,89(15):6901 ~ 6905.
[15]Rivas A L,Fabricant J.Indications of immuneodepression in chickens infected with various strains of Marek’s disease virus[J].Avian Diseases,1988,32(1):1 ~ 8.
[16]Roediger W E.Role of anaerobic bacteria in the metabolic welfare of the colonic mucosa in man[J].Gut,1980,21(9):793 ~ 798.
[17]Tsukahara T,Koyama H,Okada M,et al.Stimulation of butyrate production by gluconic acid in batch cultune of pig cecal digesta and identificationof butyrate-producing bacteria[J].Journal of Nutrition,2002,132(2):2229 ~ 2234.
