银杏叶提取物对糖尿病大鼠学习记忆能力及海马神经元NGF、NT-3表达的影响*
2012-08-30金可可陈国荣李剑敏
赵 竞,金可可,吴 亮,陈国荣,李剑敏△
(1.温州医学院病理生理学教研室,温州 325035;2.温州医学院附属第一医院病理科,温州 325003)
糖尿病可导致糖尿病脑病(diabetic encephalopathy,DE)目前已成共识[1],其主要特征表现为认知功能减退、学习记忆力减弱、智力降低、情绪障碍等精神功能紊乱。近几年来,神经营养因子对影响认知的中枢胆碱能神经元的神经营养支持作用、抑制细胞的凋亡、调节突触可塑性等作用在糖尿病脑病中特别引起研究者关注,而且认为神经营养因子的缺乏是糖尿病脑病的病理机制之一[2]。神经营养因子的缺乏导致神经生存转导信号的异常,Bax表达增强、Bax/Bcl-2比值增大引发凋亡级联反应使神经元凋亡[3]。
我们前期的实验发现银杏叶提取物(extract of Ginkgo biloba,EGB)可通过降低海马Bax的表达、减小Bax/Bcl-2比值从而减少神经细胞的凋亡,提高神经细胞的密度,保护I型糖尿病大鼠的认知功能的损伤[4]。但EGB对糖尿病大鼠海马的抗凋亡作用是否与其影响糖尿病大鼠海马神经元的神经营养因子的表达有关,有待进一步证实。本课题用STZ诱导I型糖尿病模型,进一步研究EGB对海马神经神经生长因子(nerve growth factor,NGF)、神经营养因子-3(neurotrophin-3,NT-3)表达的影响,探讨EGB对糖尿病脑病的保护机制。
1 材料与方法
1.1 主要试剂和设备
链脲佐菌素(streptozocin,STZ)及枸橼酸钠分析纯购于美国sigma公司;银杏叶提取物(EGB)购于北京双鹤高科天然药物有限公司,批号:100718;兔抗鼠NGF、NT-3多克隆抗体及辣根过氧化物酶(HRP)标记的羊抗兔二抗购于北京中杉生物技术有限公司;NGF、NT-3、及β-actin引物合成并订购于上海生工生物工程有限公司;BCA蛋白定量测定试剂盒购自美国Pierec公司,BeyoECL Plus(免疫印迹化学发光试剂盒)购自碧云天生物技术有限公司;Morris水迷宫由温州医学院药理研究所提供。MUVB-20凝胶成像分析系统(美国Ultralum公司)。
1.2 实验动物的分组和糖尿病模型的建立
SPF级标准健康雄性SD大鼠30只,由温州医学院实验动物中心提供,动物许可证号:SYXK(浙2010-0150),体重180~220 g,鼠龄2个月,随机分成正常对照组(10只)和糖尿病模型组(20只),糖尿病模型组大鼠禁食12 h后,按65 mg/kg剂量腹腔注射链脲佐菌素,正常对照组则给予等体积的生理盐水腹腔注射。注射后72 h测血糖在13.8 mmol/L以上者为制造模型成功。成功模型大鼠随机分为糖尿病组(DM组)、银杏叶组(EGB组)。EGB组按8 mg/(kg.d)剂量腹腔注射EGB,糖尿病组和正常对照组则给予等体积的生理盐水腹腔注射。所有动物自由进食、饮水,饲养,每周测体重1次,每两周测血葡萄糖1次,饲养12周后行股动脉放血处死大鼠。冰浴上立即取出脑并分离两侧海马组织,并将海马组织分别固定于10%中性福尔马林液及-70℃储存备用。
1.3 大鼠生长过程中的相关指标的测定
观察大鼠精神状态、每周监测各组大鼠的体重,并每两周行断尾采血法(采用Johnson稳步倍加血糖仪)测定大鼠血糖以动态监测大鼠血糖水平的变化。
1.4 Morris水迷宫实验
Morris水迷宫圆形,直径 1.5 m,平台直径12 cm,水深30 cm。平台置于迷宫东北象限正中,水面高出平台5 cm,水温保持在22℃~25℃。各组大鼠在实验第12周开始水迷宫训练,将大鼠移至暗室中适应30 min后开始测定。训练或测试时大鼠头朝池壁,分别从正东、正南、正西、正北四个象限入水,设定最长游动时间为120 s。120 s未找到平台者,将其引至平台,放置30 s引导其学习与记忆。每只大鼠每天实验一次,共进行5 d,前4天为训练时间,第5天为测试。数据采集及图像分析均有图像自动监视和处理系统完成。实验结束后记录各实验动物的搜索到达平台所需的时间或称潜伏期和搜索平台的策略(直线式,记分4分;曲线式,记分3分,随机式,记分2分;圆圈式,记分1分)。
1.5 Western bot免疫印迹法检测海马组织中NGF和NT-3的蛋白表达
于-70℃冰箱取出海马组织(每组各3只),Western bot免疫印迹法具体步骤同前期试验所述[4],所用一抗浓度:NGF 1∶500、NT-3 1∶500、GADPH 1∶1 000、二抗浓度:1∶5 000
1.6 RT-PCR法检测大鼠海马组织NGF和NT-3的mRNA的表达
于-70℃冰箱取出海马组织,按Trizol试剂说明书方法提取海马组织总RNA。取1 μ g进行RT-PCR反应。所用RT-PCR扩增引物(β-actin为内参对照)如表1。PCR变性、退火和延伸温度分别为94℃,56℃和72℃,反应时间分别为15 s,45 s和60 s,共进行35个循环。循环完毕再 72℃延伸 10 min。PCR产物用2%琼脂凝胶电泳分析。电泳后在紫外灯下拍摄照片,然后用MUVB-20凝胶成像分析系统(美国Ultralum公司)对每一标本的PCR产物扩增的特异性片段进行灰度扫描,以β-actin密度作为参考定量标准,数值以两者之积分吸光度的比值表示。
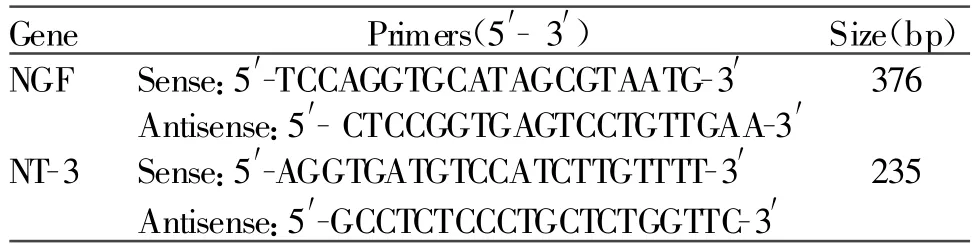
Tab.1 Sequence of primers and length of PCR products
1.7 统计学处理
采用SPSS 18.0统计学软件进行分析,计量资料以均数±标准差(±s)表示,多组比较用单因素方差分析,均数间的两两比较用q检验。
2 结果
2.1 一般情况
Con组大鼠体型适中,精神状况良好,动作自如,反应灵敏,毛发平伏有光泽;DM组大鼠消瘦,精神萎靡,反应迟钝,毛竖无光泽,动作迟缓,弓背蜷体;EGB组相对DM组大鼠体型较胖,精神状况与正常无差别,毛发较有光泽,活动度较好。在为期12周的实验中,每周比较各组实验大鼠的体重,DM组大鼠的体重明显低于Con组和EGB组(P<0.05,图1)。
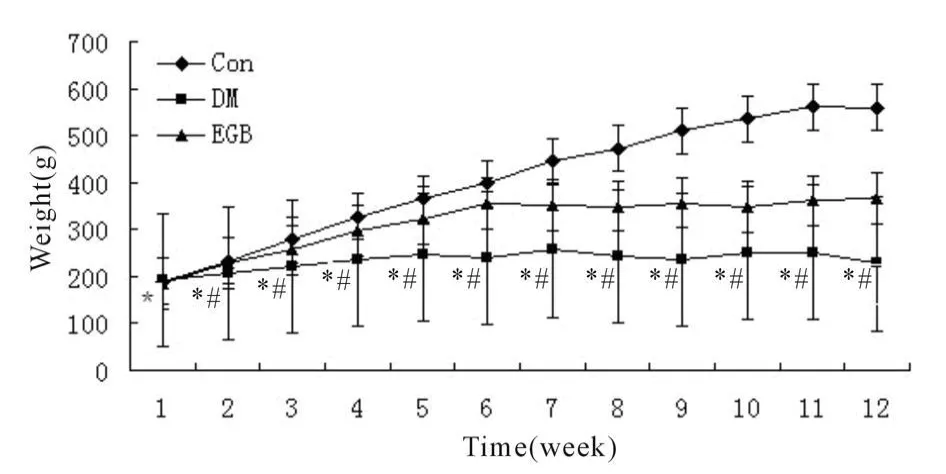
Fig.1 Weight change of each group rat(±s,n=8~10)Con:Control group;DM:Diabetic group;EGB:EGB-treated group
2.2 EGB对I型糖尿病大鼠血糖水平的影响
在为期12周的试验中,Con组大鼠血糖稳定在正常水平,DM组大鼠血糖升高并趋持续升高状态,而EGB组血糖明显低于DM组,并相对稳定,无持续升高的趋势,DM组和EGB组比较,有显著差异(P<0.05,图2)。
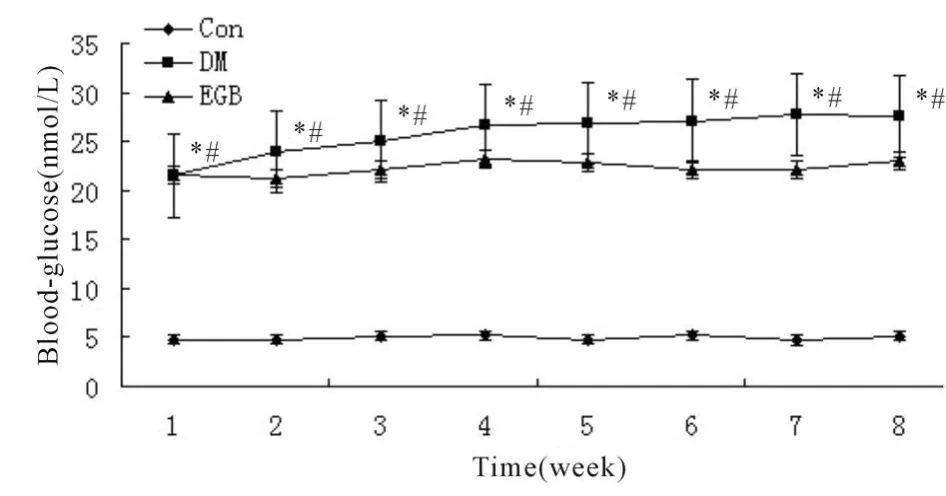
Fig.2 Effect of EGB on blood glucose of rats in each group(±s,n=8~10)
2.3 实验动物的空间学习记忆能力测试及评价
Morris水迷宫实验的第1~2天,各组间潜伏期比较无显著差异(P>0.05);第3天出现正常对照组潜伏期明显较DM组和EGB组缩短(P<0.05,P<0.01),而DM组和EGB组比较差异无统计学意义(P>0.05);第4天出现正常组、EGB组的潜伏期均明显较DM组缩短(P<0.01),但正常组与EGB组比较无显著差异(P>0.05);第5天出现正常组、EGB组的潜伏期均明显较DM组缩短(P<0.05,P<0.01),但正常组与EGB组比较无显著差异(P>0.05,图3)。比较第5天各组实验大鼠搜索平台的策略:从高分到低分依次为正常对照组>EGB组>DM组,DM组分别与正常对照组和EGB组比较均有显著性差异(P<0.01),而正常对照组与EGB组比较无显著性差异(P>0.05,图4)。
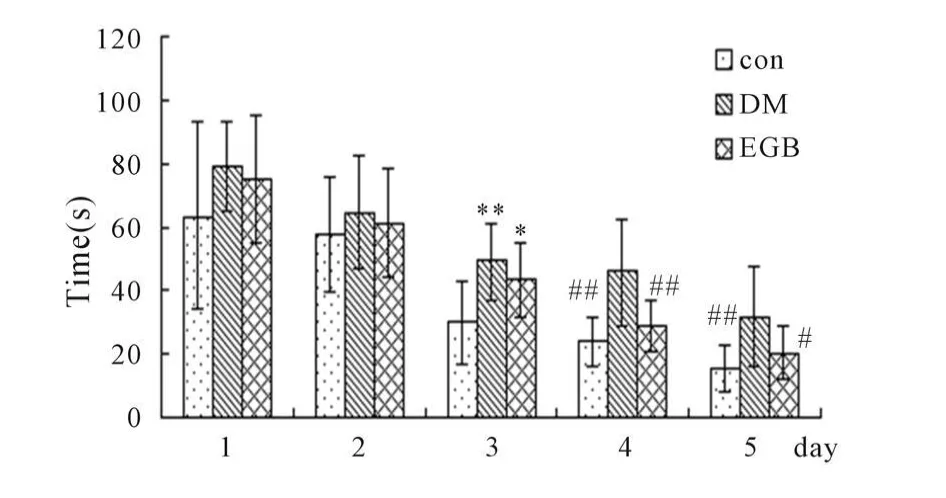
Fig.3 Effect of EGB on escape latency of Morris water maze test(±s,n=10)
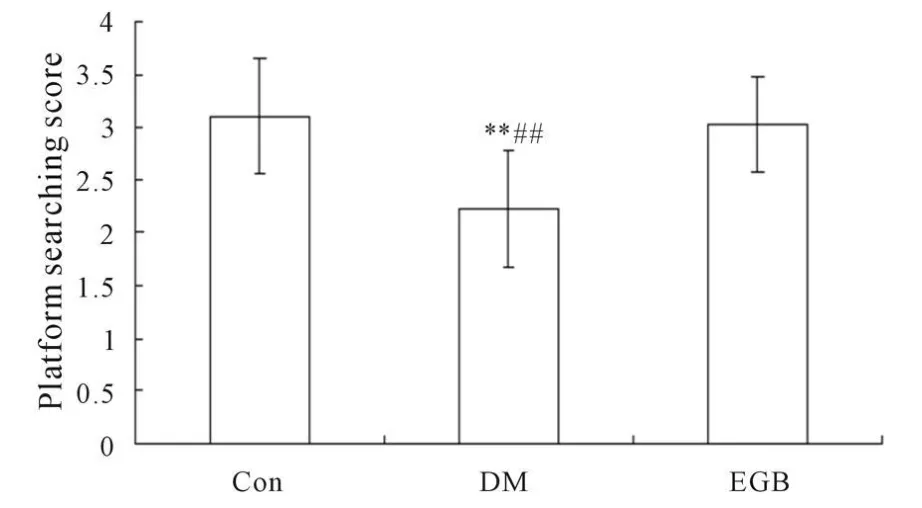
Fig.4 Effect of EGB on the platform searching score of Morris water maze test(±s,n=10)
2.4 各组大鼠海马神经细胞的形态学观察
取各组海马组织,10%福尔马林液固定,常规HE染色,光镜下可见Con组大鼠海马神经元排列紧密,未见明显的神经元核固缩或体积缩小;DM组、EGB组大鼠海马区神经细胞出现不同程度的核固缩,细胞体积变小,部分区细胞稀少,海马区神经细胞排列紊乱,以CA1和CA2段为著,但EGB组大鼠的海马区的病变相对减少(图5,见彩图页Ⅰ)。

2.5 各组大鼠海马组织NGF、NT-3蛋白Western blot的检测结果
NGF和NT-3蛋白在Con组大鼠海马组织中的表达分别为0.827±0.115;2.643±0.344;在EGB组大鼠海马组织中的表达分别为0.987±0.006;2.48±0.12;而两者在DM组大鼠海马组织中的表达明显减弱,分别为 0.563±0.119;1.563±0.471。DM组大鼠海马组织NGF和NT-3蛋白的表达分别与Con组、EGB组比较,差异显著(P<0.05,图6)。
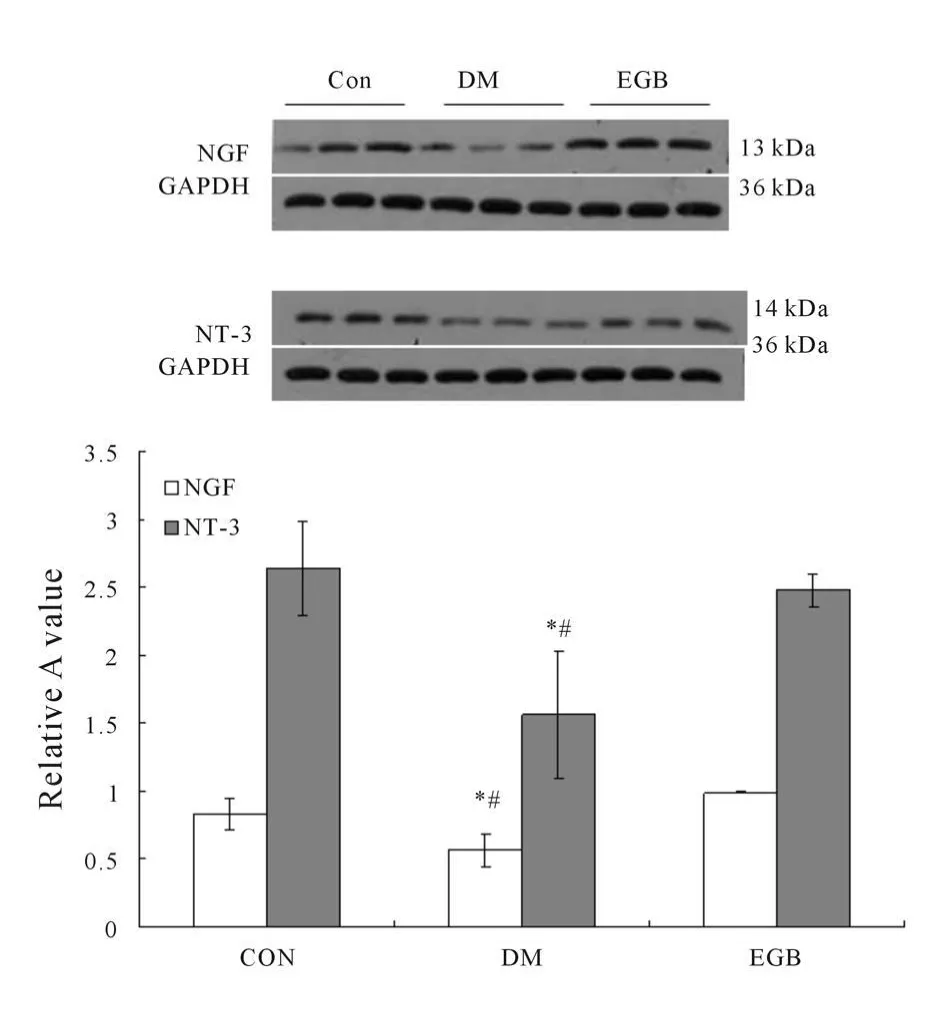
Fig.6 Western blot analysis of NGF and NT-3 in hippocampus of rats(±s,n=3)
2.6 各组大鼠海马组织中NGF、NT-3基因的mRNA表达的RT-PCR检测结果
NGF mRNA和NT-3 mRNA在Con组大鼠海马组织中的表达分别为1.709±0.007;4.72±0.243;在EGB组大鼠海马组织中的表达分别为1.749±0.054;4.35±0.042;而两者在DM组大鼠海马组织中的表达明显减弱,分别为0.912±0.094;2.456±0.237。DM组大鼠海马组织NGF mRNA和NT-3 mRNA的表达分别与Con组、EGB组比较,差异显著(P<0.05,图 7)。
3 讨论
我们前期的实验发现I型糖尿病大鼠认知功能的障碍与海马神经元的丢失,神经元的凋亡密切相关。EGB可通过线粒体通路减少海马神经元的凋亡,提高海马神经元密度从而减少糖尿病对海马神经元的损伤,保护糖尿病脑病大鼠的认知功能。事实上,神经元存活和凋亡都是通过复杂的调控机制完成的[5,6]。
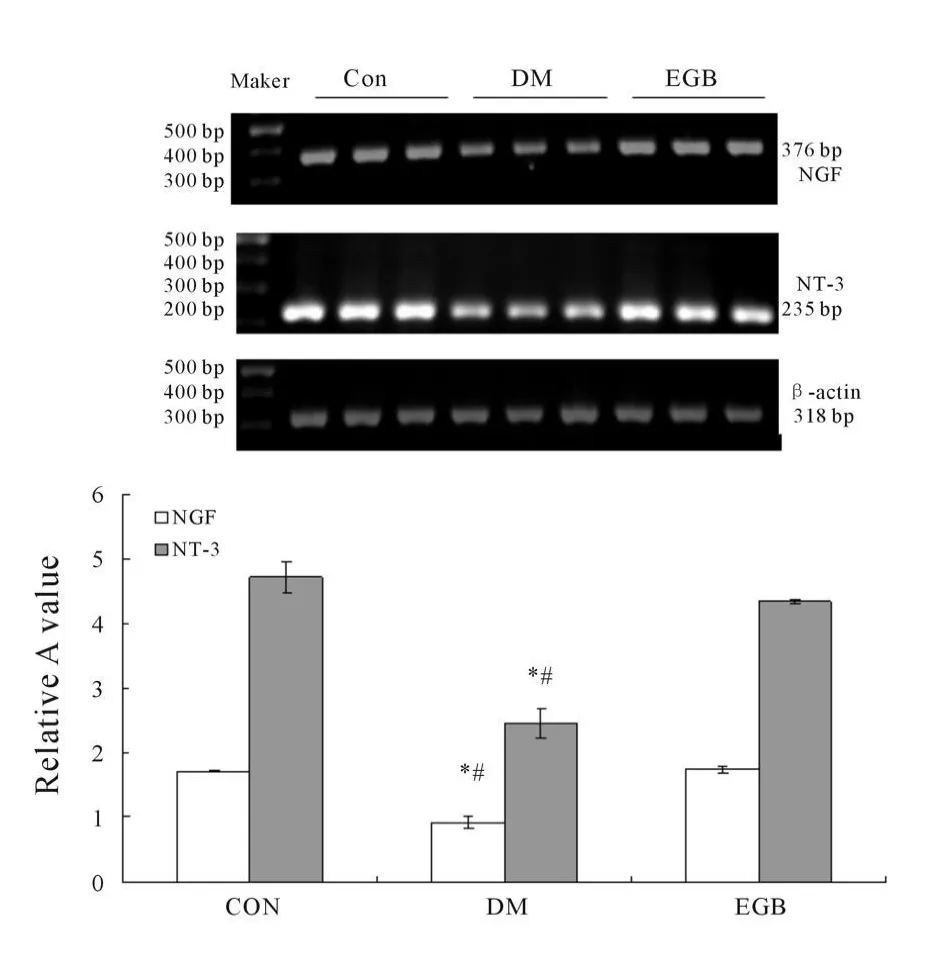
Fig.7 RT-PCR analysis of NGF mRNA and NT-3 mRNA in hippocampus of rats(±s,n=3)
神经营养因子家族(neurotrophic factors,NTFs)是一类小分子多肽物质,在神经系统的发生、发育过程中能促进细胞的增殖、生长、生存及功能表达。在成熟的神经系统中具有维持神经细胞生存的作用。经典的NTFs包括神经生长因子(NGF)、脑源性神经营养因子(BDNF)、神经营养因子-3(NT-3)和神经营养因子4/5(NT4/5)等,它们具有同源性。研究发现NGF、NT-3对海马等胆碱能神经元的抑制凋亡作用是通过它们与其特异性的受体(p75和TrKs)的结合而发挥生物学效应的[7,8]。NGF、NT-3均可以与其特异性的受体(p75和TrKA)的结合,主要通过PI-3K/AKT和ras-MAPK通路激活神经细胞内的信号转导,维持神经元的存活;反之,在凋亡等损伤刺激因子的作用下,神经营养因子缺乏可使神经元功能受损,促凋亡蛋白Bax表达增加,Bax/Bcl-2的比值增大引发凋亡级联反应导致神经元凋亡的发生[3]。
本实验通过STZ诱导的I型糖尿病大鼠的模型,动态观察糖尿病大鼠的体重和血糖变化,发现12周内糖尿病大鼠的血糖一直趋于上升的趋势,同时体重明显的减轻。12周末的Morris水迷宫实验显示糖尿病大鼠潜伏期延长,搜索平台的策略明显降低,提示此时糖尿病大鼠已经出现明显的认知功能损伤。海马组织学观察发现糖尿病脑病大鼠海马结构的异常,表现为海马区神经细胞出现不同程度的核固缩,细胞体积变小,部分区细胞稀少,海马区神经细胞排列紊乱。说明12周的模型大鼠出现认知功能损伤的同时海马形态学也表现异常。研究表明海马与学习记忆功能密切相关,海马的损伤直接影响其功能。本实验Western blot免疫印迹和RT-PCR的实验结果发现糖尿病大鼠海马组织中NGF、NT-3蛋白含量及mRNA的表达都明显低于正常对照组,提示糖尿病大鼠海马神经元处于神经营养因子的缺乏或低营养状态。糖尿病大鼠海马神经元的神经营养因子的缺乏,神经元生存能力的降低,导致海马神经元的丢失(主要表现为凋亡)与认知功能障碍有关。神经营养因子的缺乏可能是糖尿病脑病大鼠认知功能障碍的重要原因[9]。最近有研究发现,增加海马区NGF水平能够减少老化鼠的脑神经元凋亡,从而降低脑组织老化和神经元损害的风险[10]。本实验EGB干预治疗后,糖尿病大鼠的体重增加、血糖明显改善,海马神经元的病理学改变减轻。Morris水迷宫实验显示糖尿病大鼠潜伏期缩短,搜索平台的策略明显提高,提示EGB能改善糖尿病脑病大鼠的认知功能,同时也说明减轻糖尿病大鼠海马神经元的损伤可改善糖尿病大鼠的认知功能。Western blot免疫印迹和RT-PCR的实验结果发现EGB干预后糖尿病大鼠海马的NGF、NT-3的表达明显增加,可见EGB能有效提高糖尿病大鼠海马神经元的NGF、NT-3的表达。实验结果提示EGB改善糖尿病大鼠的认知功能障碍与其提高糖尿病脑病大鼠海马神经元的NGF、NT-3的表达水平,缓解或部分缓解海马神经元神经营养缺乏有关。
我们前期的实验发现EGB可降低糖尿病大鼠海马神经元的Bax、Caspase-3的表达以及Bax/Bcl-2的比值,减少神经元的凋亡,提示EGB可通过线粒体凋亡途径发挥其抗神经元凋亡作用的。而Bax、Bcl-2和caspase-3等是PI-3K/AKT和ras-MAPK通路的下游分子,因此,我们推断EGB增加糖尿病大鼠海马神经元的神经营养因子NGF、NT-3的表达,NGF、NT-3与其受体结合后,可能通过PI-3K/AKT和ras-MAPK通路下调糖尿病大鼠海马神经元Bax、Caspase-3的表达及Bax/Bcl-2的比值,从而提高神经元的抗凋亡的能力,发挥其对糖尿病大鼠认知功能的保护作用。但其内在的机制尚未完全清楚,有待进一步的深入研究。
[1]Mijnhout G S,Scheltens P,DiamantM,et al.Diabetic encephalopathy:A concept in need of a definition[J].Diabetol,2006,49(6):1447-1448.
[2]尹国平,陈 丽.神经营养因子与糖尿病脑病[J].国际内分泌代谢杂志,2006,26(2):119-122.
[3]Juan J,Yankner B A.Apoptosis in the nerve system[J].Nature,2000,407(6805):802-809.
[4]李剑敏,万 丽,王蓉蓉,等.银杏叶提取物对1型糖尿病大鼠认知功能及海马神经细胞凋亡的影响[J].中国病理生理杂志,2010,26(2):266-271.
[5]Meier P,Finch A,Evan G.Apoptosis in development[J].Nature,2000,407(6805):796-801.
[6]Savill J,Fadok V.Corpse clearance defines the meaning of cell death[J].Nature,2000,407(6805):784-788.
[7]Kraemer R,Baker P L,Kent K C,et al.Decreased neurotroph in TrkB receptor expression reduces lesion size in the apolipoprote in E-null mutant mouse[J].Circulation,2005,112(23):3644-3653.
[8]Mutoh T,Tachi M,Yano S,et al.Impaiment of Trk-neurotroph in receptor by the serum of apatient with subacute sensory neuropathy[J].Arch Neurol,2005,62(10):1612-1615.
[9]杨 芳,姬志娟,王蓬文,等.前体蛋白N端11肽对糖尿病小鼠脑海马神经元神经生长因子、神经元纤维蛋白及早老蛋白1表达的影响[J].中国糖尿病杂志,2002,10(03):152-154.
[10]Chae C H,Kim H T.Forced,moderate-intensity treadmill exercise suppresses apoptosis by increasing the level of NGF and stimulating phosphatidylinositol 3-kinase signaling in the hippocampus of induced aging rats[J].Neurochem Int,2009,55(4):208-213.
