急性低氧性缺氧小鼠血液粘度与红细胞流变性变化*
2012-08-30李新妙许帼杰刘晓彬牛春雨赵自刚
张 敏,李新妙,冯 季,许帼杰,刘晓彬,姜 华,牛春雨,赵自刚
(河北北方学院微循环研究所,张家口 075000)
充足的氧供是维持细胞能量代谢、保证细胞、组织、器官乃至机体生理功能的必要条件,而正常的血液流变性与红细胞流变性是保证组织、器官血液灌注以及维持氧供的重要因素;凡引起血液流变性与红细胞流变性的诸多因素(如:创伤、炎症)均可导致组织、细胞的氧供不足,成为组织细胞损伤的关键环节[1-3]。研究表明,多种疾病引起的慢性低氧性缺氧(hypoxic hypoxia)均可导致血液流变性异常与红细胞变形性下降[4-6],影响血管内皮功能[7],进而加重微循环障碍,引起组织缺血缺氧,形成恶性循环。但在临床实践中,由于自然灾害、意外事故等因素导致的急性低氧性缺氧(acute hypoxic hypoxia,AHH),对血液流变性与红细胞流变性有何影响值得研究,这也是在临床救治过程中需要关注的问题。为此,本文观察了不同时间的急性低氧性缺氧对血液粘度与红细胞变形性的影响,进一步明确血液流变性变化在急性低氧性缺氧发展进程中的作用,以血液流变性为研究靶点,为急性低氧性缺氧的临床干预提供实验依据。
1 材料与方法
1.1 实验动物与分组
健康昆明小鼠32只(购自北医三院动物中心),雌雄不拘,体重(29±2)g,按照数字随机表法随机分为对照组(n=8)、急性低氧性缺氧组(简称“低氧组”,n=24),由于小鼠在100 ml缺氧瓶中的死亡时间为13~15 min,因此为了观察血液粘度与红细胞流变性在小鼠急性低氧性缺氧发展进程中的变化,将低氧组进一步分为三个亚组(n=8):低氧5 min组、低氧8 min组、低氧11 min组,小鼠饲养环境:室温20℃~23℃,相对湿度55%±15%,照明度 280~350 LX,光照节律12 h明12 h暗,昼夜交替,标准口粮(购自中国军事医学科学院实验动物中心),清洁饮水,自由饮食。实验前所有小鼠禁食12 h,自由饮水。实验过程中动物处置符合动物伦理学标准。
1.2 动物模型复制与标本留取
将3组实验组小鼠依次置于低氧瓶中,在盖紧瓶塞即刻记录时间,分别低氧5 min、8 min、11 min,并密切观察小鼠的活动情况、口唇及爪和尾部的发绀情况,复制急性低氧性缺氧模型。在低氧瓶中放入5 g的钠石灰,以吸收小鼠在缺氧过程中呼吸出的二氧化碳,避免二氧化碳对呼吸中枢的刺激作用,以保证模型更符合临床实际。在相应时间点,将小鼠直接在缺氧环境下快速颈椎脱臼法处死,用1 ml注射器从小鼠心尖抽取血液0.8~1 ml于试管中;对照组小鼠置于低氧瓶中,但不给予低氧,5 min后直接颈椎脱臼法处死后从心尖抽取0.8~1 ml于试管中。将0.2%的肝素(北京奥博星生物技术责任有限公司)溶液以0.3 ml/ml的比例缓缓加入留取的全血标本中抗凝,轻轻混匀。
1.3 红细胞比积测定
毛细管法:将抗凝血移入毛细管中,长度为40 mm左右,两端用肥皂封口,在TGL-12B型离心机(上海安亭科学仪器制造厂)以4 000 r/m的速度离心12 min,测毛细管中抗凝血柱全长和红细胞沉积度,计算红细胞压积(hematocrit,Hct)。
1.4 全血粘度测定
应用3-9D型微循环、血流变、红细胞变形仪(成都麦赛科贸公司)通过综合传感法检测各组小鼠的全血粘度,根据全血切变率的范围:低切变率(1~20/s)、中切变率(50~60/s)、高切变率(范围 100~300/s),结合血粘度的参数设置,本实验选择了1.0/s、10.3/s、30.7/s、40.3/s、115.0/s、300.0/s 等切变率下的全血粘度值作为观察指标;然后将全血标本置于KA-1000型离心机(上海飞鸽)中,以3 500 r/min转速离心10 min,取血浆置流变仪中检测血浆粘度。
1.5 红细胞电泳
将上述离心后沉淀的血细胞与生理盐水1∶1混匀,再次以2 500 r/m转速离心10 min,弃上清液,留取底部洗涤后的血细胞沉淀物待测。将制备好的电泳液和电极液(配制方法见参考文献[8])用吸管和加样器加入电泳板的电泳槽和电极槽中,将制备的红细胞加到电泳板上,用综合分析仪中的电泳仪进行群体细胞电泳,测量红细胞移动的最大距离和最小距离,记录数据测得红细胞电泳率。根据全血粘度、血浆粘度、Hct结果,由四用分析仪的参数分析系统计算红细胞聚集指数与红细胞变形指数。
1.6 统计学处理
2 结果
2.1 血液流变学指标的变化
低氧5 min组各切变率下的全血粘度、全血高切相对粘度、全血低切还原粘度均显著低于对照组(P<0.05),低氧11 min组各切变率下的全血粘度、全血低切还原粘度均显著低于对照组(P<0.05),低氧8 min组全血粘度各指标与对照组均无统计学差异(P>0.05);低氧8 min组的全血高切相对粘度、全血低切还原粘度均显著高于低氧5 min组(P<0.05);各组间小鼠血浆粘度无统计学差异(P>0.05,表 1)。
Tab.1 Changes of blood viscosity indices in mice(/s, ±s,n=8)

Tab.1 Changes of blood viscosity indices in mice(/s, ±s,n=8)
AHH:Acute hypoxic hypoxia*P<0.05 vs control group;#P<0.05 vs AHH for 5 min group
Whole blood viscosity(/s)Group 1.0 10.3 30.7 40.3 115.0 300.0 Relative viscosity(300)Reduced viscosity(1.0)Plasma viscosity(100.0)Control 7.199±1.524 5.170±1.093 3.706±0.783 3.400±0.719 2.442±0.516 2.132±0.451 2.060±0.433 0.173±0.030 1.044±0.180 AHH for 5 min6.195±0.757*4.449±0.544*3.189±0.390*2.925±0.358*2.101±0.257*1.835±0.224*1.665±0.203*0.131±0.013*1.105±0.092 AHH for 8 min6.845±1.076 4.916±0.772 3.523±0.554 3.232±0.508 2.405±0.468 2.027±0.318 2.022±0.364#0.160±0.040#1.033±0.254 AHH for 11 min5.991±0.544*4.303±0.390*3.084±0.280*2.829±0.257*2.032±0.184*1.775±0.161*1.860±0.281 0.145±0.020*0.964±0.087
2.2 红细胞变形性参数的变化
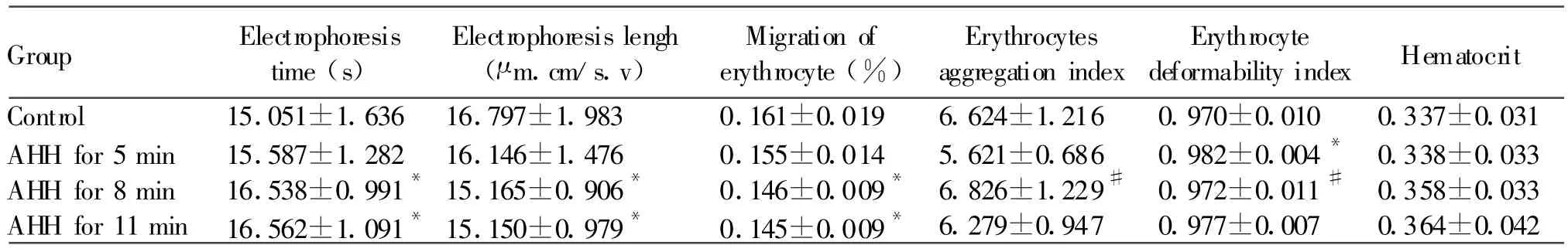
低氧5 min组红细胞变形指数高于对照组(P<0.05),其它指标与对照组无统计学差异(P>0.05);低氧8 min组和低氧11 min组的群体细胞电泳时间显著长于对照组、细胞电泳长度与细胞迁移率显著低于对照组(P<0.05),低氧8 min组的红细胞变形指数显著低于、红细胞聚集指数高于低氧5min组(P<0.05)。此外,低氧5 min组、低氧8 min组和低氧11 min组的Hct与对照组比较无统计学差异(P>0.05,表2)。
Tab.2 Changes of erythrocyte rheology indices in mice(±s,n=8)
Tab.2 Changes of erythrocyte rheology indices in mice(±s,n=8)
AHH:Acute hypoxic hypoxia*P<0.05 vs control group;#P<0.05 vs AHH for 5min group
Group Electrophoresis time(s)Electrophoresis lengh(μ m.cm/s.v)Migration of erythrocyte(%)Erythrocytes aggregation index Erythrocyte deformability index Hematocrit Control 15.051±1.636 16.797±1.983 0.161±0.019 6.624±1.216 0.970±0.010 0.337±0.031 AHH for 5 min 15.587±1.282 16.146±1.476 0.155±0.014 5.621±0.686 0.982±0.004* 0.338±0.033 AHH for 8 min 16.538±0.991*15.165±0.906* 0.146±0.009* 6.826±1.229# 0.972±0.011# 0.358±0.033 AHH for 11 min 16.562±1.091*15.150±0.979* 0.145±0.009* 6.279±0.947 0.977±0.007 0.364±0.042
3 讨论
缺氧是临床上常见的、许多疾病共有的病理过程。以往研究表明,低氧性缺氧可以使动脉氧分压、氧含量、血氧饱和度以及血红蛋白携氧能力降低,进而导致红细胞流变性和血液粘度异常,这又成为疾病恶化的重要因素。因此,进一步的研究血液粘度和红细胞流变性的变化可以为临床抢救提供可靠依据。
血液粘度是血液的主要流变学特性并赋予血流以固有的阻力,粘度愈高流动性愈小[5]。本研究结果显示,低氧5 min全血粘度出现了下降,随后8 min时又出现了升高的趋势,而在11 min则再次下降,因全血粘度主要受红细胞数量的影响,故据研究结果可推测,小鼠急性缺氧引起了机体的应激反应,交感神经、肾上腺髓质系统兴奋,导致血管收缩,组织液回流增加,引起了血液稀释,导致血液粘度下降,早期的这种变化对于维持良好的血液循环是有利的。血浆粘度主要与血浆蛋白有关,急性缺氧引起的应激情况下,可能会引起纤维蛋白原等急性时相反应蛋白的生成增多,但由于随之带来的血液稀释,导致血浆蛋白浓度并未出现显著变化,故血浆粘度并没有出现统计学变化,因此,去除血浆粘度影响的全血高切相对粘度就出现了与全血粘度相一致的结果。同样,由于红细胞比积虽有下降趋势、但没有统计学差异,也就使得去除红细胞比积影响的全血低切还原粘度变化与全血粘度相一致。应当看到,与对照组相比,低氧8min的全血粘度与低氧5 min、11 min的结果不一致,结合全血高切相对粘度与全血低切还原粘度的变化,全血粘度的这种变化与血浆蛋白、红细胞数量对于全血粘度影响的相互作用有关,其具体机制还有待进一步研究。
红细胞流变性受多种因素的影响。红细胞电泳能力及红细胞变形性是红细胞流变性的重要指标,红细胞电泳反映红细胞的流动性,红细胞变形能力是红细胞在外力作用下改变新的形状的能力,二者对于保障血液的流动性、红细胞寿命和微循环有效灌注起着重要作用[9]。本研究结果发现,低氧5 min后,红细胞变形指数增高,低氧8 min组和低氧11 min组的群体细胞电泳时间显著长于对照组、细胞电泳长度与细胞迁移率显著降低,低氧8 min组的红细胞变形指数显著低于、红细胞聚集指数高于低氧5 min组,结果表明,急性缺氧引起了小鼠的红细胞流变性异常,这也是加重微循环障碍的关键因素。
综上所述,急性低氧性缺氧引起了小鼠的血液流变性异常,表现在血液低粘、红细胞电泳能力与变形性下降、红细胞聚集性增加;尽管血液低粘并非加重微循环障碍的原因,但低粘可进一步引起红细胞携氧能力下降[10],加重缺氧;研究结果也表明,红细胞流变性异常可能在急性缺氧引起的微循环障碍、组织细胞损伤的发病学中发挥更为主要的作用。
[1]尚金星,张 梅,赵自刚.缺氧致细胞凋亡发生机制研究进展[J].河北北方学院学报(医学版),2008,25(6):80-82.
[2]Pichon A,Connes P,Quidu P,et al.Acetazolamide and chronic hypoxia:effects on hemorheology and pulmonary hemodynamics[J].Eur Respir J,2012(Epub ahead of print).
[3]van PatotM C,GassmannM.Hypoxia:adapting to high altitude by mutating EPAS-1,the gene encoding HIF-2α[J].High Alt Med Biol,2011,12(2):157-167.
[4]Yelmen N,Ozdemir S,Guner I,et al.The effects of chronic long-term intermittent hypobaric hypoxia on blood rheology parameters[J].Gen Physiol Biophys,2011,30(4):389-395.
[5]Esteva S,Panisello P,Torrella J R,et al.Blood rheology adjustments in rats after a program of intermittent exposure to hypobaric hypoxia[J].High Alt Med Biol,2009,10(3):275-281.
[6]梁晚益,罗德成,高珏琪,等.缺氧时大鼠红细胞变形性损伤的机制研究[J].中国应用生理学杂志,1997,13(4):306-308.
[7]Boyer L,Chaar V,Pelle G,et al.Effects of polycythemia on systemic endothelial function in chronic hypoxic lung disease[J].J Appl Physiol,2011,110(5):1196-1203.
[8]李俊杰,王伟平,牛春雨,等.正常淋巴液对大鼠血液流变性异常的干预作用[J].中国微循环,2006,10(3):250-253.
[9]赵自刚,张玉平,刘春艳,等.肠系膜淋巴管结扎对急性失血大鼠红细胞流变性的影响[J].中国应用生理学杂志,2010,26(4):470-473.
[10]吴 忧,冯静茹,张 赛,等.不同容量液体对失血性休克家兔早期复苏效果的影响[J].中国血液流变学杂志,2009,19(3):338-341.
