5种水生植物在低浓度污水中氮、磷固定能力比较研究
2012-08-28卜俊超蔡雄彬
邓 然,卜俊超,蔡雄彬
(西南林业大学 园林学院,云南 昆明 650224)
1 引言
近年来,自然湿地系统在人为因素和自然因素的影响下出现了水位下降、萎缩退化、生境破碎的问题[1~4],原有的湿地植物无法适应不断增加的污染负荷而生长受到抑制并导致湿地功能退化,湿地系统由于污染负荷增加和功能退化的恶性循环几乎崩溃[5~7]。通过人为参与尽快的恢复并提升湿地系统功能,使其进入正常的状态成为解决这一问题的唯一途径。生态恢复提出根据地带性规律、生态演替及生态位原理选择适宜的先锋植物来构造种群和生态系统,以达到土壤、植被与生物同步分级恢复,使生态系统逐步恢复到一定的功能水平[8]。但是,由于对引用先锋植物的认知不够全面,盲目引进、缺乏管理加之水体中丰富的营养,使先锋植物在短时间内占据湿地的生境空间,形成单一型种群[10~12],这类有意引进外来物种造成的生物入侵占入侵物种数的49.80%[13],如大薸(Pistia stratiotes)、凤眼莲(Eichhornia crassipes)、空心莲子草(Alternanthera philoxeroides)、互花米草(Spartina alterniflora)等恶性杂草被认为是全球100种最具威胁的外来物种。人为干扰造成的生物入侵给原本脆弱的生态系统造成了更加严重的创伤[14]。
为了确保人为参与湿地恢复的安全性和有效性,这需要在湿地植物的选择前对它们有更全面深入的了解。本实验选择了5种在湿地中常见的植物:大薸、芦苇(Phragmites australis)、水葱(Schoenoplectus tabernaemontani)、茭 草 (Zizania latifolia)、荇 菜(Nymphoides peltatum)作为研究对象,它们在严重富营养化的水体中生长旺盛容易成为优势种,具备生物入侵植物所需的特点。实验将5种植物种植于低浓度生活污水中,观察它们在低浓度污水中生物量、TN、TP含量的动态变化及生长状况,研究这些植物种类在低浓度污水中是否能表现出旺盛的生长能力,以及对营养元素氮、磷的固定能力。通过以上指标分析这5种植物在湿地系统富营养化情况得到缓解后是否依然具有入侵性以及维护系统稳定性的能力。
2 材料与方法
实验在2010年6~10月完成,5种植物均采自滇池湿地,选择健康且生长状况相似的大薸、芦苇、水葱、茭草、荇菜植株,生物量为150g种植于直径、高分别为50cm、60cm的装有30cm厚细沙的塑料桶中,每只桶装生活污水26L,水深10cm;5种水生植物在生活污水栽培前用自来水驯化一个月,以使其根部得以修复;实验在室外进行,有充足光照;每种植物设2个重复,8个时间处理,每30d换1次污水,污水TN、TP浓度分别为13~17mg/L、1.0 ~1.9mg/L。实验分别在6月21日、7月9日、7月25日、8月10日、8月25日、9月10日、9月26日、10月31日进行植物采收并测量其生物量、TN、TP 浓度测定[16]。
每次实验时将塑料桶中的植株地上与地下部分以及凋落物全部取出,洗净泥沙以及叶面灰尘,沥干水分后称其鲜重得到生物量;放入理化干燥箱内150℃高温杀青15min,再调至70℃烘干至恒重后磨碎。植物样品采用浓硫酸-过氧化氢法消解,TN用次氯酸钠和水杨酸钠显色后采用分光光度法(GB 11894—1989)测定,植株TP钼酸铵显色后采用分光光度法(GB 11893—1989)测定。植物TN、TP累积量计算公式为:

式中 Pj和 Bj分别是第 j次植物 TN、TP浓度(mg/g)和生物量(g/m2)。
3 结果分析
3.1 不同湿地植物的生长状况及生物量动态变化
生物量迅速增长是生物入侵的最直接的表现,当一个物种的生物量达到一定值成为该地区的优势种,则表改变该地区原有的生态结构并对当地生态系统造成危害。由图1可见,经过4个月的生长,5种植物在污水中生物量都有明显上升,且各植物之间生物量差异明显,依次为:大薸(1599 g/m2)>水葱(918 g/m2)>茭草(711 g/m2)>芦苇(503 g/m2)>荇菜(430 g/m2)。大薸在污水中生物量最大,最高时达到1599g/m2,生物量增加速度稳定,除8月因为实验生活污水不能满足大薸生长高峰期生长所需营养,出现了叶片发黄腐烂的现象,生物量有所下降,更换污水后情况好转,10月大薸进入枯萎期,生物量再次下降[16];水葱生物量增加,期间生长状况良好,生物量呈阶段性增长,随着第一次生活污水的加入,水葱迅速萌发出新叶,生物量上升较明显,8月水葱地下茎及叶片在桶内均匀分布,生长速度较慢,生物量仅从520 g/m2增加到534 g/m2,进入9月后水葱生物量再次迅速上升,到实验结束达到最大值;茭草实验开始后迅速长出新的叶片,生物量明显增加,8月茭草出现了叶片发黄以及叶鞘腐烂的现象,造成生物量变化波动较大,9中旬后茭草生长进入枯萎初期,生物量增加较少。芦苇前期生长较缓慢,第一个月生物量仅从100.3 g/m2增加到 128.5 g/m2,此阶段芦苇地上部分的生长只表现为老茎上零星发出新芽,8月中旬之后由于新芽不断的生长以及地下茎萌发出新的植株,芦苇的生物量快速增加,9月26日以后生物量增加较少;荇菜生物量变化趋势与芦苇相似,与芦苇生长速度缓慢不同,荇菜实验开始后很快萌发出新叶及地下横走茎,但由于大量老叶腐烂导致荇菜前期生物量增长缓慢。8月荇菜进入生长旺盛期生长量明显多于腐烂量才表现出生物量的明显增加,9月底进入枯萎期以后生物量增加较少。
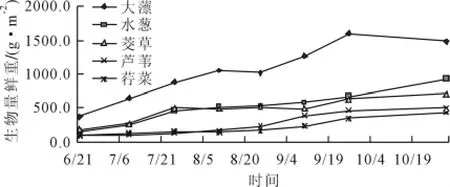
图1 不同植物生物量在生活污水中动态变化
5种植物在低浓度污水中大薸依然表现出明显的生长优势,实验开始后植株很快完全长满水面,在营养供给和生长空间受到限制时,出现了叶片腐烂的现象;芦苇、水葱与茭草均为挺水植物,在自然水体中生物量分别可达到8110 g/m2、1580 g/m2和1650 g/m2[17~19],都明显高于实验结果,说明此 3 种植物生物量受环境环境影响较大,当水体富营养情况得到改善后不会形成生物入侵;3种植物中茭草根系最为发达,芦苇次之,水葱根系最少且浅,大量研究结果表明,荇菜在富营养化水体中生物量干重可达到395.3 g/m2[18,20,21],东太湖水生植物群落结构的演变及其沼泽化,容易成为当地的优势种[22],实验中荇菜生物量最低,稳定性差,说明荇菜生长受到低浓度污水的抑制,不足以形成生物入侵;5种植物中大薸、荇菜和茭草极容易发生腐烂释放营养物质[23]水葱和芦苇释放强度低,不容易形成二次污染[22,24]。
3.2 不同植物TN浓度动态变化
氮素是植物中蛋白质、核酸、核蛋白、叶绿素及各种酶的组成成分,植物中TN浓度也反映了植物对营养物质的吸收能力及生长状况,植物体内营养物浓度与植株所处水环境有一定的相关性[25]。由图2可以看出,5种植物在实验设计的环境中TN浓度都出现了不同程度的下降,实验前荇菜(31.93mg/g)>大薸(17.91mg/g)>水葱(17.09 mg/g)>茭草(14.26mg/g)> 芦苇(9.95mg/g),实验结束后大薸(13.87 mg/g)>荇菜(8.27 mg/g)>茭草(7.51 mg/g)>芦苇(5.80 mg/g)>水葱(5.22 mg/g)。同一植物在不同阶段TN浓度变化也不同:大薸实验前后TN浓度在13.78~17.91 mg/g之间,下降23%,与其余4种植物的TN浓度都一直保持下降的趋势不同,大薸TN浓度在生物量增加缓慢或降低时,TN浓度还会表现出一定程度的上升;芦苇在整个实验过程中TN浓度稳定在5.22~9.95mg/g之间,而据文献报道,在富营养化水体中芦苇 TN 浓度可以高达 32.15 mg/g[26~28];荇菜、水葱、茭草在实验开始一个月后便完成了在新环境的调整,TN浓度迅速下降到相对稳定的大小:水葱TN浓度经一个月迅速从17.09mg/g下降到9.24mg/g,依然保持相对较慢的速度下降,而富营养化水体中水葱植物 TN 浓度可达37.36mg/g[29];茭草 TN 浓度在富营养化水体中为15.2mg/g[30],实验中下降至7mg/g后基本保持不变,还出现了叶片发黄腐烂的现象,说明茭草的TN浓度已经下降到该N环境极限值;荇菜受环境中N浓度影响最大,在高度富营养化水体中荇菜 TN 浓度为17.25mg/g[31],而在实验中荇菜 TN 浓度下降程度在5种植物中最大(74%),第一个月荇菜生物量变化虽然较小,但TN浓度明显下降66%,这与荇菜大量老叶腐烂及新茎叶萌发有关,之后荇菜生长情况较为稳定,TN浓度下降较缓慢。综上所述,5种植物在低浓度生活污水中,TN浓度容易受到水环境影响,还与生长量成反比关系,植物生长速度越快TN浓度下降越快。

图2 不同植物TN浓度在生活污水中动态变化
3.3 不同植物TN累计量动态变化
植物对N的固定能力与植物种类有关[32],相同植物在不同浓度污水中 TN 累积量也不同[25,33,34]。由图3可见,在污水中生长4个月,5种水生植物的TN累积量都有不同程度的明显上升,变化范围为417.1~1291 mg/m2,大薸TN累积量增加最多,荇菜最少,仅为大薸的30%。对N的固定能力由强到弱的顺序为:大薸(1755.96 mg/m2)> 茭草(875.42 mg/m2)>水葱(767.64 mg/m2)>芦苇(665.33 mg/m2)>荇菜(673.10 mg/m2)。同一植物在不同阶段单位面积TN累积量增加速度也不同:大薸7月整体上升较稳定,8月和9月每次换水TN累积量迅速上升15d后由于污水中N源减少后上升较缓慢;茭草实验开始后TN累积量迅速上升到815.73 mg/m2后,便在650 mg/m2上下波动,实验结束时TN累积量达到最大值875.42 mg/m2;水葱TN累计量经过15d迅速上升到591.95 mg/m2,之后 TN 累积量便在358.06 ~552.76 mg/m2之间波动;芦苇TN累计量仅大于荇菜,除了7月9日及8月25日出现一定程度降低以外,芦苇TN累积量整体上升较稳定;荇菜TN累积量最低,实验开始后由于大量老叶及叶片的腐烂导致TN累计量下降到最低值,但是经过一个月的调整后上升趋势稳定。

图3 不同植物TN累积量在生活污水中动态变化
3.4 不同植物TP浓度动态变化
P是植物生长所必须的元素之一,是水生植物生长、繁殖的限制因子[35],从植物TP浓度变化可以看出植物对P元素的需求量,以推测植物的入侵性。结合图2与图4可以看出,5种植物中N、P的含量相关性较低,与TN浓度相比,TP的浓度变化差异更明显:实验开始时5种植物之间的TP浓度差异较大,荇菜2.25mg/g>水葱(2.07 mg/g)>大薸(1.36 mg/g)>茭草(0.88 mg/g)>芦苇(0.84 mg/g),结束时差异明显缩小而且顺序也发生了明显变化,芦苇(0.87 mg/g)>大薸(0.83 mg/g)>茭草(0.76 mg/g)>水葱(0.65 mg/g)>荇菜(0.54 mg/g)。荇菜对生活污水中P源浓度较敏感,实验开始时TP浓度最高,经过30d的栽培后迅速从2.25mg/g降低到0.64mg/g成为最低,明显低于自然水体中荇菜的 TP浓度(1.52mg/g)[31];水葱对水体中P浓度反应较迟钝,虽然在实验设计的环境中 TP浓度从 2.07mg/g下降至 0.65mg/g,高达69%,但与荇菜的迅速下降不同,水葱TP浓度保持着较稳定的下降速度;大薸TP浓度经过45d从1.36mg/g下降至0.96mg/g后基本保持不变;茭草与芦苇TP浓度变化相似,实验前后变化较小分别为14%和5%,TP浓度出现了极少时间的波动,其他时间都较为稳定,说明茭草和芦苇对p浓度要就较高,不会因为环境中P的变化而发生较大的改变。
3.5 不同植物TP累积量动态变化
由图5可知,水生植物在实验设计污水环境中,TP与TN累积量的变化曲线有明显差异,不同植物对P的固定规律也差异较大,芦苇TP累积量增加最多,从 18.59 mg/m2增加到98.73 mg/m2,增加了431% 。对P固定能力从强到弱依次为:大薸(105.92 mg/m2)>芦苇(98.73 mg/m2)>水葱(94.96 mg/m2)>茭草(88.96 mg/m2)>荇菜(43.94 mg/m2)。芦苇实验前期由于生长缓慢导致TP累积量增加较慢,随着生长速度加快TP累积量也迅速上升,10月芦苇进入生长衰退期,TP累积量上升不明显;水葱TP累积量从 22.53 mg/m2增加到94.96 mg/m2,增加321% ,实验开始15d水葱TP累积量迅速增加后速度降低,8月10日上升至88.31 mg/m2后开始下降,直到9月25日下降至58.99 mg/m2后迅速上升至94.96 mg/m2;大薸TN累积量从37.36 mg/m2上升到105.92 mg/m2,上升184%,大薸TP累积量上升速度较稳定,9月10日以后大薸由于生长进入枯萎期,TP累积量出现了下降;茭草实验开始后TP迅速增加,1个月后TP累积量一直在85 mg/m2上下变动,实验结束后达到88.95 mg/m2,与开始时 37.00 mg/m2相比增加140%;荇菜TP累积量最低,从17.99 mg/m2增加到43.94 mg/m2,增加144%,TP累计量前期变化较小,8月25日后随着生物量的明显增加TP累积量也迅速增加。
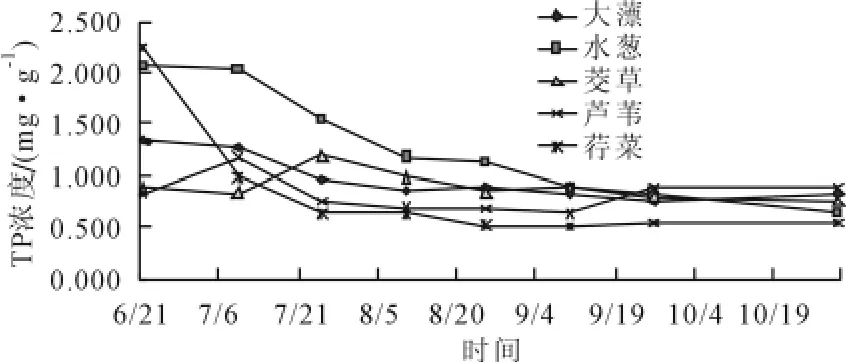
图4 不同植物TP浓度在生活污水中动态变化

图5 不同植物TP累积量在生活污水中动态变化
4 结果与讨论
本研究在2010年6月至10月通过对植物在26LTN、TP浓度分别为 13 ~17mg/L、1.0 ~1.9mg/L的生活污水栽培,30d换一次水的实验条件下生物量氮磷固定能力进行研究得到以下结论。
(1)5种植物生物量都有明显上升,且植物间差异显著,依次为大薸(1599 g/m2)>水葱(918 g/m2)>茭草(711 g/m2)>芦苇(503 g/m2)>荇菜(430 g/m2)。
(2)实验开始前植物之间TN浓度差异较大,依次为荇菜(31.93mg/g)>大薸(17.91mg/g)>水葱(17.09 mg/g)>茭草(14.26mg/g)>芦苇(9.95mg/g),在低浓度污水中5种植物TN浓度都发生了不同程度的下降,实验结束时大薸(13.87 mg/g)>荇菜(8.27 mg/g)>茭草(7.51 mg/g)>芦苇(5.80 mg/g)>水葱(5.22 mg/g)。
(3)实验开始时植物之间TP浓度差异明显:荇菜(2.25mg/g)>水葱(2.07 mg/g)>大薸(1.36 mg/g)>茭草(0.88 mg/g)>芦苇(0.84 mg/g),结束时差异明显缩小而且顺序也发生了明显变化,芦苇(0.87 mg/g)>大薸(0.83 mg/g)>茭草(0.76 mg/g)>水葱(0.65 mg/g)> 荇菜(0.54 mg/g)。
(4)对N的固定能力由强到弱依次为:大薸(1755.96 mg/m2)>茭草(875.42 mg/m2)>水葱(767.64 mg/m2)>芦苇(665.33 mg/m2)>荇菜(444.64 mg/m2)。
(5)对P的固定能力从强到弱依次为:大薸(105.92 mg/m2)>芦苇(98.73 mg/m2)>水葱(94.96 mg/m2)>茭草(88.96 mg/m2)>荇菜(43.94 mg/m2)。
大薸适应环境能力最强,在低浓度污水中依然表现出较强的生长势头,对N的固定能力及利用率极强,优势显著,对P的吸收固定能力与其他4种植物相比较优势不明显,对污水有较强的净化能力。大薸对环境因素如污水营养状况、生长面积等改变非常敏感,当环境因子出现不利情况时大薸表现出老叶发黄并腐烂的现象,生长速度也明显放慢,因此大薸应谨慎使用和精细管理,避免造成不必要的生物入侵和二次污染。
茭草和水葱在实验过程中表现相似,N、P固定能力在5种植物中属于中等水平。水葱在污水浓度降低的情况下生长状况依然稳定,TN、TP浓度下降速度稳定;而茭草会出现叶片发黄并腐烂的现象以保持TN、TP浓度在一个稳定的值。茭草对N、P的要求更高,根系发达对基质固定能力强,但茎叶稳定性底容易腐烂,在使用过程中容易形成二次污染,应注意及时收割;水葱对环境变化反应较慢。对N、P要求不高,植株稳定性较高不容易腐烂,但根系较浅,茎杆脆弱容易倒伏。
芦苇对环境中N、P浓度变化反应速度缓慢,N、P固定能力属于中等水平,有良好的上升空间,而且5种植物中芦苇的稳定性最高、最不容易腐坏、抗伏倒能力最强,不容易形成生物入侵,因此可以作为主导植物使用。
荇菜在富营养化水体中可以成为优势种,但在实验过程中表现最差,生物量低、生长状况不稳定、TN与TP累积量低,这是由于试验所设计的环境N、P浓度不满足荇菜的生长。而且荇菜的生长还受到水体透明度的影响,生长状况不理想时还会出现腐坏的现象。但是浮叶植物也有其独特的生态地位,可以应用于N、P浓度较高的富营养化严重的静水中。
[1]李忠平.我国高原湿地及其保护对策研究[J].林业资源管理,2006(4):36~39.
[2]田 昆,陆 梅,常凤来,等.云南纳帕海岩溶湿地生态环境变化及驱动机制[J].湖泊科学,2004,16(1):35~42.
[3]刘红玉,白云芳.若尔盖高原湿地资源变化过程与机制分析[J].自然资源学报,2006,21(5):810~817.
[4]赵仁昌.若尔盖草地沙化及防治对策[J].四川环境,1995(2):15~20.
[5]杨清海.中国富营养化水体修复技术进展[J].辽东学院学报:自然科学版,2008(6):71~77.
[6]洪雪花,李作生,杨春伟,等.云南湿地的现状和保护对策[J].云南环境科学,2006(25):58~60.
[7]沈亚强,王海军,刘学勤,等.滇中五湖水生植物区系及沉水植物群落特征[J].长江流域资源与环境,2010,19(1):111~118.
[8]张永泽.自然湿地生态恢复研究综述[J].生态学报,2001,21(2):309~314.
[9]李洪远,孟伟庆.湿地中的植物入侵及湿地植物的入侵性[J].生态学杂志,2006,25(5):577~580.
[10]王虹扬,黄沈发,何春光,等.中国湿地生态系统的外来入侵种研究[J].湿地科学,2006(3):7~12.
[11]王元军.南四湖湿地外来入侵植物[J].植物学报,2010,45(2):212~219.
[12]丁 晖,徐海根,强 胜,等.中国生物入侵的现状与趋势[J].生态与农村环境学报,2011,27(3):35~41.
[13]李彦连.山东省南四湖湿地外来入侵植物区系分析[J].济宁学院学报,2011(6):56~61.
[14]李淑英,周元清,胡 承,等.水生植物净化中微生物变化及净化效果研究[J].环境科学与技术,2009(11):75~80.
[15]金树权,周金波,朱晓丽,等.10种水生植物的氮磷吸收和水质净化能力比较研究[J].农业环境科学学报,2010,29(8):1571~1575.
[16]刘 育,夏北成.芦苇湿地不同生物量处理生活污水中三氮[J].环境科学与技术,2006,29(4):98~99.
[17]石 雷,王宝贞,曹向东,等.沙田人工湿地植物生长特性及除污能力的研究[J].农业环境科学学报,2005,24(1):98~103.
[18]熊汉锋,彭有轩,孙海元,等.10种湿地水生经济植物综合评价[J].安徽农业科学,2009,37(32):15815~15816,15826.
[19]王震宇,温胜芳,李锋民.南四湖湿地六种水生植物的磷素根际效应[J].中国环境科学,2010(30):64~68.
[20]谷孝鸿,张圣照,白秀玲,等.东太湖水生植物群落结构的演变及其沼泽化[J].生态学报,2005,25(7):1541~1548.
[21]胡圆圆,林 萍,肖德荣,等.丽江拉市海高原湿地水生植被调查与分析[J].山东林业科技,2008(1):1~4,37.
[22]李文朝.东太湖茭黄水发生原因与防治对策探讨[J].湖泊科学,1987,9(1):27~28.
[23]范云爽,戴 丽,蒋云东.人工湿地处理污染河水和湿地植物腐烂分解影响研究[J].环境科学导刊,2010,29(3):42 ~45.
[24]刘树元,阎百兴,王莉霞等.潜流人工湿地中植物对氮磷净化的影响[J].生态学报,2011,31(6):1538~1546.
[25]徐德福,徐建民,王华胜.湿地植物在富营养化水体中的N、P吸收效率研究.nitrogen and phosphorus absorp-tion from eutrophicated water[J].植物营养与肥料学报,2005,11(5):597~601.
[26]吴爱平,吴世凯,倪乐意.长江中游浅水湖泊水生植物氮磷含量与水柱营养的关系[J].水生生物学报,2005,29(4):406~412.
[27]林小涛,梁海含,梁 华,等.澳门路氹湿地芦苇氮磷含量的季节变化[J].生态学杂志,2007,26(1):5~8.
[28]李 萍.水中氨氮、亚硝酸盐氮及硝酸盐氮相互关系探讨[J].上海环境科学,2006,25(6):245 ~246,250.
[29]范云爽,戴 丽,蒋云东.人工湿地处理污染河水和湿地植物腐烂分解影响研究[J].环境科学导刊,2010,29(3):42~45.
[30]雷泽湘,徐德兰,谢贻发,等.太湖水生植物氮磷与湖水和沉积物氮磷含量的关系[J].植物生态学报,2008,32(2):402~407.
[31]蒋跃平,葛 滢,岳春雷,等.人工湿地植物对观赏水中氮磷去除的贡献[J].生态学报,2004,24(8):1718 ~1723.
[32]王庆海,段留生,武菊英,等.北京地区人工湿地植物活力及污染物去除能力[J].应用生态学报,2008,19(5):1131~1137.
[33]吴淑杭,徐亚同,姜震方,等.梦清园人工湿地芦苇的氮磷和生物量动态及其适宜收割期的研究[J].农业环境科学学报,2006,25(6):1594 ~1597.
[34]刘 革.水体富营养化的成因、危害及防治措施[J].中国水产,2009(10):68~69.
