Hg2+对草鱼鱼种肾、鳃Na+/K+-ATPase及其组织结构的影响
2012-08-27温茹淑郑清梅徐鸿飞方展强
温茹淑,郑清梅,徐鸿飞,方展强
(1.嘉应学院 生命科学学院,广东 梅州 514015;2.华南师范大学 生命科学学院,广东 广州 510631)
随着工业的迅速发展,工业废水的大量排放,污染物不断进入到生态系统中,对人类的生产、生活及健康造成很大的影响及危害,并严重的威胁到自然界中各种生物的安全,日本的“水俣病”就是重金属汞污染给人类带来得一个警告。由此,水体重金属污染问题越来越受到人们的关注,工业废水把铅、汞、镉等大量的重金属带入江河湖泊,严重破坏了水域生态环境,直接影响依赖水环境生长的鱼类的正常生长发育和繁殖。草鱼(Ctenopharyngodon idellus)属鲤形目,鲤科,雅罗鱼亚科,草鱼属。是中国淡水养殖的4大家鱼之一,作为重要经济鱼类,对我国的渔业经济具有重大的影响。鱼类早期发育是整个生活史中对各种污染物最为敏感的阶段,用以作为毒性试验具有快速、敏感、经济有效等特点。Na+/K+-ATPase是广泛存在于生物细胞质膜上,是组成Na+/K+泵活性的主要部分,对金属离子的暴露非常敏感[1-4]。近年来不少学者开展了重金属对草鱼影响的相关研究[5-12]。本文研究了汞对草鱼鱼种肾脏和鳃Na+/K+-ATPase活性及其组织结构的影响,旨在探讨重金属Hg2+对生物体的毒性作用及其机理,为水体污染的治理及渔业种质资源和环境保护提供科学依据。
1 材料与方法
1.1 实验动物
试验用草鱼(Ctenopharyngodon idellus)鱼种购自广东梅县丙村镇某鱼苗场,是同批孵化的个体。从鱼池起捕后在室内暂养一周后进行实验,驯养期间每天定时投喂2次。然后选择游动活泼,体表无损伤的个体进行试验,平均体长为(7.3 ±1.2)cm,体质量为(11.0 ±1.6)g。
1.2 试验条件
暴露试验是在容积为58 cm×38 cm×52 cm水族箱内进行,加入水体积为50 L,试验用水为连续曝气24 h的自来水,水温(25±2)℃,pH为6.8,硬度为2.4度(德国度),中间不更换试验液,每组均用同样管径的气头连续充气。每天投喂2次,试验前2 d停止投喂,试验期间不喂食。
1.3 暴露实验
Hg2+对草鱼鱼种暴露试验采用静态染毒法[13]。实验设3个质量浓度组和一个对照组,根据温茹淑等[5]所做的汞、铅对草鱼鱼种的急性毒性研究,Hg2+对草鱼鱼种的96 h LC50为0.362 mg/L,3个质量浓度设定分别取96 h LC50的1/2,1/4 和 1/8,即分别为 0.181,0.091,0.045 mg/L。试验液的配制先用分析纯氯化汞[HgCl2·2H20]配制成100 mg/L的母液储藏备用,然后稀释成所需要的各级不同质量浓度。每个质量浓度都设平行组,每组放入实验鱼35尾。试验开始后连续观察8 h,之后分别记录6,12,24,48,72 h草鱼的活动状况及死亡个体数目。死亡的标准是鱼腹部向上,鳃盖停止运动,用玻璃棒轻轻刺激尾柄部位,5 min内无反应即可确定为个体死亡[5]。鱼一旦死亡马上取出,记录死亡时间,鱼的体表特征,并通过解剖取下死鱼的鳃、肾脏、肝脏制成组织切片用以观察组织变化。
在处理第6,12,24,48,72 h,分别从各水族箱中取出8尾草鱼鱼种,用镊子尖端刺入草鱼的大脑并轻轻地搅动将鱼处死,剖开腹腔,去掉鳃盖骨,取出其肾脏、鳃组织,放入预冷的生理盐水中洗干净血迹。将5尾草鱼的样品装入做好标记的1.5 mL离心管,放入-80℃超低温冰箱,用于Na+/K+-ATPase活性的测定,将3尾草鱼的样品迅速放入做好标记的波恩氏固定液中,并贴上标签,用于组织切片的制作。
1.4 Na+/K+-ATPase活性的测定
分别取试验鱼的鳃和肾组织,加人适量预冷匀浆介质,用玻璃匀浆器在冰浴条件下进行匀浆,匀浆液在0~4℃,3 000 r/min,离心15 min,取上清液测定Na+/K+-ATPase活性,匀浆介质含有:蔗糖0.25 mol/L、EDTA1.25 mmol/L、Tris 10 mmol/L,pH=7.0。Na+/K+- ATPase 活性测定参照 Paxton 等[14]方法,样品中蛋白质含量的测定采用考马斯亮蓝法[15]。Na+/K+-ATPase酶活性单位定义为:每毫克蛋白质每小时分解产生每微摩尔的无机磷的量为l个酶活性单位。
抑制率=(对照组Na+/K+-ATPase活性 -浓度组Na+/K+-ATPase活性)/对照组 Na+/K+-ATPase活性×100% (1)
1.5 数据处理与分析
图表的制作采用Excel 2007软件,实验数据用2次重复的平均数及标准差表示,不同处理组数据间的差异采用SPSS软件,采用Student’s-t检验法进行分析,P<0.05认为存在显著性差异,P<0.01认为存在极显著性差异。
1.6 组织切片制作
组织切片的制作是根据芮菊生[16]的组织切片技术的方法,进行常规的石蜡切片,把波恩氏液固定24 h的组织块用体积分数为70%酒精冲洗,各级乙醇脱水,石蜡包埋,切片厚度6~8 μm,经苏木精-伊红(H.E)染色,中性胶封藏后置光学显微镜(OLYMPUS BX45-32P02)观察并用数码相机(尼康FG-20)进行拍照。
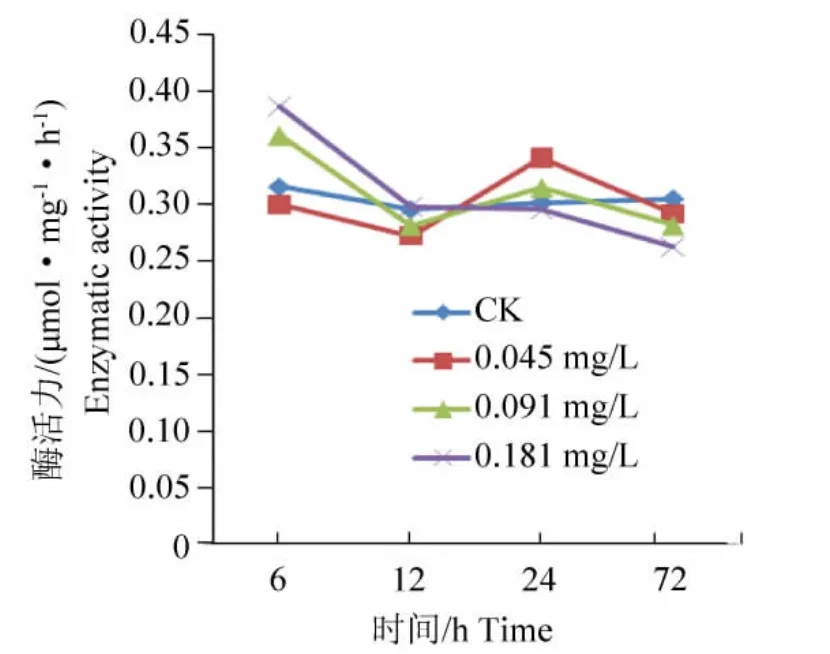
图1 Hg2+对草鱼鱼种鳃组织Na+/K+-ATPase活性的影响Fig.1 The effect of Hg2+on the Na+/K+-ATPase activity of gills in grass carp fingerling

图2 Hg2+对草鱼鱼种肾组织Na+/K+-ATPase活力的影响Fig.2 The effect of Hg2+on the Na+/K+-ATPase activity of kidney in grass carp fingerling
2 结果分析
2.1 草鱼状态及解剖观察
试验鱼放入含汞的试验液后表现兴奋、不安定,在试验液中上下窜动,快速游动。随着时间推移,试验鱼渐趋于平静。整个暴露实验过程中未见死鱼。在解剖过程中发现,高浓度组的草鱼鱼种的体表粘液分泌增多,肝脾肿胀,肝脏的颜色变成暗红色;肾脏充血、色泽变暗;鳃丝颜色反而变成浅红色,且显得肿胀。对照组的鱼种未出现上述解剖症状,同时整个实验过程中无死亡个体。
2.2 Hg2+对草鱼鱼种肾、鳃组织Na+/K+-ATPase活性的影响
Hg2+对草鱼鱼种鳃组织Na+/K+-ATPase活性的影响试验结果如图1所示。从图1可以看出,经不同质量浓度Hg2+处理后草鱼鱼种鳃组织的Na+/K+-ATPase活性变化不明显。其中0.181 mg/L Hg2+处理12 h后,其活性基本没变化。对于 0.045 mg/L,0.091 mg/L Hg2+处理在24 h时,酶活力都呈上升趋势,而到72 h又呈下降趋势。
Hg2+对草鱼鱼种肾组织Na+/K+-ATPase活性的影响试验结果如图2所示。在0.045 mg/L Hg2+溶液中曝露12 h后,Na+/K+-ATPase的活性出现的显著的下降趋势。对于 0.091 mg/L和 0.181 mg/L Hg2+试验组Na+/K+-ATPase活性随时间的延长出现平缓下降的趋势。3个试验组的Na+/K+-ATPase在72 h时出现了极显著的下降。
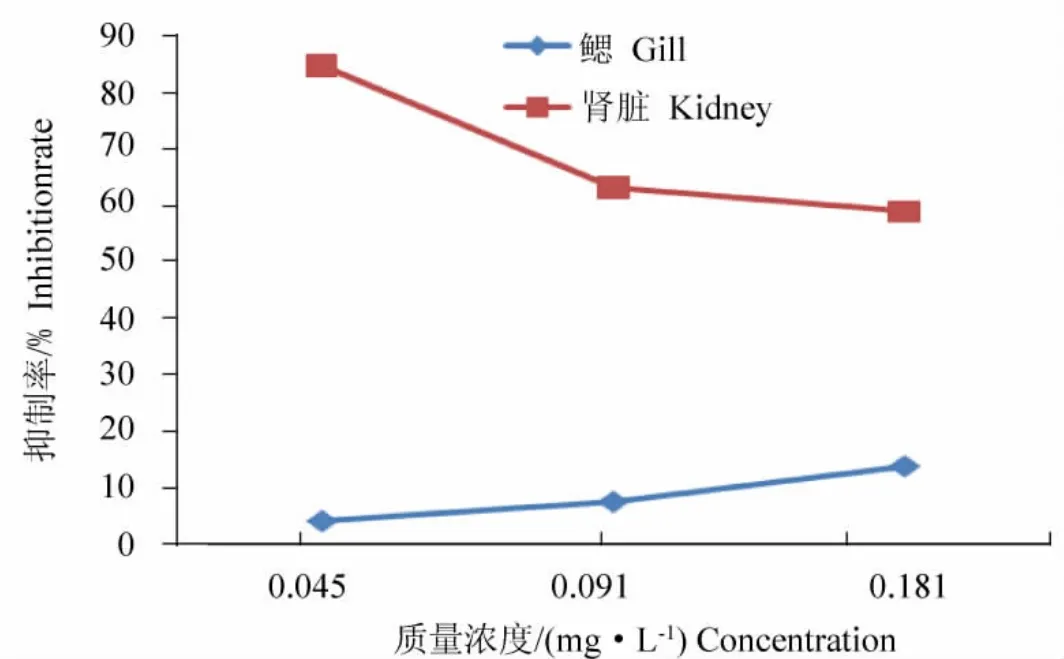
图3 Hg2+处理72 h,对草鱼鱼种鳃、肾Na+/K+-ATPase活性的抑制作用Fig.3 The decrease of mecury exposed 72 hours in Na+/K+-ATPase activity of Grass Carp gill and kidney
2.3 Hg2+处理 72 h,对草鱼鱼种肾、鳃Na+/K+-ATPase的影响比较
Hg2+暴露72 h,对草鱼鱼种鳃、肾Na+/K+-ATPase的影响比较结果见图3。从图3可看出,肾在0.045 mg/L、0.091 mg/L 和0.181 mg/L Hg2+对 Na+/K+-ATPase的抑制率均比同质量浓度下的鳃的抑制率要大。对于0.045 mg/L Hg2+暴露6 h时,肾组织中Hg2+对Na+/K+-ATPase的抑制率达到了84.64%。可见,抑制作用是极为明显的。
2.4 Hg2+对草鱼鱼种肾组织结构的影响
鱼类的肾脏在系统发育上属中肾。草鱼鱼种的肾脏深红色,位于前后鳔室中间,贴于体腔的背壁,以输尿管通入膀胱,横切面上可见肾脏外被一层结缔组织膜,由许多肾小体构成,肾小体包括肾小管(图版Ⅰ-1,2)和肾小球(图版Ⅰ-3)两部分,肾小球是背大动脉分支在肾小管的肾口旁形成一个毛细血管团(图版Ⅰ-3),肾小管的前端凹入,由两层扁平的上皮细胞构成杯状的肾小球囊,将肾小球包入其中。肾小球囊壁分内外两层,两层之间为一狭小的腔隙,称肾小囊腔,与肾小管的管腔相通。肾脏也包含拟淋巴细胞,其细胞分布于各肾小管即由连接小管,集合小管与各血管等构造之间。细胞甚小,其核较显著,皆有淋巴细胞之特征(图版Ⅰ-1,2,3)。
从组织切片观察结果表明,对照组的肾组织无损伤,肾小体、肾小管结构正常(图版Ⅰ-1,2,3))。经过 Hg2+暴露24 h,0.045 mg/L 实验组的草鱼,没有出现病变的情况(图版Ⅰ-4),0.091 mg/L 和0.181 mg/L的实验组草鱼鱼种的肾小管出现了萎缩的现象,肾小管周围开始出现空腔(图版Ⅰ-5),肾小体组织结构未见异常(图版Ⅰ-6)。经过汞暴露72 h,0.045 mg/L的实验组中,草鱼的肾脏组织结构未发现异常;0.091 mg/L及0.181 mg/L的实验组中,肾小管均出现了萎缩,甚至坏死(图版Ⅰ-7,8),肾小体组织结构未见异常(图版Ⅰ-9)。
2.5 Hg2+对草鱼鱼种鳃组织结构的影响
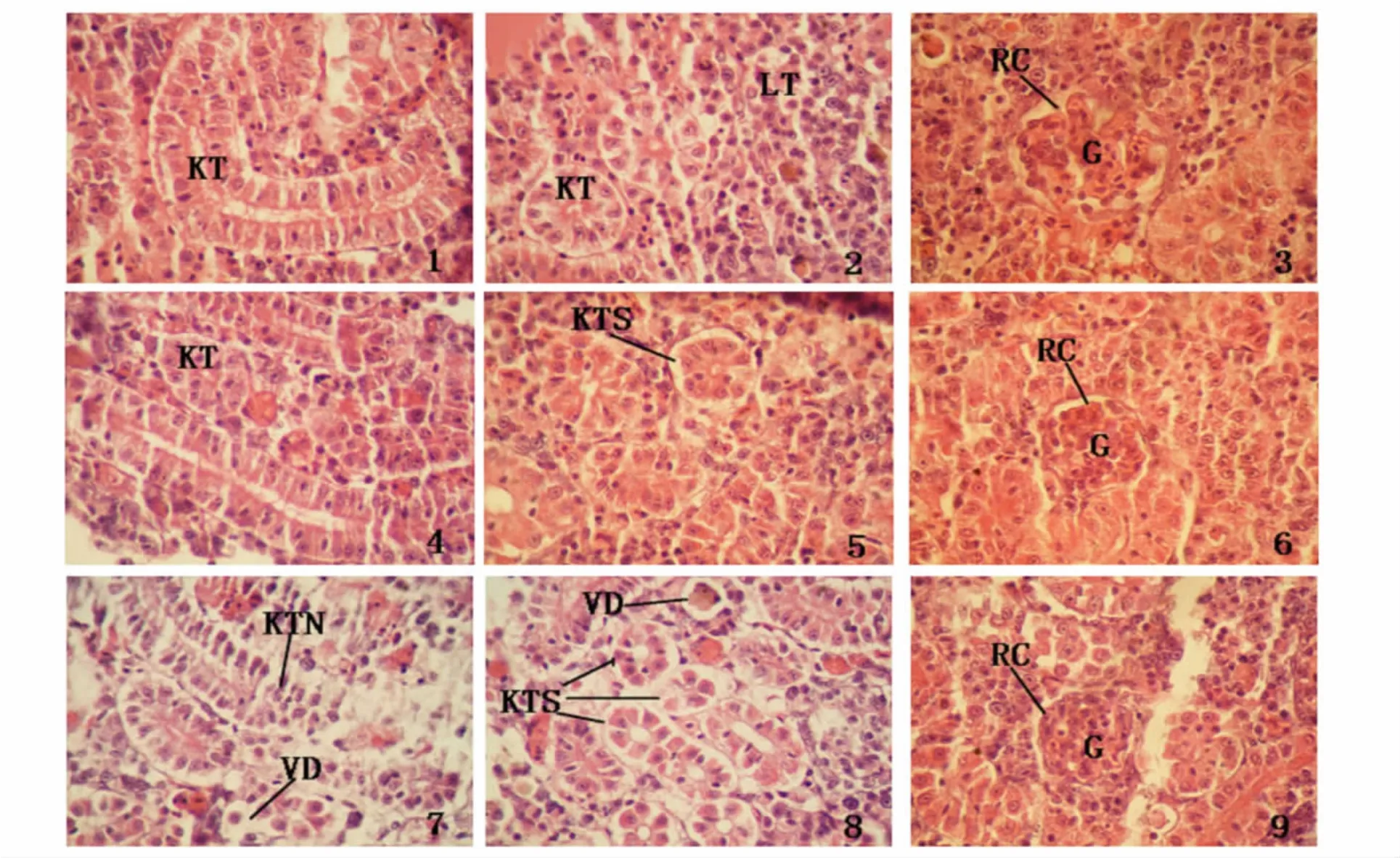
图版Ⅰ Hg2+对草鱼种肾组织结构的影响PlateⅠ Effects of Hg2+on the histological structure of kidney in grass carp
鳃是鱼类的呼吸器官。鳃组织由许多从鳃弓以直角向外伸出的鳃丝组成,每个鳃丝的背面和腹面都有并排的鳃小片,是气体交换的场所。鳃小片由上皮组织,结缔组织,毛细血管及神经组织等所组成。上皮组织位于鳃小片的基部与鳃小片的各部,是双层细胞,两层之间含有细胞间淋巴的空隙。鳃丝上皮具有泌氯细胞,鳃小片上皮也有,主要位于鳃丝表皮层基膜的基部,泌氯细胞起离子调节作用。鳃小片纵切其中轴有一空隙,叫毛细血管空隙,其中是毛细血管,管里充满红血球。小片自由摆动,细胞单层极薄,其中的红血球通过它与水流进行O2和CO2的交流,进行上皮呼吸(图版Ⅱ-1,2)。
从组织切片观察结果表明,对照组鳃小片清晰整齐,上皮细胞之间有黏液细胞、腺细胞和泌氯细胞等,无扭曲增生现象,鳃组织无损伤(图版Ⅱ-1,2)。经过Hg2+暴露24 h后,各质量浓度组的草鱼鱼种鳃小片均开始出现弯曲(图版Ⅱ-3,4,5)、上皮细胞增生肿大(图版Ⅱ-4),相邻的鳃小片出现融合等病变(图版Ⅱ-4,5)。Hg2+暴露72 h后,鳃小片的弯曲十分明显(图版Ⅱ-6);有的鳃小片顶端不但肿大,甚至出现充血的现象,呈球状或棒状(图版Ⅱ-6,8);上皮细胞增生,腺细胞分泌的粘液增多,相邻的鳃丝出现融合现象,形成一片上皮细胞板(图版Ⅱ-8);泌氯细胞肿胀,也出现了许多空泡;有的鳃小片甚至还出现了坏死和脱落(图版Ⅱ-7),严重影响了鳃的功能。这些现象在不同质量浓度组的试验鱼中表现出的症状随质量浓度的增加而加重。

图版Ⅱ Hg2+对草鱼鳃组织结构的影响PlateⅡ Effects of Hg2+on the histological structure of gill in grass carp
3 讨论
3.1 Hg2+对草鱼Na+/K+-ATPase活性影响
Na+/K+-ATPase是存在于细胞质膜上从水解ATP获得能量、逆电化学梯度转运Na+,同时反方向转运K+的一种内膜蛋白,也称钠泵,其广泛分布于各类细胞质膜上。Na+/K+-ATPase酶是多种毒物作用的靶位点,对毒物十分敏感。本试验研究的结果表明,Hg2+对草鱼鱼种的鳃、肾Na+/K+-ATPase的活性有抑制作用,特别是对肾Na+/K+-ATPase有明显的抑制作用。相关研究[4]表明重金属可以抑制Na+/K+-ATPase的活性,原因在于重金属离子通过与膜上蛋白质的结合位点即含巯基结构或氧基结构的基团结合后,引起蛋白质空间构象发生变化,这种变化阻止了底物与蛋白质的结合,从而抑制了正常酶的活性。而Na+/K+-ATPase的抑制对鱼生理功能造成一定程度的损害,原因在于这种抑制引起细胞膜结构的破坏,损害的部位或是质膜或为线粒体膜,结果导致生物自身的代谢活动受到抑制。徐立红等[17]通过研究表明,重金属影响Na+/K+-ATPase的活性途径可能与活性中心的羧基形成不溶性盐,影响活性中心的亲核催化作用;也可能取代Na+,使酶的构象受到影响,从而影响了磷酸化步骤后面的反应。而Thaker[2]则认为重金属离子对细胞的作用首先是攻击细胞膜上的Na+,K+离子泵,导致了不可控制的Na+离子沿着度梯度进入细胞中,同时水分子与其它成分一道流入细胞,最终导致膜的破裂。
本试验结果中,Hg2+对肾Na+/K+-ATPase的抑制率明显大于鳃。暴露72 h,在0.045 mg/L Hg2+处理组,鳃组织Na+/K+-ATPase的抑制率只有4.29%,肾组织Na+/K+-ATPase的抑制率为84%;在0.181 mg/L Hg2+处理组,鳃组织Na+/K+-ATPase的抑制率只有14%;肾组织Na+/K+-ATPase的抑制率为64%;表明肾组织Na+/K+-ATPase对毒物的敏感性较鳃组织的要大。这一现象与徐立红等[17]的研究类似,Bouquegneau[18]用鳗的研究也发现 Hg2+对 Na+/K+-ATPase有较强的抑制,Jampol[19]的研究表明,淡水鱼肾中的Na+/K+-ATPase所占的比例较鳃等组织大,因此,肾ATPase要比鳃ATPase敏感些。方展强等[4]认为Na+/K+-ATPase作为生物膜物质的装运与能量代谢的一种关键酶,对Hg中毒十分敏感,其活性变化可以考虑作为对水环境Hg污染效应的较理想指标。
3.2 Hg2+对草鱼的肾脏、鳃组织结构的毒性
肾脏是鱼类排泄Hg的重要器官,是鱼体内蓄积Hg2+最多的地方,无机Hg2+进入血液后迅速分布全身,随之转运、聚积在肝脏和肾脏,70%~80%的无机汞逐步以汞结合硫蛋白的形式集中在肾脏皮质的近曲小管细胞内,并经肾由尿排出体外[20]。本实验中,暴露24 h,0.045 mg/L、0.091 mg/L及暴露72 h,浓度为0.045 mg/L的草鱼肾脏均未出现病变。其原因在于重金属离子能在肾细胞内与含巯基的硫蛋白结合,形成对金属有储存、传递和解毒作用的金属硫蛋白(MT),MT主要存在于肾小管细胞内,当MT有足够储量时,可通过与重金属离子的结合而保护肾小管细胞不受损害,从而使肾对重金属污染表现出一定的耐受性[21]。但随着Hg2+质量浓度的增加还有暴露时间的延长,将会超出金属硫蛋白的解毒能力,进而直接对肾组织造成伤害。而重金属对肾的毒性,主要是损害近曲小管的上皮细胞,使其细胞溶酶体增多,线粒体肿胀变形[20],导致肾发生病变。所以在本实验中,经过Hg2+暴露24 h,0.181 mg/L及暴露72 h,0.091 mg/L、0.181 mg/L的草鱼鱼种的肾脏的肾小体无明显的变化,但是肾小管出现了萎缩,细胞坏死等现象。且病变的程度与Hg2+质量浓度有着密切的关系,Hg2+质量浓度越高,病变的情况越明显。因此,鱼类肾脏的组织结构的变化也是监测Hg2+质量浓度污染的一个有效标志物。
鳃是鱼类与外部环境接触的主要器官,是外源性化学物质的第一靶器官。鱼鳃的特殊结构决定它有利于水中离子的穿过,成为鱼体直接从水中吸收重金属的主要部位。本实验中草鱼鱼种的鳃组织结构也出现了鳃小片肿大、充血、坏死;鳃丝融合,上皮细胞增生,腺细胞分泌的粘液增多,泌氯细胞肿胀,等一系列的病态症状,破坏了鳃的功能,造成鱼体呼吸困难,且症状随Hg2+质量浓度的升高和暴露时间的延长而加重。这与关海红等[22]的实验结果是一致的。其认为生物体内对有害金属的解毒机制是因体内的金属蛋白和类金属巯蛋白分子的巯基(-SH)能结合大量的金属,这两种蛋白质对重金属在生物体内的贮存、传递和解毒可能起着重要作用。但金属巯蛋白的解毒作用是有限的,当鱼体内重金属含量过高,金属巯蛋白不能结合的金属便转移到组织中的高分子量蛋白质中,使组织受到损伤,呈现病理状态,正常的生理活动受到影响。其中上皮细胞增生,泌氯细胞肿胀,被认为是对鳃损坏引起的离子失衡而做出的补偿性应答[23];上皮的增生和泌氯细胞的肿张引起鳃小片融合,当鳃丝之间的空隙被鳃丝细胞填满,引起跨鳃表面的氧气交换减少,呼吸困难甚至死亡[24]。
[1]Pinhey A E,Wright D A,Jepson M A,et al.Effects of tributyltin compounds on ionic regulation and gill ATPase activity in estuarine fish[J].Comparative Biochemistry and Physiology ,1989,92(1):125 - 129.
[2]Thaker J,Chhaya J,Nuzhat S,et al.Effects of chromium(VI)on some ion - dependent ATPase in gills,kidney and intestine of a coastal teleost Periophthalmus dipes[J].Toxicology,1996,112(3):237 -244.
[3]方展强,张凤君,郑文彪,等.多氯联苯对剑尾鱼Na+/K+-ATPase活性的影响[J].水产学报,2004,28(1):89-92.
[4]方展强,王春凤,卫焕荣.汞和硒对剑尾鱼Na+/K+-ATPase活性的影响[J].应用与环境生物学报,2006,12(2):220-223.
[5]温茹淑,郑清梅,方展强,等.汞、铅对草鱼的急性毒性及安全浓度评价[J].安徽农业科学,2007,35(16):4863-4864.
[6]刘占才,牛俊英,孔祥会,等.汞离子对草鱼血清和肾脏溶菌酶活性的影响[J].安徽农业科学,2007,3(9):2615-2616.
[7]刘占才,牛景彦.汞暴露对草鱼脾和肾脏器系数的影响[J].湖北农业科学,2011,50(4):810-811,814.
[8]侯丽萍,马广智.镉与锌对草鱼种的急性毒性和联合毒性研究[J].淡水渔业,2002,32(3):44-46.
[9]张重谋,喻运珍,王守荣.草鱼种对络合铜的敏感性试验[J].水利渔业,2000,20(2):33-34.
[10]冯健,刘永坚,田丽霞,等.草鱼实验性镉中毒的肝、肾病理学研究[J].中山大学学报:自然科学版,2003,42(2):226-230.
[11]冯建,刘永坚,田丽霞,等.草鱼实验性镉中毒对肝胰脏、肾脏和骨骼的影响[J].水产学报,2004,28(2):195-200.
[12]蔺玉华,刘子靖.鱼体汞的甲基化及其甲基汞的吸收与代谢[J].水产学报,1994,18(4):326-329..
[13]邱郁春.水污染鱼类毒性实验方法[M].北京:中国环境科学出版社,1992:111,113-114.
[14]Paxton R,Limiager B,Umminger.Altered activities of branchial and renal Na/K- and Mg-ATPase in cold-acclimated goldfish(Carassius auratus)[J].Comparative Biochemistry and Physiology ,1983,74(3):503 -506.
[15]刘嘉瀛,黄世岭.考马斯亮兰G-250蛋白质定量测定法及其应用[J].国外医学临床生物化学与检验学分册,1990,11(2):12-16.
[16]芮菊生.组织切片技术[M].北京:高等教育出版社,1980.
[17]徐立红,张甬元,王德铭.用环境毒物对草鱼组织ATPase的影响作为生态毒理学指标的初步研究[J].水生生物学报,1987,11(3):193 -202.
[18]Bouquegneau J M.ATPase activity in mercury intoxicated eels[J].Cellular and Molecular Life Sciences,1977,33(7):941 -943.
[19]Jampol L M,Epstein F H.Sodium -potassium -activated adenosine triphosphatase and osmotic regulation by fishes[J].A-merican Journal Physiology,1970,218(2):607 -611.
[20]孔志明.环境毒理学[M].南京:南京大学出版社,2008:138-142.
[21]纪云晶.实用毒理学手册[M].北京:中国环境科学出版社,1991:20.
[22]关海红,蔺玉华,刘伟.汞在松浦鲤体内的转化及对鳃组织的损伤[J].大连水产学院学报,2004,19(1):58-61.
[23]Jagoe C H,Faivre A,Newman M C.Morphological and morphometric changes in the gills of mosquitofish(Gambusia holbrooki)after exposure to mercury(II)[J].Aquatic Toxicology,1996,34(2):163 -183.
[24]Michael C N,Michael A U.生态毒理学原理[M].北京:化学工业出版社,2007:107-108.
