玫瑰糠疹患者不同时期血清白细胞介素4、白细胞介素12和干扰素γ水平检测
2012-08-27陈慧君陈治国缪希红
陈慧君,陈治国,缪希红
(河北省承德市中心医院,承德 067000)
玫瑰糠疹(pityriasis rosea,PR)是一种临床上较为常见的皮肤病,每于春秋季节多发,各国皮肤病学研究中心报告PR的患病率为0.4%~4.8%[1-2]。因其具有玫瑰红色圆形或椭圆形斑疹,搔抓后出现糠粃样鳞屑而得名[3]。由于PR病程较长,一般4~8周,少数可以迁延半年以上,且病因不明确,给医生及患者带来极大困扰。本实验观察PR患者在急性期和恢复期血清中白细胞介素-4(interleukin-4,IL-4)、白细胞介素-12(interleukin-12,IL-12)和 γ-干扰素(interferon-γ,IFN-γ)表达水平的变化情况,以便更好的认识本病的发生发展规律与某些细胞因子的相关性,现将结果报道如下。
1 对象与方法
1.1 研究对象 30例PR患者均为我院皮肤科门诊就诊的患者。30例健康志愿者做为正常对照。根据PR的诊断标准[4],除外二期梅毒、银屑病、药疹、体癣等疾病。选择患病时间≤1周(时间以患者主诉时间为准),年龄及性别不限,未经过任何药物治疗的患者为受试对象。设定30例PR患者在病程≤1周时为急性期患者,并要求其定期复诊,设定皮损消退≥70%为恢复期患者。30例PR患者中男13例(43.3%),女17例(56.7%),年龄18~54岁,平均23岁。30例健康志愿者中男14例(46.7%),女16例(53.3%)。年龄18~53岁,平均24岁。各组性别构成、年龄差异均无统计学意义(P>0.05)
1.2 标本采集 分别抽取急性期和恢复期PR患者静脉血 3 mL放入抗凝管中,放置30 min后在离心机中离心3 000转/min,10 min,采集到的血清标本放入-20℃冰箱中保存备用。同法将采集到的健康志愿者的血清标本放入-20℃冰箱中保存备用。
1.3 实验方法 IL-4、IL-12和IFN-γ的检测应用双抗体夹心酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)方法,试剂盒购自欣博盛生物科技有限公司。结果测定使用芬兰雷勃公司MK3酶标仪,测定450 nm处吸光度(AD)值,以标准AD值绘制标准曲线。所有数据测定均由同一操作者使用相同设备完成,所有操作严格按照试剂盒的使用说明书进行。
1.4 统计学分析 采用SPSS11.5统计学软件,计量资料以(±s)表示。各组间进行两样本均数比较的t检验。
2 结果
PR患者恢复期和急性期相比IL-4水平升高(P<0.05),恢复期与正常对照组相比IL-4表达水平接近(P>0.05);PR患者恢复期和急性期相比IL-12水平下降(P<0.05),与正常对照组相比水平接近(P>0.05);PR患者恢复期和急性期相比IFN-γ水平下降(P<0.05),与正常对照组相比水平接近(P>0.05),见表 1、2。
表1 PR患者急性期与恢复期血清IL-4、IL-12、IFN-γ 水平比较 (±s,ng/L)
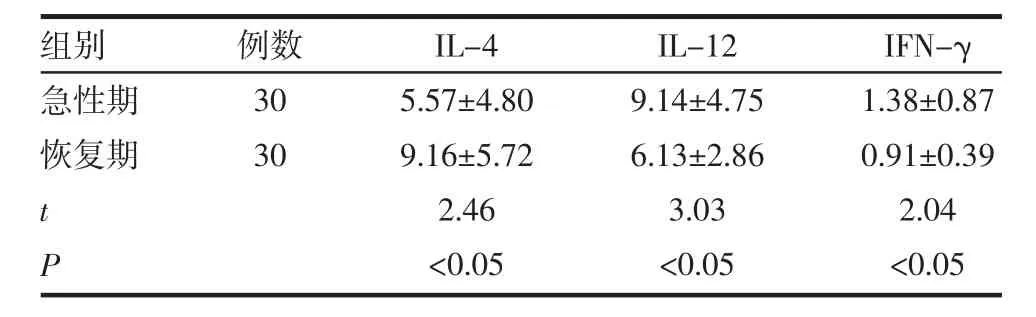
表1 PR患者急性期与恢复期血清IL-4、IL-12、IFN-γ 水平比较 (±s,ng/L)
组别急性期恢复期例数30 30 t P IFN-γ 1.38±0.87 0.91±0.39 2.04<0.05 IL-4 5.57±4.80 9.16±5.72 2.46<0.05 IL-12 9.14±4.75 6.13±2.86 3.03<0.05
表2 PR患者恢复期与正常者血清IL-4、IL-12、IFN-γ水平比较 (±s,ng/L)
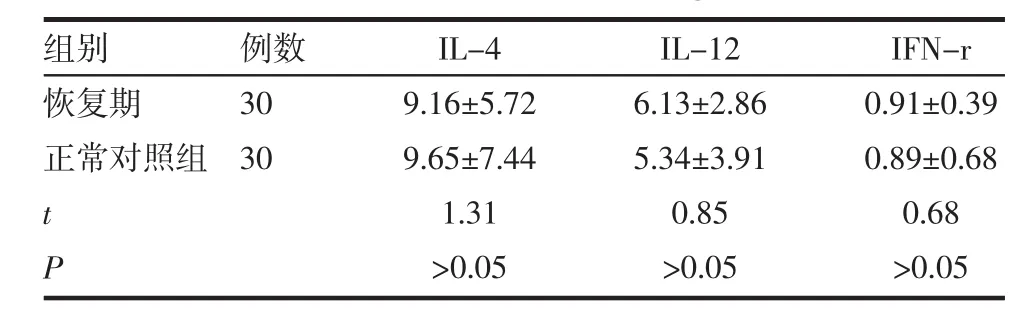
表2 PR患者恢复期与正常者血清IL-4、IL-12、IFN-γ水平比较 (±s,ng/L)
组别恢复期正常对照组例数30 30 t P IL-4 9.16±5.72 9.65±7.44 1.31>0.05 IL-12 6.13±2.86 5.34±3.91 0.85>0.05 IFN-r 0.91±0.39 0.89±0.68 0.68>0.05
3 讨论
PR虽为自限性疾病,但是给患者及其家人的身心均造成明显的不良影响。从1798年苏格兰皮肤病学家Willan首次报道环状玫瑰疹,到1860年法国皮肤病学家Gilbert根据本病特点而将其命名为玫瑰糠疹[3]至今,150年间人们对其病因和发病机制的探索从未中断过。近年来的一些研究显示PR的发病主要涉及细胞免疫,与体液免疫关系不大。如皮损浸润的细胞主要为辅助/诱导T淋巴细胞,表皮、真皮乳头内朗格汉斯细胞(Langerhans cell,LC)明显增多,角质形成细胞内出现人白细胞抗原-DR(human leucocyte antigen-DR,HLA-DR)的表达[5]。也有研究认为PR的发病与感染后机体的细胞免疫和(或)体液免疫的失衡有关。在机体免疫状态改变时如妊娠或骨髓移植后PR多发也支持了这一假说[6]。
CD4+T细胞(Th)根据其合成和分泌细胞因子的不同可分为Th1和Th2细胞亚群。Th1细胞分泌IL-2、IL-12、IFN-γ等Th1类细胞因子,能增强杀伤细胞的细胞毒性作用,与细胞免疫有关;Th2 细胞则产生 IL-4、IL-5、IL-6、IL-9、IL-10、IL-13等Th2类细胞因子,促进抗体的产生,与体液免疫有关。IL-12是参与免疫应答的重要细胞因子,其独特且重要的生物学活性是调节Th1和Th2细胞间的平衡,诱导Th1细胞分泌IL-2和IFN-γ,使Th0向Th1方向发展。IFN-γ作用于抗原递呈细胞,具有促进炎症细胞浸润和表皮细胞增殖的作用,同时还可促使角质形成细胞表达细胞黏附分子,协同促进炎症细胞浸润和表皮细胞增生。IFN-γ和IL-4是Th1和Th2细胞的代表性细胞因子,免疫学上常常通过检测IFN-γ和IL-4来了解Th1和Th2细胞的功能状态。
本研究通过检测PR患者急性期和恢复期血清中IL-4、IL-12、IFN-γ的水平并进行比较发现PR患者在急性期体内存在细胞免疫与体液免疫的失衡,在恢复期机体的免疫失衡状态得到恢复,同时说明IL-4、IL-12、IFN-γ参与了PR的发病,并在疾病发生发展过程中扮演着重要角色,起到了重要的作用。
Aiba等[7-9]对PR患者的皮损标本进行了组织病理和免疫组化研究,发现PR患者皮损真皮中浸润的淋巴细胞主要为记忆性T细胞,证实细胞免疫在PR发病中可能起主要作用,而体液免疫不起主要作用。Sugiura等[10]观察到在恢复期PR患者的皮损中,CD4+/CD8+浸润细胞的比例显著降低,并提出与恢复期PR患者的免疫抑制功能提高有关。孙晓杰等[11]运用免疫组化方法检测PR患者急性期和恢复期外周血T细胞亚群的变化,发现PR患者外周血CD8+细胞比例明显高于恢复期,CD4+/CD8+比值明显降低,CD4+细胞比例急性期与恢复期无明显变化。认为PR患者急性期机体存在免疫失衡,免疫细胞间的比例发生了变化。且Aiba等[9]运用流式细胞术(flow cytometry method,FCM)分析PR患者皮损中淋巴细胞时发现32%~88%是Leu-La+(CD5+)细胞,70%~90%是Leu-2a+(CD8+)细胞,10%~14%是Leu-3a+(CD4+),70%~90%是HLA-DR+细胞,也得到了与前面一致的结论。
据以上研究结论可推测PR患者在急性期机体出现免疫失衡,CD4+T淋巴细胞在朗格汉斯细胞等抗原递呈细胞的作用下而活化,活化的CD4+T细胞可产生多种细胞因子,IL-12表达于活化的T淋巴细胞表面,促进Th0细胞分化为Th1细胞,并促进IFN-γ、TNF-α和IL-2的合成,而抑制Th2细胞合成IL-4、IL-10等。IL-12分泌增加并促使IFN-γ合成增加,IL-4分泌受到抑制。从而导致T淋巴细胞功能异常。IFN-γ是强有力的巨噬细胞活化因子,活化的巨噬细胞具有杀伤微生物和清除抗原的功能,促进细胞毒性淋巴细胞(cytotoxic lymphocyte,CTL)成熟和活化,而IFN-γ的水平也在免疫反应中势力逐渐削弱,随着疾病的发展PR逐渐进入恢复期,IL-12和IFN-γ水平下降,对Th2细胞的抑制减弱,IL-4分泌逐渐增多,患者免疫平衡状态逐渐得到恢复,炎症反应减轻,皮损消退,疾病也渐渐好转。
[1]Bjornberg AA,Tegner E.Pityriasis rosea.In:Freedberg IM,Eisen AZ,Wolff K,et al editors.Fitzpatrick’s dermatology in general medicine[M].New York:McGraw Hill,2003:445-450.
[2]Chuh AA,Lee A,Molinari N.Case clustering in pityriasis rosea:a multicenter epidemiologic study in primary care settings in HongKong[J].Arch Dermatol,2003,139:489-493.
[3]Percival GH.Pityriasis rosea[J].Br J Dermatol,1932,44:241-253.
[4]赵辨.临床皮肤病学[M]第3版.南京:江苏科学技术出版社,2001:775.
[5]张学军.皮肤性病学[M].第5版.北京:人民卫生出版社,2001:124.
[6]Spelman LJ,Robertson IM,Strutton GM,et al.Pityriasis rosea-like eruption after bone marrow transplantation[J].J Am Acad Dermatol,1994,31:348-351.
[7]Aiba S,Tagami H.HLA-DR antigen expression on the keratinocyte surface in dermatoses characterized by lymphocytic exocytosis(e.g.pityriasis rosea)[J].Br J Dermatol,1984,111:285-294.
[8]廖家,吴昌辉.玫瑰糠疹免疫病因学研究新进展[J].岭南皮肤性病科杂志,2008,15(1):52-54.
[9]Aiba S,Tagami H.In vitro propagation of tissue-infiltrating lymphoid cells from lesional skin by culture in IL-2 containing medium[J].Acta Derm Venereol,1986,66:391-397.
[10]Sugiura H,Miyauchi H,Vehara M.Evolutionary changes of immunohistoiogical characteristics of secondary lesions in pityriasis rosea[J].Arch Dermatol Res,1988,280:405-410.
[11]孙晓杰,郭英军,刘文力,等.玫瑰糠疹患者T细胞亚群检测及意义探讨[J].中国中西医结合皮肤性病学杂志,2003,2(2):87-88.
