KRAS基因突变高分辨率熔解曲线检测技术参数的优化
2012-08-20刘丽琴张海燕
刘丽琴,张海燕,王 捷*
(1.南方医科大学 研究生学院,广东 广州 510515;2.广州军区广州总医院 医学实验科,广东 广州 510010)
KRAS基因突变高分辨率熔解曲线检测技术参数的优化
刘丽琴1,2,张海燕2,王 捷2*
(1.南方医科大学 研究生学院,广东 广州 510515;2.广州军区广州总医院 医学实验科,广东 广州 510010)
目的 建立KRAS基因突变高分辨率熔解曲线分析法(high resolution melting,HRM)检测方法,确立最佳反应体系和反应条件,为将此技术用于临床基因突变的快速检测奠定基础。方法根据引物Tm值设立退火温度梯度,确定适宜的退火温度。利用正交实验,对影响实时荧光定量PCR(qPCR)-HRM反应体系的模板DNA、Mg2+、引物等3种主要因素进行优化。通过对SW480和MDA-MB-231细胞基因组DNA进行HRM分析检测突变,并直接测序验证,观察反应体系和反应条件的可行性。结果引物最适退火温度为60.8℃。KRAS基因突变qPCR-HRM最佳反应体系为:20μl qPCR-HRM 反应体系中,引物浓度为0.5μmol/L,Mg2+为2.5mmol/L,模板DNA为40ng。优化的qPCR-HRM反应体系和反应条件能检测基因突变,和直接测序结果一致。结论采用正交实验优化的qPCRHRM反应体系,操作简便,电泳条带清晰,熔解曲线峰型单一,特异性好,结果准确可靠,可为进一步建立HRM技术检测基因突变的临床应用提供借鉴。
突变;高分辨率熔解曲线;正交实验;优化
(ChinJLabDiagn,2012,16:1167)
高分辨率熔解曲线分析法(high resolution melting,HRM)是在实时荧光定量PCR基础上通过饱和染料监控核酸的熔解曲线变化进行分析的一种新兴分子诊断技术。HRM检测无需使用序列特异性探针,不受突变碱基位点和种类的局限,具有高灵敏度、高特异性、操作简便、低成本、高通量、闭管操作等优点[1,2],可检测石蜡包埋组织块、血液、粪便等多种来源标本。HRM技术不损伤DNA,分析之后可以直接纯化测序,可应用于基因分型、突变扫描等多方面[3,4]。
近些年来,结直肠癌治疗领域中最大亮点是确定KRAS基因状态与抗EGFR单体疗效的相关性,KRAS基因野生型者从西妥昔单抗联合化疗中获益更大[5]。KRAS基因突变检测可以指导临床选择合理的治疗方案,预测抗EGFR单抗疗效,是实现结直肠癌个体化治疗的必检指标。本研究旨在对qPCR-HRM的反应体系和反应条件进行优化,选择最佳退火温度、引物浓度和模板量,建立一种快速准确的突变检测方法,为HRM技术检测KRAS基因突变的临床应用奠定基础。
1 材料与方法
1.1 材料选取HT29人结肠癌细胞系、SW480人结肠癌细胞系和MDA-MB-231人乳腺癌细胞系作为优化qPCR-HRM方法技术参数的标准品,HT29细胞系为KRAS基因野生型,SW480细胞系为KRAS基因第12密码子G12V突变型,MDA-MB-231细胞系为KRAS基因第13密码子G13D突变型。
1.2 仪器与试剂Rotor-Gene 6000分析仪(QIAGEN,德国),琼脂糖凝胶电泳仪(DYY-8B型,北京六一仪器厂),BIO-RAD GelDoc XR凝胶成像系统(美国伯乐),TaKaRa广谱型DNA纯化试剂盒(DV811A),Nanodrop 2000紫外分光光度计,Typeit HRM PCR kit(QIAGEN),BIOER XP基因扩增仪(杭州博日科技有限公司)。
1.3 引物的设计与合成根据KRAS基因片段序列(NC-000012.11),运用primer premier 5.0软件设计能扩增出包括整个2号外显子的引物,并用BLAST验证引物的特异性。引物由北京六合华大基因科技股份有限公司合成。

1.4 基因组 DNA 提取MDA-MB-231细胞用含10%胎牛血清的DMEM高糖培养基,HT29和SW480细胞用含10%胎牛血清的RPMI 1640培养基,均于37℃、5%CO2饱和湿度细胞培养箱中培养,常规换液与传代,待细胞生长至对数生长期时,用TaKaRa广谱型DNA纯化试剂盒提取细胞基因组DNA,具体操作步骤按照试剂盒说明书进行。
1.5 PCR反应条件的优化以KRAS野生型HT29细胞DNA为模板,做梯度PCR,摸索最佳退火温度。用Nanodrop 2000紫外分光光度计测DNA浓度,并将DNA浓度稀释至30ng/μl,引物浓度为10μmol/L。根据引物Tm值,设立11个梯度的退火温度,从低到高依次为45.0℃、46.4℃、47.6℃、49.2℃、51.9℃、54.8℃、57.0℃、57.9℃、60.8℃、62.9℃和64.0℃,在BIOER XP基因扩增仪上进行梯度PCR反应。PCR反应体系为20μl,组成如下:2×HRM PCR Master Mix缓冲液10 μl,引物 KRAS-F和 KRAS-R各0.4μl,模板 DNA 1μl,RNase-free water 8.2μl。PCR 反应条件为95℃预变性10min;95℃变性20s,退火20s,72℃延伸20s;40个循环,最后72℃延伸5min。PCR产物用3%琼脂糖凝胶电泳检测,90V恒压电泳40 min,置于BIO-RAD凝胶成像系统下观察拍照。
1.6 PCR反应体系的优化以模板DNA、引物和MgCl2为实验因素,进行3因素3水平的正交实验优化反应体系(表1),即选用L9(34)正交表进行9种组合的实验(表2)。

表1 qPCR-HRM反应体系正交实验的水平和因素

表2 反应体系正交实验设计表L9(34)
1.7 HRM分析技术检测基因突变 用优化的qPCR-HRM反应体系和反应条件对HT29、SW480和MDA-MB-231细胞DNA进行PCR扩增并分析熔解曲线,用HT29细胞DNA样品做KRAS基因野生标准品,HRM方法分析检测SW480和MDAMB-231细胞DNA是否为KRAS基因第2外显子突变,并进行直接测序验证。
2 结果
2.1 退火温度的优化3%琼脂糖凝胶电泳检测PCR产物,目的片段为168bp。电泳显示,从45.0℃-64.0℃这11个温度温度梯度,差异明显。泳道1、2、3和4扩增的非特异性条带多,■泳道5~11均能扩增出目的条带,条带清晰,特异性好。泳道9扩增条带最清晰明亮,选定泳道9所对应的60.8℃为最适退火温度。见图1。

图1 温度梯度PCR结果
2.2 正交实验优化qPCR-HRM反应体系通过3因素3水平的正交实验,共9种实验组合,对qPCRHRM反应体系进行了优化。第5组合扩增曲线斜率较大,熔解曲线为高而窄的单一峰,电泳条带相对清晰、明亮。结合PCR扩增曲线、熔解曲线和PCR产物电泳图分析可得,第5实验组合为最佳反应体系:20μl qPCR-HRM 反应体系中,引物浓度为0.5 μmol/L,Mg2+为2.5mmol/L,模板 DNA 为40ng(图2和图3)。
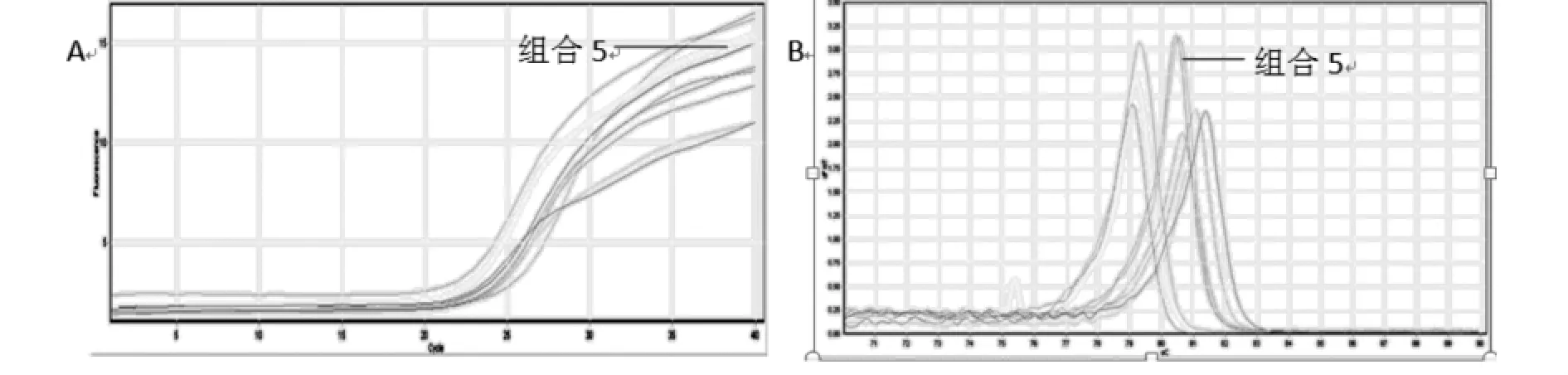
图2 正交实验qPCR-HRM扩增曲线和熔解曲线

图3 正交实验qPCR-HRM反应体系优化电泳图
2.3 HRM分析检测基因突变以 HT 29细胞DNA样品作为KRAS基因野生标准品,HRM分析检测SW480和 MDA-MB-231细胞DNA均为KRAS基因2号外显子突变型,直接测序结果和HRM分析结果一致,SW480细胞为KRAS基因G12V突变型(GGT>GTT),MDA-MB-231细胞为 KRAS基因G13D突变型(GGC>GAC)。HRM分析结果见图4,反向直接测序结果见图5。
3 讨论
HRM分析方法是在实时荧光定量PCR基础上通过饱和荧光染料监控核酸的熔解曲线变化进行分析的一种技术,所以qPCR的反应体系和反应条件直接影响HRM的结果分析。

图4 细胞样品HRM分析结果
PCR反应受许多因素影响,不同的引物具有不同的最适退火温度,退火温度的高低直接影响PCR扩增结果。温度过低,特异性差,非特异性条带多,温度过高会影响引物和模板的结合,扩增效率低,甚至无PCR产物扩增。本研究设置45.0℃-64.0℃11个梯度的退火温度,其中,60.8℃扩增的条带清晰、明亮,将其作为最适退火温度。

图5 细胞样品反向测序峰图
本研究采用3因素3水平的正交实验,对qPCR-HRM反应体系进行优化,建立了最佳的反应体系,在动态环境中考虑到PCR反应各因素的相互作用。因为各因素浓度过低时,可能无法扩增出产物;浓度过高时,非特异性条带可能增多及出现弥散状背景。Mg2+对PCR扩增的特异性和产量有显著的影响,是TaqDNA聚合酶活性所必需的,Mg2+浓度过高,反应特异性降低,不同反应之间对反应要素的竞争不平衡,表现为条带亮度不均一,甚至也会出现非特异性扩增;浓度过低会降低TaqDNA聚合酶的活性,使反应产物减少,表现为条带整体变暗甚至消失。模板DNA和引物的用量也直接影响PCR结果。过高的模板会螯合Mg2+,降低TaqDNA聚合酶活性,产生非特异性扩增;模板浓度太低,则扩增效率降低。引物浓度过高,易引起非特异性扩增及形成引物二聚体。从节约的角度考虑,只要能扩增出清晰、明亮、稳定的条带,模板DNA、Mg2+和引物的用量应越低越好。在图3中,泳道5、6、8扩增的条带均较明亮清晰,但结合扩增曲线和熔解曲线,综合考虑各因素的浓度,选择泳道5对应的各因素浓度作为最佳的qPCR-HRM反应体系。
用优化的qPCR-HRM反应体系和反应条件检测SW480和 MDA-MB-231细胞DNA突变,操作简便省时,闭管操作,避免污染,成本低,结果准确可靠,和直接测序法结果一致。直接测序法目前虽是检测基因突变的金标准,但操作繁琐,容易交叉污染,成本高,检测灵敏度低,不适合临床常规检测。HRM分析方法不仅用于检测基因突变,还可用于基因分型、甲基化研究、RNA编辑等方面,有望成为分子诊断的常规方法。
[1]Vossen RH,Aten E,Roos A,et al.High-Resolution Melting A-nalysis(HRMA):More ThanJust Sequence Variant Screening[J].Hum Mutat,2009,30(6):860.
[2]Erali M,Wittwer CT.High resolution melting analysis for gene scanning[J].Methods,2010,50(4):250.
[3]Vandersteen JG,Bayrak-Toydemir P,Palais RA,et al.Identifying common genetic variants by high-resolution melting[J].Clin Chem,2007,53(7):1191.
[4]Erali M,Voelkerding KV,Wittwer CT.High resolution melting applications for clinical laboratory medicine[J].Exp Mol Pathol,2008,85(1):50.
[5]Soulières D,Greer W,Magliocco AM,et al.KRAS mutation testing in the treatment of metastatic colorectal cancer with anti-EGFR therapies[J].Curr Oncol,2010,17:S31.
The Optimization of High Resolution Melting Analysis for KRAS Gene Mutations Detection
LIULi-qin1,2,ZHANGHaiyan2,WANGJie2.(1.GraduateInstituteofSouthernMedicalUniversity,Guangzhou510515,China;2.Departmentof MedicalResearch,GuangzhouGeneralHospitalofGuangzhouMilitaryCommand,Guangzhou510010,China)
ObjectiveTo establish the optimal reaction system and reaction conditions of high resolution melting for KRAS mutations detection,and lay the foundation for the rapid detection on the clinical genetic mutations.MethodsThe gradients of annealing temperature were set according to Tm value of primer in order to determine the appropriate annealing temperature.The orthogonal test was used to optimize qPCR-HRM reaction system in the three factors including DNA template,MgCl2and Primer.Through the SW480and MDA-MB-231cell lines KRAS mutations detected by HRM and direct sequencing,estimating the feasibility of reaction system and reaction conditions.ResultsThe optimal annealing temperature was 60.8℃.The optimization of 20μl qPCR-HRM reaction system including DNA template 40 ng,MgCl22.5mmol/L and Primer 0.5μmol/L was established by Orthogonal Design.The results between HRM and direct sequencing were consistent.ConclusionIt was simple,specific,accurate and reliable,and with clear electrophoretic bands and single melting curve peak to optimize qPCR-HRM reaction system by orthogonal test.This would provide a reference for the further development of rapid mutation detection by HRM on the clinical application.
mutation;high resolution melting;orthogonal test;optimization
R392
A
1007-4287(2012)07-1167-04
*通讯作者
刘丽琴(1986-),女,南方医科大学在读硕士研究生,主要研究方向:肿瘤分子诊断研究。
2011-12-24)
