GRIM-19及其截断体原核表达载体的构建及表达与纯化
2012-08-20王青元许乾乾朱圆圆
王青元,朱 靖,周 颖,许乾乾,朱圆圆,凌 斌
(安徽医科大学附属省立医院 妇产科分子实验室,安徽 合肥 230001)
GRIM-19及其截断体原核表达载体的构建及表达与纯化
王青元,朱 靖,周 颖,许乾乾,朱圆圆,凌 斌*
(安徽医科大学附属省立医院 妇产科分子实验室,安徽 合肥 230001)
目的 构建GRIM-19及其截断体原核表达载体,在大肠杆菌中诱导表达并纯化融合蛋白。方法用RTPCR法从HeLa细胞中扩增出带BamHⅠ、XhoⅠ酶切位点的GRIM-19及其截断体基因片段,将GRIM-19及其截断体基因片段克隆到pGEX-4T-3原核表达载体上,在大肠杆菌中诱导表达GST-GRIM-19及其截断体融合蛋白,用Glutathione Sepharose 4B纯化,纯化后蛋白经 Western-blot鉴定。结果pGEX-4T-3-GRIM-19及其截断体原核表达载体构建正确,并在大肠杆菌中成功诱导表达,IPTG诱导以浓度0.5mM,时间2h为宜,且通过Glutathione Sepharose 4B成功纯化到融合蛋白。结论成功构建GRIM-19及其截断体原核表达载体,诱导表达并纯化GST-GRIM-19及其截断体融合蛋白。
GRIM-19;诱导表达;纯化
(ChinJLabDiagn,2012,16:0191)
GRIM-19(gene associated with retinoid-interferon mortality-19,GRIM-19),是 GRIMs家族的重要成员[1],是2000年 Angell等[2]发现的由IFN 联合RA诱导表达的一种新的细胞凋亡调节因子,定位于19p13.2,该区的多种基因为前列腺癌的抑制基因。参与细胞增殖和凋亡的调控过程,其表达降低或位点突变可以导致细胞的异常增殖和恶性转化,GRIM-19在多种正常组织中表达,参与IFN/RA诱导的肿瘤细胞凋亡,抑制肿瘤的发生[3]。本实验我们利用基因克隆技术构建了GRIM-19及其截断体原核表达载体,通过异丙基-β-D-硫代半乳糖苷(IPTG)诱导pGEX-4T-3载体质粒启动子,成功诱导了GST-GRIM-19及其截断体的融合蛋白的表达,为今后研究GRIM-19的分子生物学功能奠定了基础。
1 材料与方法
1.1 材料
逆转录试剂盒、总RNA提取试剂Trizol购自Invitrogen公司,DEPC购自Sigma公司,TaqDNA聚合酶购自TakaRa公司,小剂量质粒提取试剂盒购自Axygen公司,限制性内切酶BamHⅠ,XhoⅠ及DNA连接酶均购自TaKaRa公司,IPTG购自天根公司,GST纯化试剂盒Glutathione Sepharose 4B购自GE公司,GST单抗购自GE公司,Westernblot化学发光底物购自PIERCE公司,BL21、pGEX-4T-3载体质粒感受态细菌由本实验室保存。
1.2 方法
1.2.1 pGEX-4T-3转化至大肠杆菌 参考分子克隆第3版中感受态细胞制备和质粒转化方法和步骤等[4],制备氨苄抗性的LB平板、BL21感受态细菌以及将pGEX-4T-3载体质粒转入BL21感受态细菌,经分离鉴定,得到含pGEX-4T-3的对照菌。
1.2.2 pGEX-4T-3-GRIM-19及其截断体引物设计 参考GenBank中GRIM-19碱基序列,通过Primer Premier 5.0软件进行分析后设计出GRIM-19及其截断体上下游引物(见表1),分别在GRIM-19的第35位氨基酸和第70位氨基酸位点截断(如表1),引物分别加入了BamHⅠ、XhoⅠ酶切位点(斜体字部分)。

表1 pGEX-4T-3-GRIM-19及其截断体引物设计
1.2.3 pGEX-4T-3-GRIM-19及其截断体原核表达载体的构建及鉴定 用trizol法提取HeLa细胞中总RNA,以Oligod(T)18为逆转录引物,以提取的总RNA为模板,在M-mlv反转录酶催化下反转录出cDNA,用上述特异性引物,采用TaKaRa Prime-STAR HS DNA聚合酶进行PCR,扩增目的基因。反应条件:98℃5min 1个循环,98℃10s66℃5s,72℃30s共35个循环,72℃10min 1个循环。各取100μl PCR产物在2%琼脂糖凝胶中电泳。依据TaKaRa胶回收纯化试剂盒操作规程,胶回收纯化目的片段,将GRIM-19及其截断体编码区片段与载体pGEX-4T-3分别用BamHⅠ、XhoⅠ酶切,胶回收获得酶切后pGEX-4T-3载体片段和GRIM-19及其截断体编码区片段,然后用TaKaRa T4DNA连接酶,16℃连接过夜,将连接产物转化入BL21感受态大肠杆菌,涂板(氨苄抗性),过夜生长。各挑取10个单克隆菌落于1ml氨苄抗性LB中生长4-6 h,无菌条件下取微量菌液做菌液PCR初筛,阳性者继续摇晃生长过夜。参照Axygen质粒小量提取试剂盒操作规程提取纯化pGEX-4T-3-GRIM-19及其截断体质粒,BamHⅠ、XhoⅠ酶切质粒,琼脂凝胶电泳鉴定为阳性者,送到上海生工生物工程有限公司测序鉴定。
1.2.4 融合蛋白的诱导表达 对照菌和重组菌分别涂板(氨苄抗性),37℃生长12h,各挑取1个菌落接种于1ml氨苄抗性的LB培养基,37℃培养过夜,培养物按1∶10接种于氨苄抗性的LB培养基,37℃培养至OD600=0.5-1;吸出1ml培养物放入1.5ml EP管中,-20℃保存并记录各自OD600值,其余的培养物中加入IPTG(终浓度0.5mM),30℃震荡培养2h,取1ml样品放入1.5ml EP管中,分别测OD600值,室温12 000rpm离心1min,沉淀重悬于40μl的2×SDS凝胶加样缓冲液,100℃煮3min,室温12 000rpm离心1min,上清按0.15OD量上样于15%的SDS-PAGE胶,考马斯亮蓝染色,观察表达产物条带。
1.2.5 融合蛋白的纯化 将诱导表达后的对照菌和重组菌分别用1×PBS重悬后,加入终浓度为1mM的Cocktail,1 280Kpa高压匀浆法破碎。4℃,12 000rpm离心30min,按照Glutathione Sepharose 4B纯化试剂盒说明书,上清加入Glutathione Sepharose 4B,4℃摇晃孵育2h。4℃,500g离心5min,沉淀用pH8.0的GSH Elution buffer洗脱,蛋白上清定量备用。
2 结果
2.1 GRIM-19及其截断体编码区片段的PCR产物电泳结果
DNA marker为DL2000DNA标准参照物,PCR产物琼脂糖凝胶电泳显示在432bp、105bp、105bp、222bp位置出现的特异性目的片段,与所设计的GRIM-19及其截断体编码区片段大小一致(图1)。
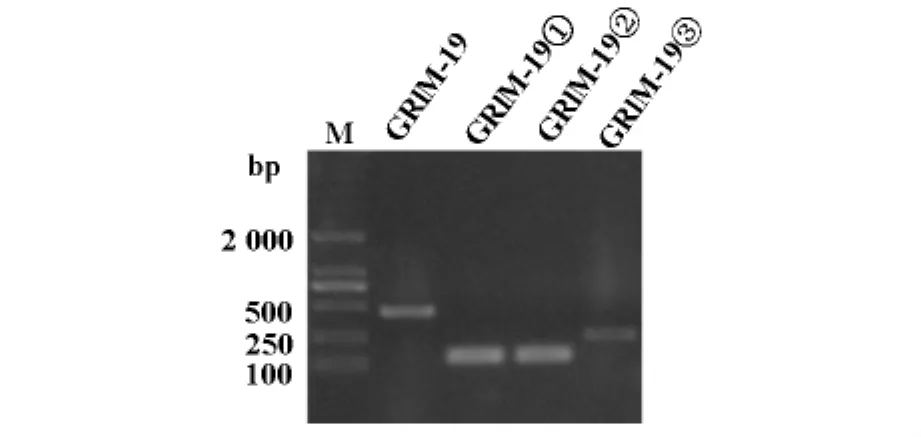
图1 GRIM-19及其截断体编码区片段的PCR产物电泳结果
2.2 pGEX-4T-3-GRIM-19及其截断体重组质粒酶切鉴定、测序
经BamHⅠ和XhoⅠ双酶切后出现分子量分别为4 900bp和432bp、105bp、105bp、222bp的特异性条带,正好与线性质粒pGEX-4T-3和GRIM-19及其截断体编码区片段的分子量一致(图2)。将pGEX-4T-3-GRIM-19及其截断体重组质粒送到上海生工生物工程有限公司测序鉴定,测序结果均与目的序列完全相同,表明构建载体成功。
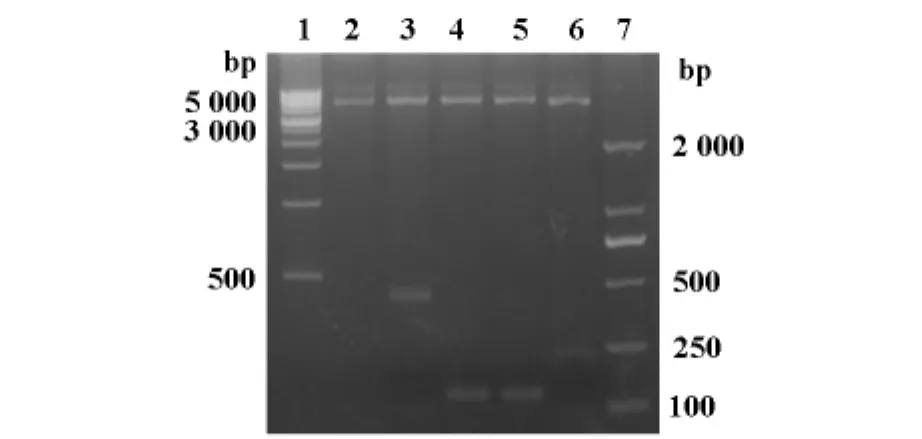
图2 重组质粒酶切鉴定图
2.3 融合蛋白诱导表达
对照菌和重组菌经0.5mM IPTG,30℃,诱导2h后,变性上样于15%的SDS-PAGE胶,考马斯亮蓝染色发现对照菌在26KD处出现很强条带,各重组菌分别在43KD、30KD、30KD、33KD处可见较强条带(图3),表明诱导表达成功。

图3 考马斯亮蓝染色检测目的蛋白诱导表达
2.4 融合蛋白纯化后的western-blot检测
将纯化好的GST及GST-GRIM-19及其截断体融合蛋白定量后进行SDS-PAGE电泳,再电转到PVDF膜上,经封闭后室温孵育一抗GST(1∶4 000)2h,TBS-T洗后加入相应的二抗孵育2h,膜经TBS-T洗后与ECL发光检测剂结合,经X片压片曝光,显示结果(图4)。
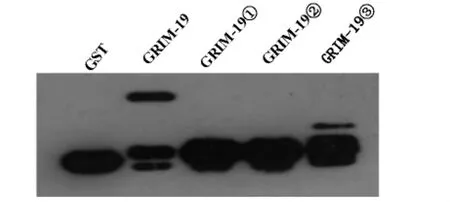
图4 Western-blot检测目的蛋白的表达
3 讨论
GRIM-19是新发现的参与细胞线粒体呼吸作用和细胞凋亡调控的新基因,主要表达在线粒体中,细胞核中微量表达[5]。GRIM-19蛋白由144个氨基酸组成,分子量约16KD,是线粒体中NADH脱氢酶复合体的基本亚单位,在Ⅰ型呼吸过程中发挥着重要作用[6]。研究发现,GRIM-19在甲状腺肿瘤、肾癌、口腔癌以及结直肠癌等肿瘤中表达降低[7]。本实验组前期研究发现在子宫颈鳞癌和卵巢癌中,GRIM-19的表达降低且与癌基因STAT3的表达呈负相关[8]。Lufei等[9]发现IFN/RA诱导肿瘤细胞凋亡的过程中上调了细胞中GRIM-19的表达。抑制GRIM-19的表达,IFN/RA诱导肿瘤细胞凋亡的作用减弱。反之,增加GRIM-19的表达则显著增加细胞的凋亡。本实验中,我们将GRIM-19基因分成三段。Kalvakolanu等[10]发现 GRIM-19①与抗肿瘤功能密切相关。Lufei等[9]发现GRIM-19②能够与STAT3结合发挥调节细胞增殖和凋亡的作用,从而拮抗STAT3激活所致的细胞永生化改变。GRIM-19③的功能目前不清楚。
大肠杆菌体外表达系统由于其遗传学、生物化学和分子生物学方面已充分被人们了解而成为许多异源蛋白质的首选表达系统。谷胱甘肽S-转移酶(GST)基因融合系统广泛地应用于分子免疫学和分子生物学的研究以及疫苗的生产。天然GST蛋白相对分子质量为26KD,pGEX系列质粒是目前较为常用的GST融合表达系统载体。本文选择的pGEX-4T-3大小为4.9KD,该载体含tac启动子和lacIq基因。未诱导条件下lacIq基因产物能结合在tac上,阻止tac启动子;IPTG诱导后,lacIq基因产物即从tac上释放出来,tac启动子被诱导启动表达,tac启动子后面的GST标签和外源性蛋白就能够表达出来[11]。同时该载体表达的外源蛋白可以通过Glutathione Sepharose 4B纯化得到特异性蛋白。
在诱导融合蛋白表达及纯化的过程中,IPTG的浓度、作用时间、诱导温度及裂菌的方式对融合蛋白的表达和纯化影响很大,因此,必须通过反复的实验来探索最佳IPTG浓度、作用时间和诱导温度等。本实验在前期摸索试验的基础上采用0.5mM IPTG,30℃,诱导2h等最佳诱导条件,既防止大量IPTG产生的细胞毒性作用、高温条件下蛋白容易出现错误折叠和形成包涵体又能满足外源蛋白大量表达的要求。
本实验中,我们成功构建了GRIM-19及其截断体的原核表达载体,在大肠杆菌中通过IPTG成功诱导GRIM-19及其截断体融合蛋白表达并使用Glutathione Sepharose 4B试剂盒法得到纯化蛋白。下一步,我们将借助溶血酶去掉GST标签得到裸的GRIM-19蛋白或者直接使用融合蛋白进行GRIM-19的体外生物学功能研究。
[1]Kalvakolanu DV.The GRIMs:a new interface between cell death regulation and interferon/retinoid induced growth suppression[J].Cytokine Growth Factor Rev,2004,15(2-3):169.
[2]Angell JE,Lindner DJ,Shapiro PS,et al.Identification of GRIM-19,a novel cell death-regulatory gene induced by the interferonbeta and retinoic acid combination,using agenetic approach[J].J Biol Chem,2000,275(43):33416.
[3]Chdambaram NV,Angell JE,Ling W,et al.Chromosomal localization of human GRIM-19,a novel IFN-beta and retinoic acid-ac-tivated regulator of cell death[J].J Interferon Cytokine Res,2000,20(7):661.
[4]J.萨姆布鲁克,D.W.拉塞尔,主编,黄培堂,译.分子克隆实验指南[M].北京:科学出版社,2002:1217-31.
[5]Huang G,Lu H,Hao A,et al.GRIM-19,a cell death regulatory protein,is essential for assembly and function of mitochondrial complex I[J].Mol Cell Bio,2004,24(19):8447.
[6]Huang G,Chen Y,Lu H,et al.Coupling mitochondrial respiratory chain to cell death:an essential role of mitochondrial complex I in the interferon-beta and retinoic acid-induced cancer cell death[J].Cell Death Differ,2007,14(2):327.
[7]周 颖,凌 斌.GRIM-19的功能及与肿瘤的相关性[J].医学分子生物学杂志,2008,5:262.
[8]朱 靖,卫 莹,王青元,等.GRIM-19基因的表达及沉默对子宫颈癌细胞株SiHa细胞中核转录因子STAT3表达的影响[J].现代妇产科进展,2010,19(4):245.
[9]Lufei C,Ma J,Huang G,et al.GRIM-19,a death-regulatory gene product,suppresses Stat3activity via functional interaction[J].EMBO J,2003,22(6):1325.
[10]Kalvakolanu DV,Nallar SC,Kalakonda S.Cytokine-induced tumor suppressors:A GRIM story[J].Cytokine.2010,52(1-2):128.
[11]Winograd E,Pulido MA,Wasserman M.Production of DNA-recombinant polypeptides by tac-inducible vectors using micromolar concentrations of IPTG[J].Biotechniques,1993,14(6):886.
Construction of GRIM-19and Its Truncated body prokaryotic expression vector and fusion protein induced expression and purification
WANGQing-yuan,ZHUJing,ZHOUYing,etal.(MolecularlaboratoryDepartmentofObstetricsand Gynecology,AnhuiProvincialHospitalaffiliatedtoAnhuiMedicalUniversity,Hefei230001,China)
ObjectiveTo construct the GRIM19and its truncated body prokaryotic expression vector,express the Fusion protein in E.coli and purify the expressed product.MethodsGRIM-19Its Truncated body gene sequence with BamHⅠand XhoⅠ,restriction enzyme cutting site were amplified from total RNA of HeLa cell line by reverse transcription-polymerase chain reaction(RT-PCR),then the GRIM-19its truncated body gene sequence was inserted into the prokaryotic expression vector pGEX-4T-3,induced express the fusion protein in E.coli and purified by Glutathione Sepharose 4B,Western-blot were used to test the fusion protein.ResultsThe pGEX-4T-3-GRIM-19its truncated body prokaryotic expression vector was constructed correctly and the fusion protein was correctly inducted expression,the optimal concentration and time of IPTG for induction was 0.5mM and 2h,and the fusion protein was successfully purified.ConclusionThe pGEX-4T-3-GRIM-19and its truncated body prokaryotic expression vector was successfully constructed,Inducible expression and purification of GST-GRIM-19and its truncated body fusion protein.
GRIM-19;inducible expression;purification
R730.231
A
1007-4287(2012)02-0191-04
国家自然科学基金资助(81072127、81001168)
*通讯作者
2011-08-16)
