虾夷马粪海胆致病菌强壮弧菌的PCR检测方法
2012-08-10常亚青封妮莎王轶南丁君刘志敏穆小虎
常亚青封妮莎王轶南丁君刘志敏穆小虎
(大连海洋大学农业部北方海水增养殖重点实验室,辽宁大连116023)
虾夷马粪海胆致病菌强壮弧菌的PCR检测方法
常亚青,封妮莎,王轶南,丁君,刘志敏,穆小虎
(大连海洋大学农业部北方海水增养殖重点实验室,辽宁大连116023)
强壮弧菌Vibriofortis是虾夷马粪海胆Strongylocentrotusintermedius的一种致病菌。为建立强壮弧菌的PCR检测方法,根据强壮弧菌gyrB基因的高度变异区序列设计引物,筛选出特异性强的3对引物VF-6、VF-7及VF-8,分别对强壮弧菌S0907及20株参比菌株进行PCR扩增,结果显示,3对引物均对强壮弧菌扩增出与预期大小一致的目的基因片段且参考菌株无扩增条带。以不同稀释度的菌悬液制备的DNA模板进行PCR扩增,结果显示,3对引物VF-6、VF-7及VF-8可检测的最低细菌浓度分别为4.1×104、4.1× 103、4.1×102cfu/mL;对不同稀释度的细菌DNA模板进行PCR扩增,结果显示,3对引物VF-6、VF-7及VF-8可检测的最低DNA含量分别为1.4、0.14、0.014 pg/μL。试验结果表明:3对引物的特异性均较好,但灵敏度存在差异,其中以VF-8为引物的PCR检测方法最佳;使用以VF-8为引物的PCR检测方法对实验室养殖海胆及其生境样品进行初步检测,健康海胆、养殖海水及投喂的海带均为阴性,而自然海域海水中带有一定量的强壮弧菌。
虾夷马粪海胆;强壮弧菌;PCR检测;gyrB基因
虾夷马粪海胆Strongylocentrotusintermedius于1989年由大连海洋大学自日本引进中国,目前已经成为中国主要的海水养殖品种之一。随着海胆养殖业的发展及养殖环境的污染,海胆也面临着病害的威胁,如海胆的黑嘴病、红斑病、秃海胆病等细菌性疾病及海胆变形虫病等[1-4]。海胆细菌性疾病的主要病原菌多为弧菌[5-6],经本课题组研究证实,强壮弧菌Vibriofortis是虾夷马粪海胆的一种致病菌[7]。此外,强壮弧菌还可导致虹鳟鱼患病,也可使卤虫无节幼体死亡率达100%[8],但目前尚未见对其检测方法的相关报道。
gyrB基因是普遍存在于细菌内编码DNA促旋酶中B亚单位蛋白的基因,与rpoD、rpoB、groE等基因相比,gyrB基因对相近物种具有很高的分辨率[9-11],在定量分析技术上可以弥补16S rDNA基因保守性过高[12]及DGGE图谱中易对微生物多样性造成假象[13]等一系列缺陷,因此,常用其作为区分亲缘较近种的靶基因。目前,gyrB基因已应用于多重PCR技术、PCR-ALFP技术等多种方法的研究中[14-15]。本研究中,作者基于gyrB基因结合PCR快速检测技术,根据强壮弧菌高度变异区序列设计引物,筛选出特异性强、灵敏度高的强壮弧菌VibriofortisPCR检测方法引物,旨在为海胆的致病菌检测、监控等提供参考。
1 材料与方法
1.1 材料
强壮弧菌S0907由大连海洋大学农业部北方海水增养殖重点实验室 (简称为本实验室)提供,该菌分离自虾夷马粪海胆综合疾病患病处[7]。参比菌株20株,包括:鳗弧菌、哈维氏弧菌、副溶血弧菌、溶藻弧菌、创伤弧菌与嗜水气单胞菌等常见水产动物致病菌,黄海希瓦氏菌、灿烂弧菌、杀鲑气单胞菌与河豚毒素假交替单胞菌等棘皮动物致病菌株,以及强壮弧菌参比菌株D14J223。各菌株名称、编号及其来源详见表1。
1.2 方法
1.2.1 细菌基因组的提取 将细菌于2216E培养基上划线分离,于28℃下培养18~24 h,挑取单菌落悬浮于无菌水中并稀释至108cfu/mL,用细菌基因组提取试剂盒 (天根生物科技有限公司生产)提取DNA模板。

表1 细菌菌株编号及来源Tab.1 Detail of the bacteria used in the experiment
1.2.2 引物设计 在GenBank上分别查找强壮弧菌及与其亲缘关系相近的灿烂弧菌、哈维氏弧菌、副溶血弧菌、溶藻弧菌等细菌的gyrB基因,利用Blast软件进行比对分析,选择高度变异区序列,利用Primer 5.0软件设计引物,由上海生工生物有限公司合成 (表2)。
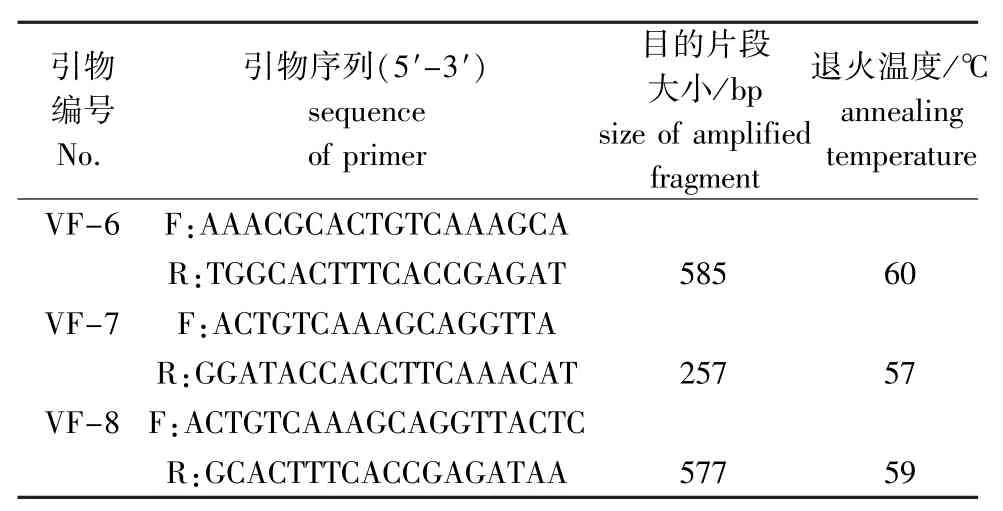
表2 引物的序列及目的基因片段大小Tab.2 Sequences of primers and the sizes of am plified fragments
1.2.3 PCR反应 PCR反应体系共25μL,包括MgCl2(25 mmol/L)1.5μL,10×PCR Buffer 2.5 μL,dNTP(2.5 mmol/L)2.0μL,TaqDNA酶(250 U/μL)0.125μL,上、下游引物各1μL, DNA模板1μL,用ddH2O补至25μL。
PCR反应程序:94℃下预变性3 min;94℃下变性30 s,57℃下退火30 s,72℃下延伸1 min,共进行35个循环;最后在72℃下延伸10 min,于4℃下保存。取PCR产物4μL,用10 g/L琼脂糖凝胶进行电泳,采用凝胶成像系统观察并拍照。PCR产物经宝生物工程 (大连)有限公司纯化并测序。
1.2.4 特异性及灵敏度的检验 以强壮弧菌S0907以及20株参比菌株的DNA为模板,分别对其进行PCR扩增。
将强壮弧菌悬浮于无菌水中并稀释至 108cfu/mL,依次进行10倍浓度的稀释。用细菌基因组试剂盒分别提取不同浓度梯度细菌的DNA模板,每个PCR反应体系中加1μL DNA模板进行PCR扩增。用平板活菌计数法确定菌悬液的浓度。
对浓度为107cfu/mL的强壮弧菌DNA模板采用微量光度计定量,并依次进行10倍浓度的稀释,取各稀释度DNA模板1μL为进行PCR扩增。
1.2.5 海胆及环境样品的检测 从本实验室养殖室随机选择4个虾夷马粪海胆养殖槽,分别取养殖海水1 L,并随机选择10枚健康海胆 (直径为3~6 cm,体质量为16~30 g)及投喂用海带5 g。另从黑石礁自然海域取海水1 L及海带20 g。
用一次性注射器分别抽取海胆体腔液1 mL,离心 (500×g,2 min,4℃)后取上清液;水样经0.22μm无菌滤膜过滤富集后使用1 mL无菌水冲洗收集;用无菌刀片刮取各养殖槽内或自然海域海带的表面黏液,混合后用无菌水稀释至1 mL。将上述样品分别于100℃水浴中煮沸10 min后快速冷却,以12 000 r/min离心10 min,取上清作为DNA模板,分别按 “1.2.3”的PCR反应及反应程序进行PCR扩增。以 “1.2.4”中制备的不同浓度的细菌DNA模板为对照。
2 结果
2.1 PCR引物特异性的检验
灵敏度检测结果显示,3对引物均对强壮弧菌扩增出与预计大小一致的DNA片段,其它参比菌株无特异条带 (图1)。PCR扩增产物经测序,用Blast软件进行比对分析,与强壮弧菌的相似性为99%。研究表明,3对引物均具有较好的特异性。

图1 引物VF-6、VF-7和VF-8对强壮弧菌及参比菌株的PCR扩增结果Fig.1 Result of PCR am p lification w ith primer VF-6,VF-7,and VF-8 for V.fortis and reference strains
2.2 PCR引物灵敏度的检验
经活菌计数法计算,10个梯度的活菌浓度为4.1×10-1~4.1×108cfu/mL;经微量光度计测定,10个梯度的细菌DNA浓度为1.4×10-2~1.4×103pg/μL。利用引物VF-6、VF-7、VF-8分别对不同细菌浓度及不同DNA浓度进行PCR扩增。结果显示,3对引物VF-6、VF-7、VF-8可检测的最低细菌浓度分别为4.1×104、4.1×103、4.1×102cfu/mL,可检测的最低 DNA含量分别为 1.4、0.14、0.014 pg/μL(图2)。
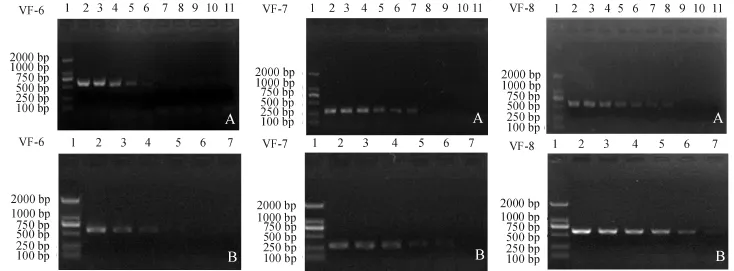
图2 引物VF-6、VF-7和VF-8对细菌浓度及DNA浓度灵敏度的扩增结果Fig.2 Sensitivity of PCR detection w ith primer VF-6,VF-7,and VF-8 for bacterial concentration and genome DNA concentration
2.3 对海胆体腔液及环境的检测
利用引物VF-8分别对各样品进行强壮弧菌的PCR检测,养殖健康海胆体腔液、实验室海胆养殖海水、实验室养殖环境海带及黑石礁海域海带均无扩增条带,仅黑石礁海域海水扩增到浓度与103cfu/mL相近的特异片段 (图3)。

图3 引物VF-8对海胆及其环境样品的PCR扩增结果Fig.3 PCR amp lifications of samples from sea urchin and environment by primer VF-8
3 讨论
病原菌的检测方法除常规的生理生化鉴定技术外,还包括免疫学、PCR检测方法及芯片检测技术等[16-17]。与其他方法相比,PCR检测方法具有简便、快速、特异性强等优点,近年来在多种病原菌的检测中广泛应用。本研究中基于gyrB基因筛选到3对强壮弧菌特异性引物并建立了PCR检测方法,可将强壮弧菌与常见水产动物致病弧菌、假单胞菌等以及其它棘皮动物致病菌区分开。
以引物VF-8建立的PCR快速检测方法具有较高的灵敏度,可检测的最低DNA含量为0.014 pg/μL,最低细菌浓度为4.1×102cfu/mL。相关研究中,基于16S rDNA基因建立的灿烂弧菌PCR检测方法,可检测的DNA最低含量为0.5 pg[18],利用toxR基因建立的溶藻弧菌PCR检测方法,可检测的DNA最底限为0.01 pg[19]。因此,从细菌检测的最低DNA含量比较,本研究中建立的强壮弧菌检测方法表现出更高的灵敏度。同时,本结果也反映出以gyrB基因为检测目的片段具有一定的优越性。与DNA检测量相比,活菌检测灵敏度在实践应用中更为直观。同样以gyrB基因为目的片段,应用多重PCR方法检测多种弧菌,其检测范围为4 ×104~2×103cfu/mL[20]。创伤弧菌的PCR检测方法灵敏度为300 cfu/g[21],溶藻弧菌的实时荧光定量PCR检测方法灵敏度为102cfu/mL[22],与本研究中检测方法的灵敏度相当。
强壮弧菌为条件性致病菌,对虾夷马粪海胆的半致死浓度为105cfu/mL[7-8]。本研究中,在自然海域的海水中检测出强壮弧菌量为103cfu/mL,而对养殖槽内海水的检测结果为阴性,即强壮弧菌含量低于4.1×102cfu/mL,并远小于强壮弧菌的半致死浓度。推测养殖用水经沙滤等处理后细菌大大降低,仅在条件恶化时细菌才增殖,进而导致海胆患病。本研究中,对养殖健康海胆与投喂海带的检测结果均为阴性,提示海胆生境可能没有或仅存在极少量的强壮弧菌。另外,由于养殖中投喂的海带取自自然海域,其有可能是致病菌传播的媒介。但本研究结果显示,虽然自然海域海水中存在一定量的强壮弧菌,但海带所携带的强壮弧菌含量可能极微,至少低于检测限,其是否与强壮弧菌的传播有关仍需进一步探讨。
[1] 常亚青,丁君,宋坚,等.海参、海胆生物学研究与养殖[M].北京:海洋出版社,2004.
[2] 王斌,李岩,李霞,等.虾夷马粪海胆“红斑病”病原弧菌特性及致病性[J].水产学报,2006,20(3):371-375.
[3] Maes P,Jangoux M.The bald-sea-urchin disease:a biopathological approach[J].Helgolander Meeresunters,1984:37:217-244.
[4] Miller R J.Succession in sea urchin and seaweed abundance in Nova Scotia[J].Canada Mar Bio1,1985,84:275-286.
[5] Takeuchi K,Tajima K,Iqbal M M,et al.Taxonomical and serological studies on the causative bacteria of the disease of sea urchinStronglocentrotusintermediusoccurring at low water temperature [J].Fisheries Science,1999,65(2):264-268.
[6] 王轶南,刘艳萍,常亚青.患病与健康虾夷马粪海胆(Strongylocentrotusintermedius)体腔液菌群的PCR-DGGE分析比较[J].中国农业科技导报,2011,13(1):111-116.
[7] Wang Y N,Feng N S,Li Q,et al.Isolation and characterization ofbacteria associated with a syndrome disease of sea urchinStrongylocentrotusintermediusin North China[J/OL].Aquaculture Research.DOI:10.1111/j.1365-2109.2011.03073.x.http://onlinelibrary.wiley.com/doi/10.1111/j.1365-2109.2011.03073. x/abstract.
[8] Austin B,Austin D,Sutherland R,et al.Pathogenicity ofVibriosto rainbow trout(Oncorhynchusmykiss,Walvaum)andArtemianauplii[J].Environ Microbiol,2005(7):1488-1495.
[9] Kupfer M,Kuhnert P,Koeczak BM,et al.Genetic relationships ofAeromonasstrains inferred from 16S rRNA,gyrB,andrpoBgene sequences[J].Int JSyst Evol Micmbiol,2006(5):2743-2751.
[10] Volokhov D V,Neveriv A A,George J,et al.Genetic analysis of housekeeping genes ofmembers of the genusAcholeplasma:Phylogeny and complementary molecular markers to the 16S rRNA gene[J].Molecular Phylogenetics and Evolution,2007,44(2): 527-532.
[11] Chelo M I,Ze-Ze L,Tenreiro R,etal.Congruence of evolutionary relationships inside theLeuconostoc-Oenococcus-Weissella clade assessed by phylogenetic analysis of the 16S rRNA gene,dnaA,gyrB,rpoC,anddnaK[J].Int JSyst EvoIMicr,2007,57:276-286.
[12] Wang L,Lee F,TaiC,et al.Comparison ofgyrBgene sequences, 16S rRNA gene sequences and DNA-DNA hybridization in theBacillussubtilisgroup[J].Int JSyst Evol Micro,2007,57:1846-1850.
[13] Wang X,Haruta S,Wang P,etal.Diversity of a stable enrichment culture which is useful for silage inoculantand its succession in alfalfa silage[J].FEMSMicrobiol Ecol,2006,57:106-115.
[14] Higgins P G,Lehmann M,Wisplinghoff H,et al.GyrBMultiplex PCR to differentiate betweenAcinetobactercalcoaceticusandAcinetobactergenomic species 3[J].JClin Microbiol,2010,48(12): 4592-4594.
[15] Gulati PS,Virdi JS.The rrn locus andgyrBgenotyping confirm the existence of two clonal groups in strains ofYersiniaenterocoliticasubspeciesPalearcticabiovar1 A[J].Rea Microbiol,2007,158 (3):236-243.
[16] 李晨,黄倢,谢国驷,等.3种水产病原菌简型基因芯片检测技术的建立[J].中国海洋大学学报,2011,41(3):37-42.
[17] 景宏丽,李强,吴秋仙,等.黄海希瓦氏菌单抗介导间接ELISA快速检测技术的建立[J].大连海洋大学学报,2010,25(6): 547-552.
[18] 张凤萍,王印庚,李胜忠,等.应用PCR方法检测刺参腐皮综合征病原灿烂弧菌[J].海洋水产科学,2008,29(5):101-107.
[19] 韩一凡,莫照兰,李杰,等.溶藻弧菌的PCR快速检测方法[J].中国海洋大学学报,2009,39(6):1237-1240.
[20] Chua K H,Thong K L.The simultaneous differential detection of human pathogenic and nonpathogenicVibriospecies using amultiplex PCR based ongyrBandpntAgenes[J].J Appl Microbiol, 2010,108(6):1940-1945.
[21] Kumai H S,Parvathi A,Karunasagar I,et al.AgyrB-based PCR for the detection ofVibriovulnificusand its application for direct detection of this pathogen in oyster enrichment broths[J].Int J Food Microbiol,2006,111(3):216-20.
[22] Zhou S,Hou Z,LiN,etal.Developmentof a SYBRGreen I realtime PCR for quantitative detection ofVibrioalginolyticusin seawater and seafood[J].Applied Microbiology,2007,103:1897-1906.
PCR detection of pathogen Vibrio fortis in sea urchin Strongylocentrotu intermedius
CHANG Ya-qing,FENG Ni-sha,WANG Yi-nan,DING Jun,LIU Zhi-min,MU Xiao-hu
(Key Laboratory of Mariculture&Stock Enhancement in North China's Sea,Ministry of Agriculture,Dalian Ocean University,Dalian 116023,China)
Vibriofortisis a pathogenic bacteria of sea urchinStrongylocentrotusintermedius.To establish PCR detection process ofV.fortis,three pairs of primer VF-6,VF-7 and VF-8 were designed according to the specified region ofgyrBgenes ofV.fortis.20 strains of bacteria were included in PCR amplification as control.The results showed that the amplified fragments of PCR applied with the three pairs of primerwere all agreed with the expected sizes,and no PCR product was found from the other reference strains.Different dilutions of bacterial suspension were used as DNA templates in PCR amplification,the results showed that the three pairs of primer was found to detect theminimum bacterial concentration of 4.1×104,4.1×103,4.1×102cfu/mL respectively.Meanwhile,different dilutions of DNA were performed in PCR amplification,the results showed that theminimum detectable concentration of bacteria DNA was 1.4,0.14,0.014 pg/μL respectively.These experiments showed that all the three pairs of primers demonstrated excellent specificity toV.fortis.However,the sensitivity of the PCR amplifications was different among the three primers,PCR procedure applied with primer VF-8 showing the best.V.fortisin coelomic fluid of sea urchin and the environmental sampleswere detected by PCR detection method with VF-8.The results of healthy sea urchin,breeding seawater and feeding kelp were negative,while the sample of seawater from natural sea area had a certain amount ofV.fortis.
Strongylocentrotusintermedius;Vibriofortis;PCR detection;gyrBgene
S947.9
A
2012-04-25
国家自然科学基金资助项目 (30972269);辽宁省 “百千万人才工程”资助项目 (2008921059);国家海洋局海洋公益项目(201105007)
常亚青 (1967-),教授,博士生导师。E-mail:yqchang@dlou.edu.cn
2095-1388(2012)04-0289-05
