海洋微藻的加压气浮采收工艺研究
2012-08-10李秀辰牟晨晓母刚李丰
李秀辰牟晨晓母刚李丰
(大连海洋大学辽宁省渔业装备工程技术研究中心,辽宁大连116023)
海洋微藻的加压气浮采收工艺研究
李秀辰,牟晨晓,母刚,李丰
(大连海洋大学辽宁省渔业装备工程技术研究中心,辽宁大连116023)
对小球藻Chlorococcumsp.和金藻Dicrateriazhanjiannsis的回流式、气液加压气浮采收工艺进行了研究,通过单因子和综合因子试验,探讨了微藻液位高度、藻液流量、溶气压力和气体流量对微藻采收效果的影响。结果表明:微藻液位高度对小球藻和金藻采收效果的影响最显著;当微藻液位高度、藻液流量、溶气压力或气体流量分别为1.2m、400 L/h、0.6 MPa或120 L/h时,微藻可获得较好的采收效果;小球藻Ⅰ、小球藻Ⅱ和金藻的最大采收率分别为60.3%、68.1%和65.4%。试验结果显示,在不改变藻液pH值和不添加絮凝剂的条件下,利用回流式、连续加压气浮技术对微藻进行采收,采收效果优于传统气浮采收。
海洋微藻;采收;溶气气浮;回流
海洋微藻不仅是重要的海产动物饵料及食品、工业原料,而且已被列为第三代可再生能源和环境增值能源开发的重要原料[1-4]。由于微藻细胞小、浓度低[5],无论作为水产饵料还是作为生物质原料,一般需要进行浓缩分离[5-6]。采用离心、化学(生物)絮凝、超声波或膜技术等均可实现微藻浓缩,但上述方法存在着成本高、微藻产品被污染或膜件堵塞等突出问题[6-11]。利用气浮技术分离水体中的微型固体颗粒 (<30μm),在工农业生产和污水处理中已得到广泛应用[12-13]。近年来,已有利用气浮技术采收微藻的研究报道[14-15]。 Wiley等[16]将空压机制备的超饱和溶气水与氧化塘小球藻Chlorella和栅藻Scenedesmu藻液混合,进行气浮浓缩小规模试验研究,发现添加一定量的絮凝剂(C-FLOC 60),微藻的气浮采收率达76.7% ~84.9%;曾文炉等[17]将空压机制备的溶气水与钝顶螺旋藻Spirulinaplayensis藻液混合,进行气浮采收小规模试验,发现添加絮凝剂、调节pH值和提高溶气压力,微藻的气浮采收率可达25%~45%,能耗为离心分离的40% ~65%;崔景芹等[18]利用氮气瓶提供气源,对盐藻Dunalillasalina进行气浮采收小规模试验,发现将藻液pH值提高到10.5~11.5时,采收率在80%以上;高莉丽等[19-20]将空压机制备的溶气水分别与小球藻和紫球藻Prophyridiumcruentum藻液混合,进行气浮浓缩小规模试验,通过调节pH值、调控溶气时间和溶气水流量等,微藻细胞的采收率在90%以上。虽然目前对微藻的气浮采收已获得较高的采收率,但多是在与气浮絮凝联合作用或通过改变藻液的pH值来实现的,絮凝剂的添加和pH值的改变不仅会造成微藻产品的污染和微藻细胞活力的下降,还会增加采收和后续加工的成本[5,21];此外,目前微藻的气浮采收主要是利用空压机或高压气瓶制备溶气水,再与藻液混合进行气浮分离,不仅增加了附属设备投资,而且溶气水还会稀释藻液,降低藻液的浓缩效率[16]。本研究中,作者拟采用回流式、连续加压溶气气浮工艺,对海洋微藻进行气浮浓缩试验研究,探讨在不添加絮凝剂和不调节藻液pH值的条件下,海洋微藻气浮采收的可行性及效率,确定海洋微藻气浮采收的合理工艺条件。
1 材料与方法
1.1 材料
试验用海水小球藻Chlorococcumsp.和湛江叉鞭金藻Dicrateriazhanjiannsis(简称为金藻)藻液均购自大连汇新钛设备有限公司。
1.2 方法
1.2.1 加压气浮采收系统工作原理 连续加压溶气气浮试验系统主要由型号为2 0 NPD 0 4 Z的尼可尼泵、压力溶气罐(Φ200 mm×430 mm,0~0.6 MPa)、释气装置、气液接触器(Φ240 mm× 1 600 mm)和泡沫收集器等组成(图1)。采用尼可尼气液混合泵,可实现同时吸入藻液和空气,并且产生微米级气泡,克服了传统的溶气气浮装置体积大、能耗高、释气气泡过大和藻液被溶气水稀释等弊端。
加压气浮采收系统工作时,微藻原液和空气同时由尼可尼泵吸入,在溶气罐内混合增压,混合液由气液接触器底部进入释气装置进行减压释放,所产生的大量微气泡在上升过程中不断黏附微藻颗粒,并将微藻颗粒载至气液接触器液面上部的收集槽;采收后的藻液由接触器底部排出,再次由尼可尼泵吸入进行气浮浓缩,每次试验持续15~20 min。
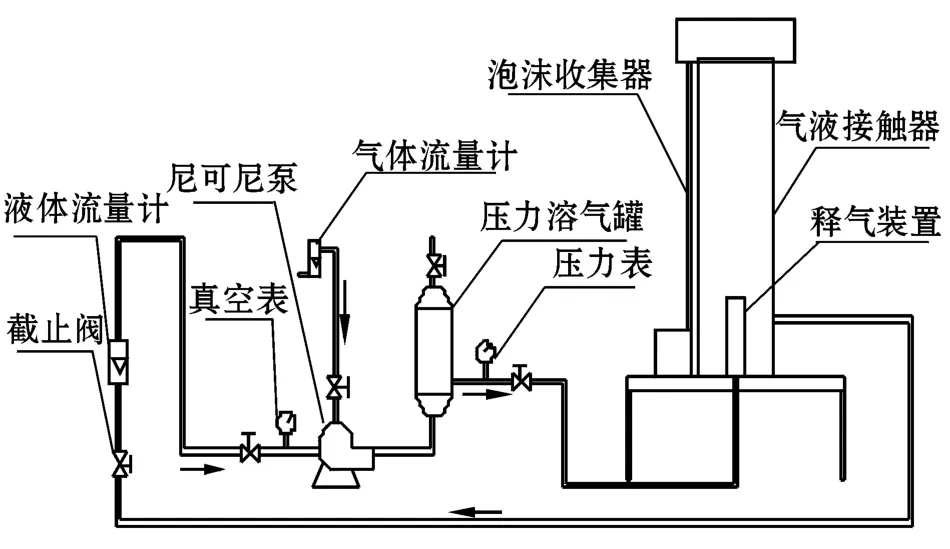
图1 加压气浮采收系统原理图Fig.1 Schematic diagram of dissolved air flotation system
1.2.2 微藻采收试验 选用小球藻Ⅰ (密度为68万个/mL)、小球藻Ⅱ (密度为390万个/mL)和金藻 (密度为184万个/mL)培养液进行气浮采收试验,试验温度为 (20±2)℃。首先选取微藻液位高度、藻液流量、溶气压力和气体流量进行单因子试验,然后根据单因子试验结果,进行综合因子的正交试验。
1.2.3 测定方法 每次试验开始前和系统运行15 min后,分别在原藻液、浓缩液中各取3个平行样,测定藻液浊度和单位体积的微藻细胞个数,取其平均值进行气浮采收效果评价。
采用TSZ-400B台式智能散光浊度仪测定藻液浊度;采用Motic B1生物光学显微镜及血球计数板方法测定微藻细胞个数,试验所用的血球计数板规格为25×16。微藻液浓缩倍数和细胞采收率计算公式为
B=Tse/Tsi,R= (Nse-Nsi)/Nse,
其中:B为微藻浓缩倍数 (倍);Tsi、Tse分别为微藻原液和微藻浓缩液的浊度 (NTU);R为微藻采收率 (%);Nsi、Nse分别为微藻原液和微藻浓缩液的密度 (万个/mL)。
2 结果与分析
2.1 微藻液位高度对微藻气浮采收效果的影响
在藻液流量为400 L/h,溶气压力为0.4 MPa的试验条件下,液位高度对小球藻和金藻气浮采收效果的影响试验结果见图2。从图2可见:当微藻液位高度为0.6~1.0 m时,随着液位高度的增加,微藻的采收率随之升高,当微藻液位高度为1.0 m时,小球藻Ⅰ、小球藻Ⅱ和金藻的采收率均达到最大,分别为60.3%、55.0%和47.8%。当液位高度超过1.0 m时,微藻采收率呈下降趋势,其中小球藻Ⅰ的采收率降幅最大,微藻液位高度为1.2 m时,小球藻Ⅰ的采收率降至7.4%;微藻液位高度为1.4 m时,小球藻Ⅱ的采收率降至41.6%。当微藻液位高度由0.6 m升到1.0 m时,小球藻Ⅱ和金藻的浓缩倍数增至最大,分别为1.63和1.46;当液位高度超过1.0 m时,两种藻液的浓缩倍数开始下降,当液位高度为1.2 m时,小球藻Ⅱ和金藻的浓缩倍数分别降至1.52和1.37;在试验液位范围内,小球藻Ⅰ的浓缩倍数变化不大 (1.01~1.06)。可见,由于小球藻Ⅰ的浓度较低,其气浮采收效果不稳定;当液位高度保持在0.8~1.2 m时,小球藻Ⅱ和金藻的采收效果比较理想。

图2 液位高度对微藻采收效果的影响Fig.2 Effects of liquid height on harvesting efficiency of algaem icroalgae
2.2 藻液流量对微藻采收效果的影响
在微藻液位高度为1.0 m,溶气压力为0.4 MPa的试验条件下,藻液流量对小球藻和金藻气浮采收效果的影响试验结果见图3。从图3可见:当藻液流量由200 L/h提高到400 L/h时,微藻的采收率明显增加,当藻液流量为400 L/h时,小球藻Ⅰ、小球藻Ⅱ和金藻的采收率均达到最大,分别为41.5%、63.2%和50.0%;继续增加流量,微藻的采收率呈下降趋势,当藻液流量为500 L/h时,小球藻Ⅰ、小球藻Ⅱ和金藻的采收率分别降至24.6%、49.0%和35.7%。小球藻Ⅱ和金藻浓缩倍数的变化与采收率的变化基本一致,当藻液流量由200 L/h提高到400 L/h时,两种藻液的浓缩倍数增至最大,分别为1.41和1.66,继续增加流量,浓缩倍数呈下降趋势;由于小球藻Ⅰ的浓度较低,其浓缩倍数变化不显著 (1.06~1.14)。可见,当藻液流量保持在200~600 L/h时,小球藻Ⅱ和金藻的采收效果比较理想。

图3 藻液流量对微藻采收效果的影响Fig.3 Effects of liquid flow rate on harvesting efficiency ofm icroalgae
2.3 溶气压力对微藻采收效果的影响
在微藻液位高度为1.0 m,流量为400 L/h的试验条件下,溶气压力对小球藻Ⅱ和金藻气浮采收效果的影响试验结果见图4。从图4可见:当溶气压力由0.2 MPa升至0.4 MPa时,小球藻Ⅱ的采收率明显增加,并且达到最大 (58.4%),继续增加溶气压力,小球藻Ⅱ的采收率呈缓慢下降趋势,当溶气压力为0.6 MPa时,其采收率降至54.4%;当溶气压力由0.4 MPa升至0.5 MPa时,金藻的采收率由53.4%增至54.9%,当溶气压力为 0.6 MPa时,其采收率降至50.1%。当溶气压力由0.2 MPa升至0.4 MPa时,小球藻Ⅱ的浓缩倍数由1.39增至1.77,并且达到最大,随着溶气压力继续增加,浓缩倍数逐渐降低,当溶气压力为0.6 MPa时,其浓缩倍数降为1.32;而金藻浓缩倍数的变化与其采收率的变化基本一致,当溶气压力为0.5 MPa时,其浓缩倍数达到最大 (2.38)。综合分析试验结果可知,提高溶气压力更有利于微藻的气浮采收。
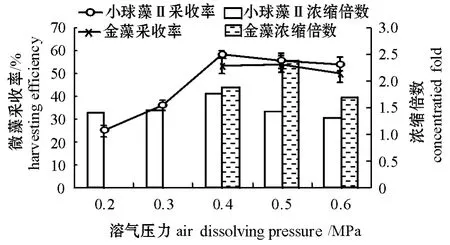
图4 溶气压力对微藻采收效果的影响Fig.4 Effects of air dissolving pressure on harvesting efficiency ofm icroalgae
2.4 气体流量对金藻气浮采收效果的影响
在微藻液位高度为1.0 m,流量为400 L/h的试验条件下,气体流量对金藻气浮采收效果的影响试验结果见图5。从图5可见:当气体流量由40 L/h提高到120 L/h时,金藻的采收率增至最大(50.0%),当气体流量提高至160 L/h时,金藻的采收率降至30.8%;当气体流量由40 L/h升提高到80 L/h时,金藻的采收倍数由1.34增至1.45,继续增加气体流量时,其浓缩倍数增幅不显著(1.45~1.46)。可见,当气体流量保持在80~160 L/h时,金藻的气浮采收效果比较理想。

图5 气体流量对微藻采收效果的影响Fig.5 Effects of air flow rate on harvesting efficiency ofm icroalgae
2.5 综合因子试验
选择小球藻Ⅱ和金藻两种藻液,选用L9(34)正交表分别进行正交试验。正交试验因素及水平见表1,试验设计方案及试验结果见表2。
从极差分析结果 (表2)可见:影响小球藻Ⅱ采收效果的主要因子为微藻液位高度,其次为藻液流量和溶气压力,最优因子组合为A3B2C3;影响金藻采收效果的因子依次为微藻液位高度、气体流量和藻液流量,最优因子组合为A3B2C2。通过验证试验发现:在最优组合条件下,即微藻液位高度、藻液流量和溶气压力分别为1.2 m、400 L/h和0.6 MPa时,小球藻Ⅱ的气浮采收率最高,为68.1%;微藻液位高度、藻液流量和气体流量分别为1.2 m、400 L/h、120 L/h时,金藻的气浮采收率最高,为65.1%。可见,3因子共同作用时,微藻液位高度对小球藻Ⅱ和金藻采收效果的影响最显著,因此,合理调控微藻液位高度,对提高微藻的气浮采收率比较有利。

表1 试验因子及其水平Tab.1 Experimental parameters and levels

表2 微藻采收正交试验设计方案及试验结果Tab.2 The resu lts of orthogonal design for harvesting ofm icroalgae
3 讨论
本试验结果显示,微藻液位高度过低或过高均不利于气浮采收,当液位高度小于0.8 m时,由于液面与释气头距离较近,释气头出水对液柱产生较大的扰动,影响微气泡对微藻细胞的黏附和提升效果;当液位高度超过1.2 m时,由于静压增大,气泡的流速降低[22],气泡在上升过程中受到挤压和撞击破碎的机会增多,采收效果亦不理想。
在本试验条件下,藻液流量小于300 L/h时,由于流速低,气泡在气液接触柱内的滞留时间延长而容易破碎,因此气浮采收效率比较低;当藻液流量超过500 L/h时,由于气液比降低,单位时间内向藻液中输送的气量减少,气泡密度降低,致使气浮效率下降。在本试验条件下,当藻液流量一定时,随着溶气压力的增加,一方面气体溶解度提高,单位液体中溶气量增加[23];另一方面,理论释气量呈线性增加,并且所产生的气泡直径减小[24],因此单位溶气量所释放的气泡个数增多,有利于气浮采收。在本试验条件下,当藻液流量一定时,随着气体流量的增加,藻液中溶入的气量不断增加,析出的微气泡增多,金藻的采收效率不断提高;但是当气体流量超过120 L/h时,溶气量有达到饱和的趋势,单位液体的溶气总量不仅不会增加,未溶解的气体还会对析出的气泡产生一定的扰动,造成气泡破碎,从而降低金藻的采收效率。
不同藻液浓度和微藻种类的采收结果显示,小球藻Ⅱ的采收率高于小球藻Ⅰ,表明微藻浓度越高越有利于气浮采收;另外,与金藻相比,小球藻更有利于气浮采收,这可能是由于金藻细胞形状不规则,其与气泡黏附时容易造成气泡破碎,从而影响气浮分离效果。
4 结论
1)微藻的采收效果与微藻液位高度、藻液流量、溶气压力或气体流量等因素有关,其中微藻液位高度对微藻采收效果的影响最显著;2)微藻液位高度、藻液流量和溶气压力分别为1.2 m、400 L/h和0.6 MPa时,小球藻的采收效果最好;微藻液位高度、藻液流量和气体流量分别为1.2 m、400 L/h和120 L/h时,金藻的采收效果最好;3)微藻的气浮效果与藻液浓度和微藻种类有关,藻液浓度愈高,愈有利于气浮采收,小球藻的气浮采收优于金藻;在本试验条件下,小球藻Ⅰ、小球藻Ⅱ和金藻的最大采收率分别为60.3%、68.1%和65.4%;4)在未改变藻液pH值和未添加絮凝剂的条件下,利用回流式、连续加压气浮技术对微藻进行采收,采收效率明显高于传统气浮采收。
参考文献:
[1] 孙灵毅,王力勇,赵强.3种微藻兼养培养及营养成分的比较[J].大连水产学院学报,2004,19(2):146-149.
[2] Pauline S,Claire JS,Elie D,et al.Commercial applications ofmicroalgae[J].JBiosci Bioeng,2006,101(2):87-96.
[3] Stephens E,Ross L L,Mussgnug JH,etal.Future prospects ofmicroalgal biofule production system[J].Trends in Plant Science, 2010,15(10):554-564.
[4] Beer L L,Boyd E S,Peters JW,et al.Engineering algae for biohydrogen and biofuel production[J].CurrentOption in Biotechnology,2009,20:264-271.
[5] Uduman N,Qi Y,Danquah M.Dewatering ofmicroalgal cultures:A major bottleneck to algae-based fuels[J].JRenewable and Sustainable Energy,2010(2):1-15.
[6] 林喆,匡亚莉,郭进,等.微藻采收技术的进展与展望[J].过程工程学报,2009,9(6):1242-1247.
[7] Grima EM,Belarbi E H,Acién Fernández FG,et al.Recovery of microalgal biomassandmetabolites:processoptionsand economics [J].Biotechnology Advances,2003,20(7/8):491-515.
[8] El Diwani G I,El Rafei SA,Hawash S I,etal.Optimized flocculation ofmicroalgae for fuel oil and antioxidant production[J].Der Chemica Sinica,2011,2(4):12-25.
[9] Salim S,Bosma R,VermuëM H,et al.Harvesting ofmicro-algae by bio-flocculation[J].Journal of Applied Phycology,2011,23 (5):849-855.
[10] Bosma R,Van Spronsen W A,Tramper J,etal.Ultrasound,a new separation technique to harvestmicroalgae[J].Journal of Applied Phycology,2003,15:143-153.
[11] 周玮,王国栋,蔡学新,等.用中空纤维超滤技术浓缩单细胞藻类的试验[J].大连水产学院学报,2008,23(4):296-299.
[12] Fukushi K,Tambo N.A kinetic model for dissolve an flotation in water and wastewater treatment[J].Water Sciences and Technology,1995,31(3-4):37-47.
[13] 牟晨晓,李俐俐,李秀辰,等.加压溶气气浮技术用于净化养殖水体的研究[J].水产科学,2008,27(4):167-170.
[14] Csordas A,Wang J K.An integrated photobioreactor and foam fractionation unit for the growth and harvest ofChaetocersspp.In open systems[J].Aquaculture Engineering,2004,30:15-30.
[15] 郑必胜,张圈权,蔡妙颜,等.利用气浮法采收小球藻的生物量[J].海湖盐与化工,1999,28(6):8-11.
[16] Wiley PE,Brenneman K J,Jacobson A E.Improved algal harvesting using suspended air flotation[J].Water Environment Research,2009,81(7):702-708.
[17] 曾文炉,李浩然,丛威,等.微藻细胞的气浮法采收[J].海洋通报,2003,27(5):507-511.
[18] 崔景芹,郑毅,丛威,等.溶气气浮法采收盐藻细胞[J].过程工程学报,2003,3(2):151-155.
[19] 高莉丽,刘天中,张维,等.小球藻的絮凝沉降及溶气气浮采收研究[J].海洋科学,2010,34(12):46-51.
[20] 高莉丽,江怀真,刘天中.紫球藻溶气气浮法采收条件研究[J].中国海洋大学学报,2010,40(11):62-66.
[21] Harith Z T,Yusoff F M,Mohamed M S,et al.Effect of different flocculation on the flocculation performance ofmicroalgae,Chaetoceroscalcitrans,cells[J].African Journal of Biotechnology,2009,8 (21):5971-5978.
[22] Week N C,TimmonsM B,Chens S.Feasibility ofusing foam fractionation for the removal of dissoved and suspended solids from fish culture water[J].Aquaculture Engneering,1992,11(4):251-265.
[23] Lekang O.Aquaculture Engneering[M].UK:Blackwell Publishing Ltd,2007:97-120.
[24] 王立新,欧阳藩.泡载分离器的研究[J].化学工程,1993,21 (5):70-73.
Performance of dissolved air flotation for marinem icroalgae harvesting
LIXiu-chen,MU Chen-xiao,MU Gang,LIFeng
(R&D Center of Fisheries Equipment and Engineering of Liaoning Province,Dalian Ocean University,Dalian 116023,China)
Harvesting experiments ofChlorococcumsp.andDicrateriazhanjiannsiswere carried out using recycled and dissolved air flotation.Effects of the height and flow rate of algae liquid,the dissolving pressure and flow rate of air on harvesting efficiency ofmicroalgae were studied by single and multi-parameter experimental approaches. Results show that the harvesting efficiency ofChlorococcumsp.andDicrateriazhanjiannsisare influenced significantly by the height of algae liquid.Relatively higher harvesting efficiency were obtained when the height and flow rate of algae liquid,the dissolving pressure or flow rate of airwere kept at1.2 m,400 L/h,0.6 MPa or120 L/h, respectively.Maximum harvesting efficiency forChlorococcumsp.Ⅰ,Chlorococcumsp.Ⅱ andDicrateriazhanjiannsiswere found as 60.3%,68.1%and 65.4%,respectively.Without changing in pH and adding any flocculent to the algae liquid,the harvesting efficiency ofmarinemicroalgae is clearly higher by the recycled and dissolved air flotation than that of traditional foam flotation
marinemicroalgae;harvesting;dissolved air flotation;recycle
S985.4
A
2095-1388(2012)04-0355-05
2012-05-03
辽宁省优秀人才计划项目 (LR201120)
李秀辰 (1964-),女,教授。E-mail:lxc@dlou.edu.cn
