紫外诱变选育β-呋喃果糖苷酶高产菌株及培养基优化
2012-08-09马歌丽韩甜甜
马歌丽 韩甜甜
(郑州轻工业学院食品与生物工程学院,河南郑州450002)
β-呋喃果糖苷酶(β-fructofuranosidase,EC3.2.1.26)又称蔗糖酶或转化酶,具有广泛的受体特性。在低浓度的蔗糖溶液中,β-呋喃果糖苷酶主要催化蔗糖水解生成果糖和葡萄糖;在高浓度的蔗糖溶液中,β-呋喃果糖苷酶可催化转糖基作用,在蔗糖的果糖基上通过β-2,1糖苷键连接1~3个果糖而形成低聚果糖;β-呋喃果糖苷酶也能以蔗糖和乳糖为底物,将蔗糖分子中的果糖基优先转移到乳糖分子上,催化合成低聚乳果糖。除此之外,β-呋喃果糖苷酶还能催化合成糖苷类化合物、生产β-寡聚葡萄糖等[1]。
β-呋喃果糖苷酶广泛存在于生物界,主要来源于节杆菌、酵母菌、黑曲霉、米曲霉、日本曲霉等微生物[2-6],但现有菌株产生β-呋喃果糖苷酶的活力普遍较低,因此,选育高产β-呋喃果糖苷酶菌株具有实际意义。本试验对黑曲霉进行紫外诱变,筛选出高产β-呋喃果糖苷酶突变菌株;并采用单因素和响应面分析试验对该突变菌株的发酵培养基进行了优化。
1 材料与方法
1.1 材料
1.1.1 菌种
黑曲霉由郑州轻工业学院生物工程实验室保藏。
1.1.2 培养基
PDA培养基:土豆20%、蔗糖2%、琼脂1.5%~2%。
初筛培养基:土豆20%、蔗糖2%、琼脂1.5%~2%。
种子培养基:蔗糖3%、酵母膏0.5%、KH2PO40.2%、NaNO30.3%、MgSO4·7H2O 0.05%、FeSO4·7H2O 0.001%,pH值自然。
初始发酵培养基:蔗糖5%、蛋白胨0.5%、酵母膏0.5%、KH2PO40.2%、NaNO30.3%、MgSO4·7H2O 0.05%、MnCl2·4H2O 0.03%、FeSO4·7H2O 0.001%,pH 值自然。
1.2 试验方法
1.2.1 紫外诱变
1.2.1.1 黑曲霉孢子悬液的制备
将保存的黑曲霉菌种接种于PDA斜面培养基上,30℃培养,待孢子成熟时,用无菌生理盐水洗掉孢子,制成孢子浓度为106~107个/ml的孢子悬液。
1.2.1.2 紫外诱变处理
取制备好的孢子悬液5 ml于直径9 cm的平皿中,将平皿置于距离30 W紫外灯30 cm的升降台上,进行不同时间的照射处理。对每个处理样品进行梯度稀释,取每个稀释度的样品0.2 ml涂布于初筛固体平板上,30℃培养。以未经紫外线照射的孢子悬液作对照。
1.2.2 诱变菌株的筛选
将诱变处理的菌株30℃培养48 h,观察菌落的形态并进行菌落计数,计算诱变致死率。以致死率在70%~85%的照射量为参考,挑取筛选平板上长势旺盛的菌落转接到PDA斜面培养基上,30℃培养48 h后接种到液体种子培养基中,于30℃、200 r/min摇床培养48 h,再以3%的接种量接种到初始发酵培养基中,于30℃、200 r/min摇床培养72 h,测定发酵液的酶活。
1.2.3 稳定性试验
将筛选得到的高产β-呋喃果糖苷酶突变菌株在斜面上进行传代培养,连续传5代,对每一代菌种进行摇瓶发酵培养,测定发酵液的酶活,检测突变株的遗传稳定性。
1.2.4 发酵培养基的优化
单因素试验:以初始发酵培养基为基础,分别改变培养基的碳源和氮源,以3%的接种量,在30℃、200 r/min摇床培养72 h,测定发酵液的酶活;再以最佳碳源和氮源为培养基的基本成分,在培养基中分别加入不同种类的金属离子,以未加金属离子的培养基为对照,测定发酵液的酶活。
响应面分析优化培养基:以发酵培养基中对黑曲霉产β-呋喃果糖苷酶活力影响较大的3个因素为自变量,β-呋喃果糖苷酶活力为响应值,采用响应面分析法优化摇瓶发酵培养基配方。
1.2.5 酶活测定
酶活定义:在35℃、pH值5.0的条件下,以每分钟催化10%的蔗糖产生1 μmol葡萄糖所需的酶量为1个β-呋喃果糖苷酶活力单位(U),用U/ml表示。
酶活测定原理:DNS(3,5-二硝基水杨酸)与还原糖共热后被还原成棕红色的3-氨基-5-硝基水杨酸,在波长540 nm处3-氨基-5-硝基水杨酸有较强的光吸收。在一定浓度范围内,反应液的吸光度值与还原糖的量成正比,即反应液的吸光度值与β-呋喃果糖苷酶的活力成正比。
酶活测定步骤:发酵液经真空抽滤后得上清液,即为粗酶液。将粗酶液进行适当稀释。取0.5 ml 10%蔗糖溶液(用pH值5.0的磷酸盐-柠檬酸缓冲液配制)和0.5 ml粗酶稀释液,于35℃水浴中反应20 min,沸水浴中10 min,冷却后加1 ml DNS溶液,混匀,沸水浴3 min,加8 ml蒸馏水,混匀。以蒸馏水作为空白对照。测定反应液在540 nm处的吸光度值,由OD540nm从标准曲线上得到还原糖的浓度,进而计算出样品的酶活。酶活计算公式:

式中:m——还原糖浓度(mg/ml);
180 ——葡萄糖相对分子质量;
t——反应时间(min);
v——酶液量(ml);
n——稀释倍数。
1.2.6 生物量测定
发酵培养液经真空抽滤,菌体和滤纸一起置于70℃干燥箱烘干至恒重,总重与滤纸之差为菌体干重,由此计算得到单位体积培养液的菌体干重。
2 结果与讨论
2.1 紫外诱变选育高产菌株
2.1.1 致死率曲线
对黑曲霉孢子悬液进行不同时间的紫外照射处理,经固体培养基平板培养,紫外诱变的致死率曲线如图1所示。
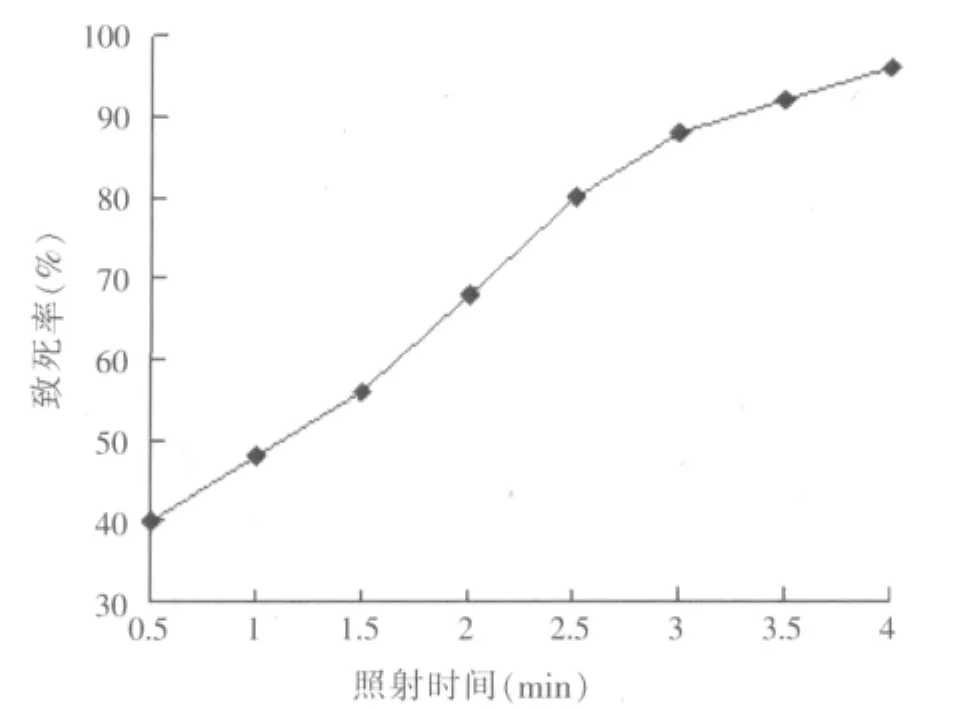
图1 紫外照射黑曲霉孢子致死率曲线
从图1可知,随着紫外照射时间的延长,黑曲霉孢子的致死率逐渐增大。当紫外照射时间小于2 min时,黑曲霉孢子的致死率小于70%;当紫外照射时间大于3 min时,黑曲霉孢子的致死率大于85%。工业育种时一般以致死率在70%~85%的照射剂量为诱变育种的参考量。因此,本试验确定紫外照射时间为2.5 min。
2.1.2 高产诱变株的筛选及稳定性检验
挑选经紫外照射2.5 min平板上生长良好,形态较大的菌落转接至斜面培养基,最终选取20株接种到摇瓶发酵培养基上进行培养,测定发酵液的酶活,结果见表1。
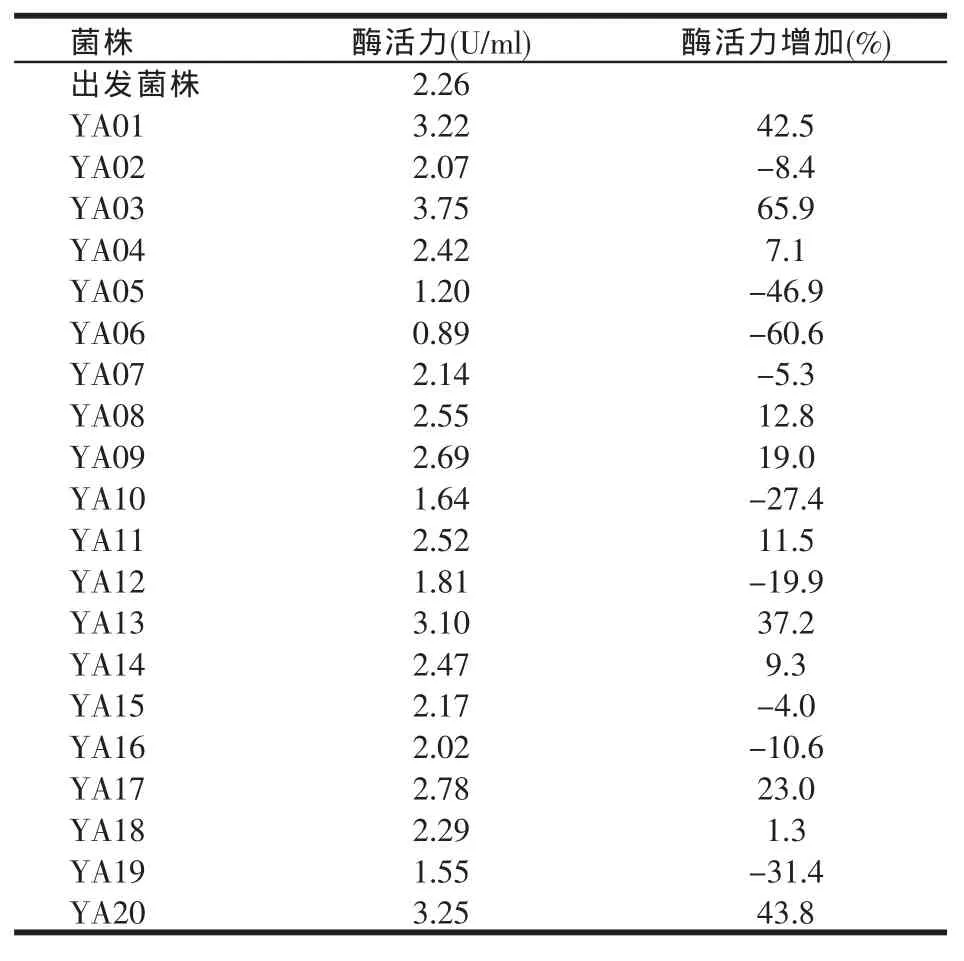
表1 紫外照射2.5 min菌株的产酶活力
由表1可知,经紫外照射2.5 min后,20株菌中有11株菌的产β-呋喃果糖苷酶活力得到提高,9株菌的产酶活力下降,其中突变株YA03的酶活力提高最多,其产酶活力为3.75 U/ml,是出发菌株的1.66倍。
将黑曲霉突变株YA03连续5次传代培养,其发酵液产酶活力如表2所示。

表2 黑曲霉突变株YA03稳定性试验
由表2可以看出,黑曲霉突变株YA03经5代培养后其产β-呋喃果糖苷酶活力变化不大,表明突变株YA03具有良好的遗传稳定性,为有效突变菌株,可以作为进一步的试验菌株。
2.2 发酵培养基的优化
2.2.1 碳源对黑曲霉YA03产酶的影响
在初始发酵培养基中分别用5%的不同碳源代替蔗糖作为唯一碳源,碳源种类对黑曲霉YA03产β-呋喃果糖苷酶酶活力和生物量的影响结果见表3。
由表3可知,黑曲霉YA03产β-呋喃果糖苷酶活性和生物量受碳源的影响均比较显著。以蔗糖、葡萄糖和果糖为唯一碳源的培养基均有利于微生物生长;以蔗糖为唯一碳源时,黑曲霉YA03产β-呋喃果糖苷酶的活力最高,为3.98 U/ml。因为β-呋喃果糖苷酶是一种诱导酶,底物蔗糖可同时作为果糖基的供体和受体,所以蔗糖的存在对β-呋喃果糖苷酶的产生具有诱导作用。由此可以确定蔗糖仍为最佳碳源。
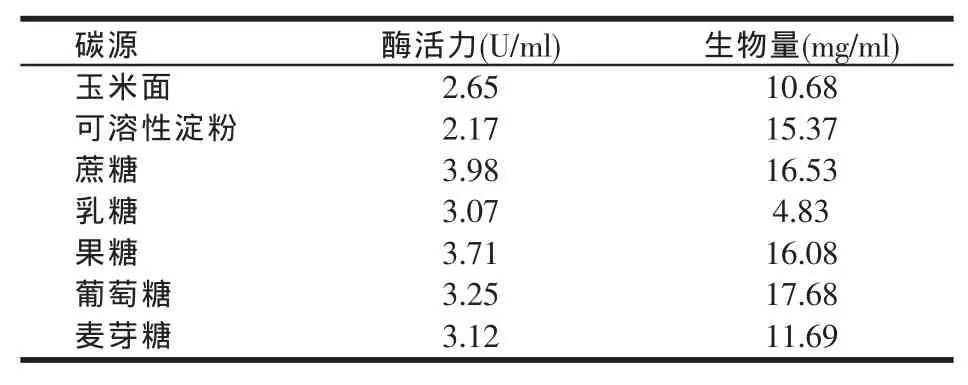
表3 碳源种类对黑曲霉YA03产酶活力和生物量的影响
2.2.2 碳源浓度对黑曲霉YA03产酶的影响
以蔗糖为唯一碳源,改变培养基中的蔗糖浓度,经发酵培养后,测定发酵液的酶活及生物量,蔗糖浓度对黑曲霉YA03产β-呋喃果糖苷酶酶活力和生物量的影响结果见图2。
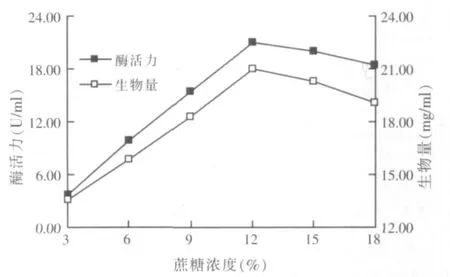
图2 蔗糖浓度对黑曲霉YA03产酶活力和生物量的影响
由图2可见,随着蔗糖浓度的增加,黑曲霉YA03产β-呋喃果糖苷酶的活性和生物量均呈现先上升后缓慢降低趋势。当蔗糖浓度为12%时酶活力达到最大,为21.08 U/ml,此时黑曲霉YA03生物量也达到最大值,为20.98mg/ml。所以,试验确定蔗糖浓度为12%。
2.2.3 氮源对黑曲霉YA03产酶的影响
以12%蔗糖为碳源,在初始发酵培养基中分别用0.5%的不同氮源代替酵母膏作为唯一氮源,氮源对黑曲霉YA03产β-呋喃果糖苷酶的影响结果见表4。
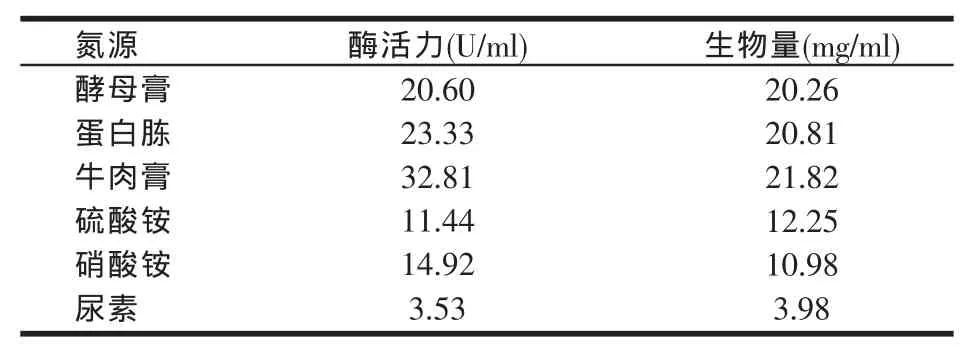
表4 氮源种类对黑曲霉YA03产酶活力和生物量的影响
从表4可知,用酵母膏等有机氮源比硫酸铵等无机氮源更有利于微生物产酶,其原因是有机氮源的营养成分比无机氮源丰富,更有利于微生物细胞的生长和代谢产物的合成。牛肉膏为黑曲霉YA03产生β-呋喃果糖苷酶的最佳氮源,酶活最大值为32.81 U/ml,生物量为21.82mg/ml,而尿素对微生物的生长和β-呋喃果糖苷酶的活性具有明显的抑制作用。所以,试验确定牛肉膏为最佳氮源。
2.2.4 氮源浓度对黑曲霉YA03产酶的影响
以12%蔗糖为碳源、牛肉膏为氮源,改变培养基中的牛肉膏浓度,经发酵培养后,测定发酵液的酶活及生物量,牛肉膏浓度对黑曲霉YA03产β-呋喃果糖苷酶和生物量的影响结果见图3。

图3 牛肉膏浓度对黑曲霉YA03产酶活力和生物量的影响
由图3可以看出,牛肉膏浓度为0.6%时,黑曲霉YA03产β-呋喃果糖苷酶活性最大,为33.19 U/ml;牛肉膏浓度为0.9%时,黑曲霉YA03生物量达到最大,为24.17mg/ml,但此时β-呋喃果糖苷酶活力较低。所以确定牛肉膏浓度为0.6%。
2.2.5 金属离子对黑曲霉YA03产酶的影响
以12%蔗糖和0.6%牛肉膏为培养基的基本成分,在培养基中分别加入0.05%的不同金属离子,以未加金属离子的培养基为对照,测定金属离子对黑曲霉YA03产β-呋喃果糖苷酶活力和生物量的影响,结果见表5。

表5 不同金属离子对黑曲霉YA03产酶活力和生物量的影响
由表5 可知,K+、Na+、Zn2+、Ca2+、Cu2+对黑曲霉YA03产β-呋喃果糖苷酶的活性均有抑制作用,其中Ca2+的抑制作用最强烈;而 Mg2+、Fe2+、Mn2+对黑曲霉YA03产β-呋喃果糖苷酶有不同程度的促进作用,以添加Mn2+酶活性最高,酶活为71.93 U/ml。
在单独添加一种金属离子的基础上又做了同时添加金属离子试验,即在培养基中同时添加0.05%的Mg2+、Fe2+、Mn2+3 种金属离子,试验结果表明,黑曲霉YA03产β-呋喃果糖苷酶活力可达84.52 U/ml,比单一添加一种金属离子的酶活力要高。所以,试验确定在培养基中同时添加 MnCl2·4H2O、MgSO4·7H2O 和FeSO4·7H2O,以提高黑曲霉YA03产β-呋喃果糖苷酶的能力。
2.2.6 响应面法优化培养基[7]
在单因素试验基础上,以影响β-呋喃果糖苷酶活力较大的3个因素即蔗糖、牛肉膏、MnCl2·4H2O浓度为自变量,以β-呋喃果糖苷酶活力为响应值,培养基中其它成分为 MgSO4·7H2O 0.05%和 FeSO4·7H2O 0.05%。根据Box-Benhnken中心组合设计原理,设计3因素3水平共15个试验点的响应面分析试验,其因素水平设计见表6,试验方案及结果见表7。

表6 响应面试验因素与水平设计

表7 响应面分析法试验设计及试验结果
利用Design Expert 7.0软件对表7数据进行二次回归响应面分析,得到酶活力对实际自变量的多元二次回归方程:
Y=-0.726 67+9.412 33A+114.880 56B+178.533 33C-0.781 67AB+1.290 00AC+29.500 00BC-0.386 72A2-103.476 85B2-757.166 67C2,各因素的方差分析见表8。
回归方程方差分析表明,该模型极显著(P=0.002 6<0.01),蔗糖、牛肉膏及其二次项对β-呋喃果糖苷酶活力影响极显著(P<0.01),MnCl2·4H2O 对 β-呋喃果糖苷酶活力有一定影响(P<0.05)。模型的相关系数R2=0.970 5,校正系数R2Adj=0.917 4,且失拟项不显著,说明该模型与实际情况拟合较好,因此可以用该回归方程代替真试验点对试验结果进行分析和预测。
运用Design Expert 7.0软件绘制出三维响应曲面图及对应的等高线图(见图4~图6),并预测最佳蔗糖浓度为11.86%、牛肉膏浓度为0.53%、MnCl2·4H2O浓度为0.14%,最大β-呋喃果糖苷酶活力为97.90 U/ml。
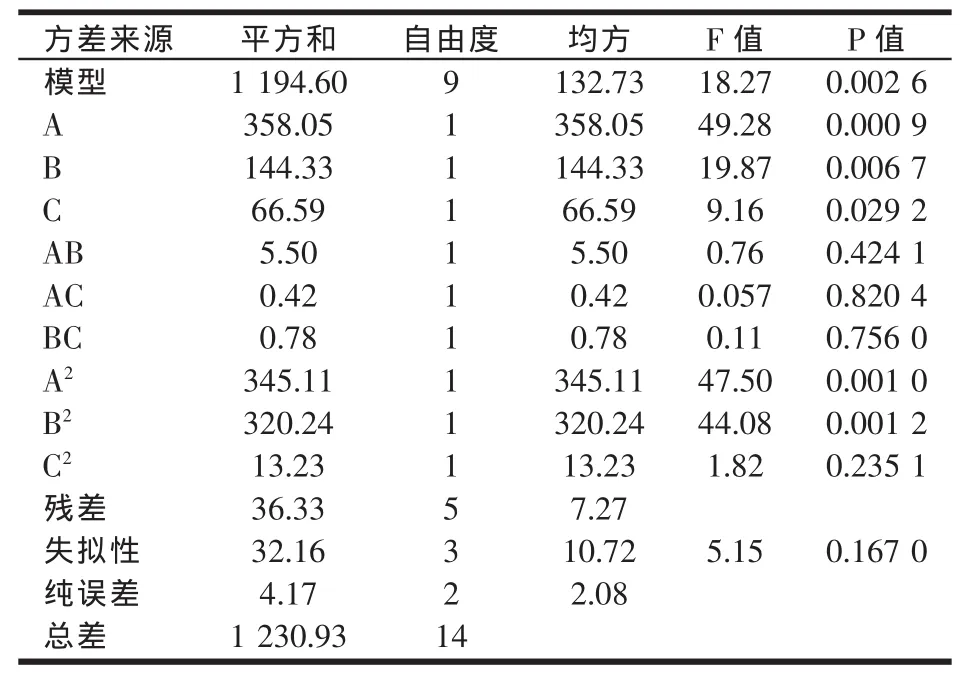
表8 回归模型的方差分析
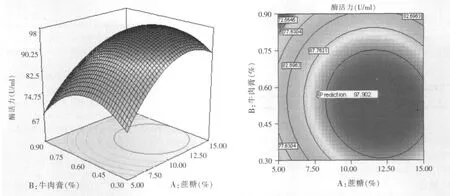
图4 蔗糖和牛肉膏对酶活力影响的三维响应面图和等高线图(MnCl2·4H2O 0.14%)

图5 蔗糖和MnCl2·4H2O对酶活力影响的三维响应面图和等高线图(牛肉膏0.53%)
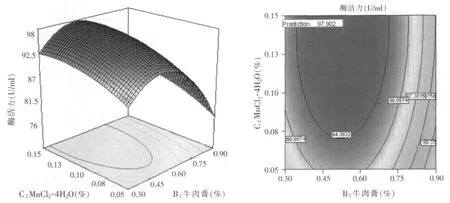
图6 牛肉膏和MnCl2·4H2O对酶活力影响的三维响应面图和等高线图(蔗糖11.86%)
2.2.7 验证试验
为了证实响应面分析预测的结果,用以上得到的最优培养基配方重复试验3次,结果见表9。

表9 验证试验结果
由表9可知,β-呋喃果糖苷酶活力的试验值与预测值最大相差3.99%,且3次试验平均值与预测值接近,表明预测值与试验值有较好的拟合性,进一步证实了该模型的有效性。
3 结论
通过对黑曲霉出发菌株进行紫外诱变,紫外照射时间为2.5 min时,筛选得到一株高产β-呋喃果糖苷酶活力的突变株YA03,其产酶活力为3.75 U/ml,是出发菌株酶活的1.66倍;经5次传代培养,该突变株生长旺盛、遗传稳定性良好。通过单因素和响应面法确定该突变株产β-呋喃果糖苷酶的最佳培养基为蔗糖 11.86%、牛肉膏 0.53%、MnCl2·4H2O 0.14%、MgSO4·7H2O 0.05%和FeSO4·7H2O 0.05%。突变菌株YA03在此最优培养基中发酵产β-呋喃果糖苷酶活力达96.58 U/ml,是优化前产酶活力的25.7倍。
[1]朱桂兰,周衍茂.微生物源β-呋喃果糖苷酶及其在功能性低聚糖工业中的应用[J].合肥师范学院学报,2009,7(6):100-102.
[2]Fujita K,Hara K,Hashimoto H,et al.Some Properties of β-Fructofuranosidase from Arthrobacter sp.K-1 and Its Application[J].Denpun Kagaku,1993,40(2):95-101.
[3]Yun J W.Fructooligosaccharides-occurrence,preparation and application[J].Enzyme Microbial Technology,1996,19:107-117.
[4]马歌丽,张学军,靳丽.黑曲霉产β-呋喃果糖苷酶酶学性质研究[J].中国酿造,2009(6):22-24.
[5]覃益民,唐江涛,苏加坤.米曲霉GX0011 β-果糖基转移酶的性质研究[J].食品工业科技,2007,28(5):123-126.
[6]赵秀红,李长彪,刘长江,等.产β-呋喃果糖苷酶菌株的筛选及发酵条件初探[J].食品工业科技,2006,27(6):90-92.
[7]代志凯,张翠,阮征.试验设计和优化及其在发酵培养基优化中的应用[J].微生物学通报,2010,37(6):894-903.
