在猪组织笼内恩诺沙星对大肠杆菌的药效研究
2012-08-08杨雨辉俞观泉
杨雨辉,俞观泉,吴 昊
(1.海南大学农学院,海口 570311;2.海南省热带动物繁育与疫病研究重点实验室,海口 570228)
使用体内建立药动学模型方法评价抗菌药物对病原菌药效,可使研究结果更接近客观实际。已有研究者使用动物感染模型分析抗菌药物对某些人源性病原菌的疗效,并以此为依据获得一些评价抗菌药物临床疗效的新观点[1-2]。在兽医临床上,Ramadan等使用绿脓杆菌感染鸡的疾病模型进行PK-PD的研究,并获得一些PK-PD参数[3],但是这些研究大部分都不能准确获得抗菌药物在感染部位的浓度和细菌的生长曲线[4]。因此需要更好的体内模型来进行抗菌药物体内药效研究。
根据Bengtsson和Creko的研究,使用组织笼模型进行体内PK-PD研究可解决以上问题,在研究中将药物直接注射到组织笼中,以克服其他给药途径下组织笼内药物浓度变化缓慢的缺点,组织笼也可以直接注射病原菌,进行组织笼内病原菌数量变化的的研究。利用该模型研究抗菌药物体内PK-PD关系是较理想的一种方法[5-6]。本研究利用在猪体内安装组织笼的方法,探讨恩诺沙星在组织笼内对大肠杆菌的药效。
1 材料与方法
1.1 材料
1.1.1 实验动物及菌种
18头健康的商品杂交猪(杜洛克×海南猪),体重(59.7±6.3)kg。按常规饲养,自由饮水和采食,饲料为不含抗菌药物的全价日粮。试验前适应2周。大肠杆菌2081(44103)为购自中国兽医药品监察所的标准菌株。
1.1.2 药品及培养基
盐酸恩诺沙星为浙江国邦药业有限公司生产;恩诺沙星标准品由中国兽药监察所提供;乙腈为美国TEDIA公司产品;四丁基溴化铵均为上海晶纯试剂有限公司产品;普通营养琼脂为广东环凯微生物科技有限公司产品。
1.2 方法
1.2.1 组织笼的准备及安装
组织笼的准备,选取直径为2.5和3 cm的不锈钢半球和钢管,首先将钢质半球用2 mm的钻头均匀钻孔,钻时注意保持钻孔间距为3 mm左右,同时将直径为2.5 cm的钢管截成长度为3.5 cm的小段,直径为3 cm的钢管截成长度为4 cm的小段,并将直径相同的钢管与钻孔的半球焊接,腔内预先放置4~5粒直径为3 mm的玻璃珠,打磨表面使其光滑,两种笼的容积分别约为25和42 mL左右,见图1。试验前将钢质组织笼洗净、包扎、灭菌并烘干备用。

图1 组织笼Fig.1 Tissue cages
组织笼的安装,选择试验用健康猪,以普鲁卡因(5 g·L-1)在猪的耳后颈部两侧进行局部浸润麻醉后,分别于两侧皮肤以无菌手术分别切开皮肤至冈上肌,形成4~5 cm的小口,钝性分离,使冈上肌和颈斜方肌之间形成小腔,分别植入一大一小两个组织笼并缝合切口。术后连续3 d每公斤体重注射青霉素钠4万单位,链霉素每公斤体重15 mg,每天两次,防止伤口感染。1周后拆线。2周时以无菌注射器抽空组织笼内组织碎片。5周后手术部位基本恢复正常。
1.2.2 试验设计与采样
MIC的测定,采用双倍试管稀释法测定恩诺沙星对大肠杆菌的MIC。为了与组织笼内细菌的数量一致,本试验测定MIC时加入的细菌量大约是5×107cfu·mL-1。
体内PK-PD同步试验的设计,18头实验猪,分为三组,每组6头,每头具有4个组织笼,颈部两侧分别具有一大一小两个组织笼。试验前24 h将对数生长期的大肠杆菌稀释10-2后,小笼取1 mL,大笼取1.5 mL(菌液的浓度大约为5×105cfu·mL-1)注射进入组织笼,制作一个感染模型,待细菌在组织笼内孵育24 h后,开始进行试验,此时即为体内PD-PK模型的0时。于试验0时按照组织笼终浓度为2MIC,5MIC和8MIC,既组织笼药物内药物终浓度为0.8、2.0、3.2 μg·mL-1的剂量向组织笼注入50 mg·mL-1的恩诺沙星溶液,颈部的一侧作为对照笼,不注射药液。分别于试验后0、0.25、0.5、1、3、6、9、12、24、48 h采取组织笼液1 mL,其中0.5 mL进行细菌数量的测定,0.5 mL进行药物浓度的测定。
1.2.3 体内抗菌活性的测定
通过平板菌落计数确定组织笼液中活菌数的变化。
1.2.4 药物浓度的测定
采用高效液相色谱对药物浓度进行测定[16]。
1.2.5 数据处理
使用Winnolin软件进行数据的计算,并获得药动学参数。
药效数据中的细菌生长对时间的曲线下面积(AUBKC)计算根据两个邻近样品点所围成的梯形面积之和进行计算。
2 结果与分析
2.1 猪组织笼制作结果
颈部已成功安装组织笼的猪如图2所示。安装完成后伤口愈合完好,可抽出淡黄色清亮的组织液,说明该猪可用于试验研究。

图2 颈部安装组织笼的猪Fig.2 Swines assembled the tissue cages
2.2 恩诺沙星在猪组织笼内的药动学特征及药动-药效参数
在此试验条件下,恩诺沙星对大肠杆菌的MIC为0.4 μg·mL-1。恩诺沙星在大、小组织笼内的药动学特征符合一室模型的药动学特征,药动学参数及药动-药效参数参数见表1。
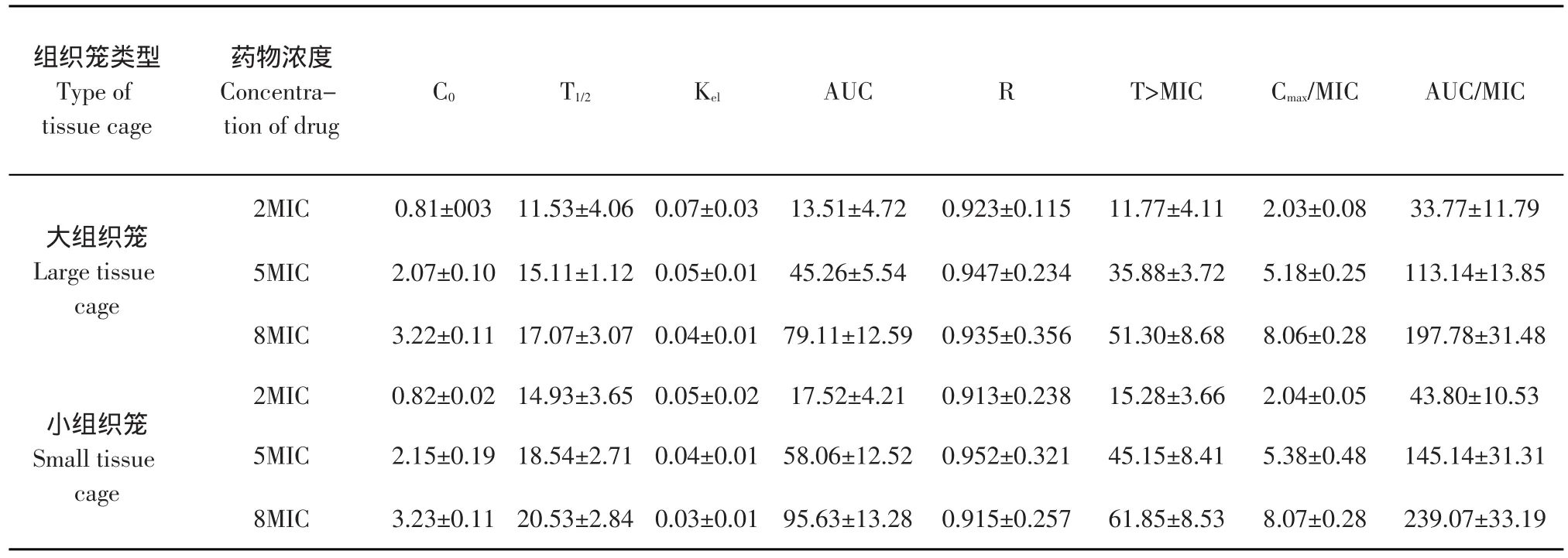
表1 恩诺沙星在猪不同大小组织笼内的药动学参数及药动-药效参数(X±S,n=6)Table 1 Pharmacokinetic parameters and PK-PD parameters of enrofloxacin in the tissue cage of swine(X±S,n=6)
结果表明注射相同的药物浓度后,药物在小组织笼内的半衰期明显大于在大组织笼内的半衰期,差异显著(P<0.05),在相同大小的组织笼内随着药物浓度的增加半衰期表现为增长。
2.3 恩诺沙星对猪组织笼内细菌的杀菌动力学曲线
恩诺沙星在大组织笼内对大肠杆菌的杀菌动力学曲线见图3,在大组织笼内,无药对照笼内的细菌在试验的过程中细菌的数量基本上保持恒定,大组织笼内注入2MIC的恩诺沙星后,细菌在被抑制9 h后,出现再生长现象,大组织笼内注入5MIC或8MIC的恩诺沙星后,细菌的杀菌曲线几乎重合,并都在24 h后检测不到组织笼内细菌的存在。细菌在接触药物的早期阶段下降最为迅速。
恩诺沙星在小组织笼内对大肠杆菌的杀菌动力学曲线见图4。在小组织笼内,无药对照笼内的细菌在试验的过程中细菌的数量也基本上保持恒定,小组织笼内注入2MIC的恩诺沙星后,细菌在被抑制12 h后,出现再生长现象,小组织笼内注入5MIC或8MIC的恩诺沙星后,细菌的杀菌曲线几乎重合,小笼注入5MIC的药物浓度后,笼内在24 h后检测不到细菌的存在,而注入8MIC药物浓度的小笼,在注药12 h后,组织笼内就不再能够检测到大肠杆菌的存在。小笼内细菌在接触药物的早期阶段也表现为迅速下降。
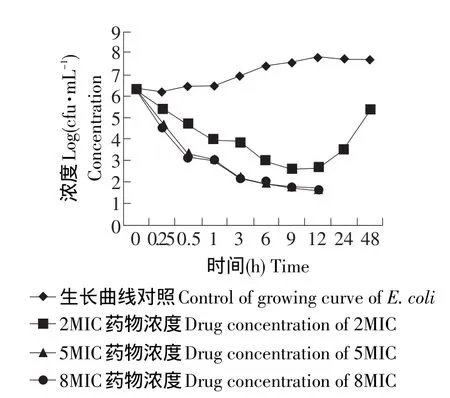
图3 不同浓度恩诺沙星在大组织笼内的杀菌动力学曲线Fig.3 Killing bacteria curve of different concentration enrofloxacin in the big tissue cage
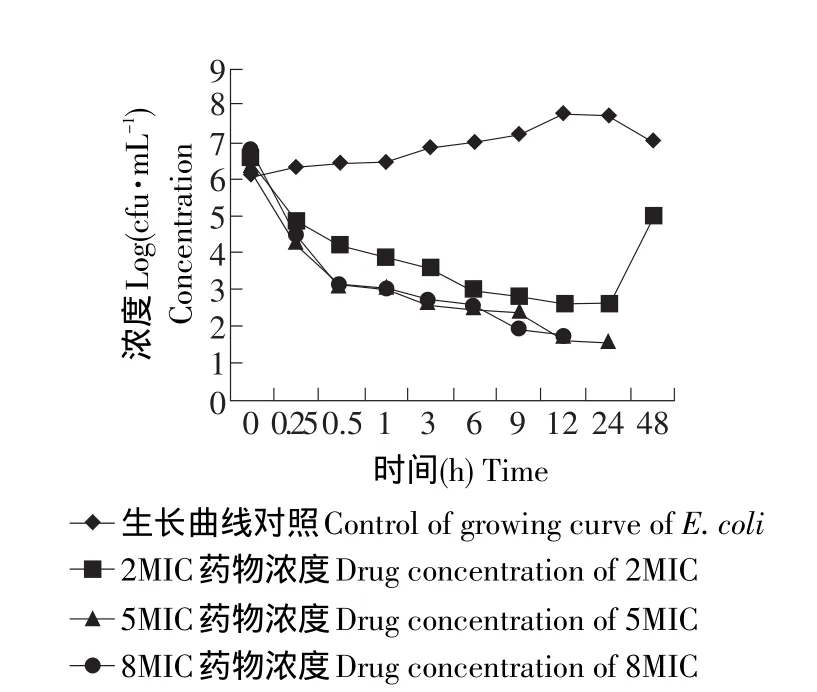
图4 不同浓度恩诺沙星在小组织笼内的杀菌动力学曲线Fig.4 Killing bacteria curve of different concentration enrofloxacin in the small tissue cage
2.4 组织笼内细菌暴露于不同浓度药物后3 h内活菌数减少值
组织笼内细菌暴露于不同浓度药物后3 h内活菌数减少的对数值见表2。
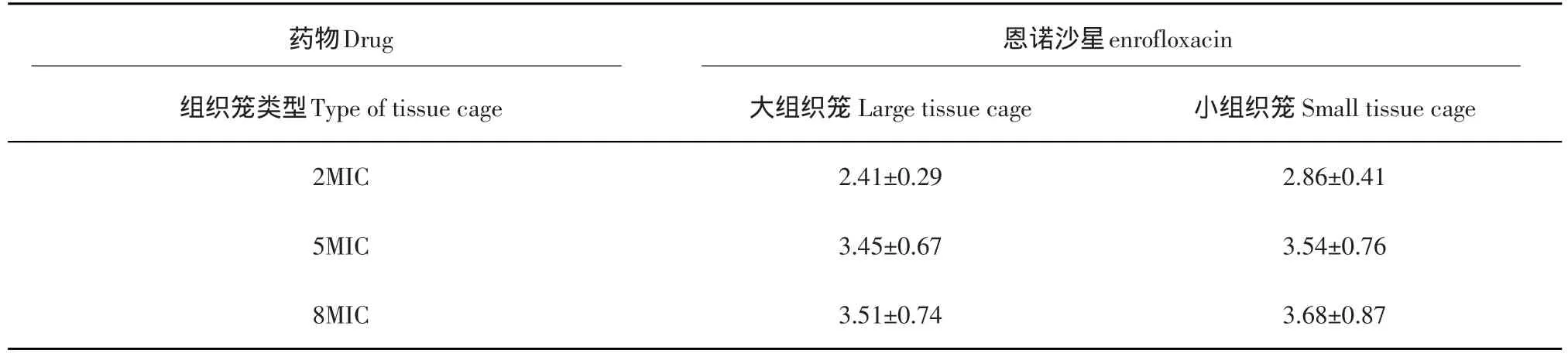
表2 注射恩诺沙星后在组织笼内3h内活菌数减少值(logcfu·mL-1,X±S,n=6)Table 2 Decreasing value of the valid bacteria in 3 hours after injecting enrofloxacin(logcfu·mL-1,X±S,n=6)
在大小组织笼注入不同浓度恩诺沙星,在接触细菌3小时内杀灭大肠杆菌的程度比较表明,2MIC与其他各浓度在3 h内菌数减少的lg值之间差异显著(P<0.05)。从5MIC到8MIC浓度在3 h内菌数减少的lg值之间差异不显著(P>0.05)。
2.5 组织笼内杀菌动力学曲线下面积(Area under the bacterial kill curve,AUBKC)
不同药物不同浓度在组织笼内杀菌曲线下面积的结果见表3。对于恩诺沙星,随着抗菌药物的浓度增加,表现为杀菌曲线下面积减少。
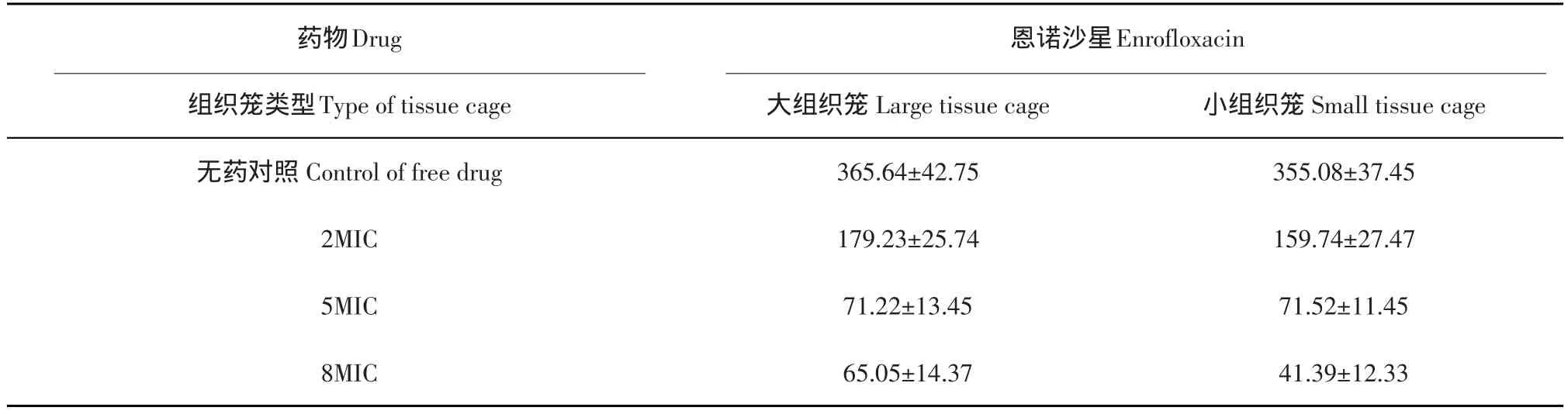
表3 不同浓度恩诺沙星在组织笼内杀菌曲线下面积(X±S,n=6)Table 3 Area under the bacterial kill curve of different concentration enrofloxacin in tissue cage(X±S,n=6)
3 讨论与结论
3.1 试验设计
对于使用组织笼研究抗菌药物的疗效研究,多采用动物一侧给药而另一侧作为对照的方法进行试验[6]。在本研究中,采用此试验设计,主要是从给药的剂量和方式来考虑。两个组织笼容积共有67 mL,猪体重60 kg,组织笼容积相对于猪的体积可以忽略。以组织笼的大小为依据计算给药剂量,药量少,由于采用直接向组织笼内注药,药物半衰期相对很长。因此,在试验期间进入血液药量较少,而进入另一个组织笼的药量更少,故可以忽略用药量对对照组织笼内细菌产生的影响,因此本研究采用的试验设计可达到研究目的。
3.2 注射药物进入组织笼的药动学特征
本研究直接向组织笼内注药,没有药物吸收过程,此种给药方式与静注给药的药动过程相仿,因此在进行药物代谢动力学数据的计算时,采用一室静注给药模型进行药物代谢动力学模拟计算。计算结果表明所有模拟的相关系数R都在0.9以上,说明静注一室模型可较好地模拟组织笼注射药物后药动学特征。
使用组织笼研究抗菌药物的抗菌效果发现,动物给药后,组织笼内的药物浓度上升和下降速度非常缓慢[7-12],为了克服肌肉注射后,组织笼内药物浓度上升和消除缓慢这一缺点,本研究采用直接向组织笼内注射药物方式进行给药,结果表明,此方法可以克服肌肉注射给药后药物在组织笼内浓度较低和半衰期较长缺点,使得恩诺沙星在组织笼的半衰期较肌肉注射给药后药物在组织笼内的半衰期降低了近一半[13],且可以通过控制注射药物剂量控制组织笼内药物浓度,是目前研究抗菌药物在动物体内PK-PD同步关系较为理想的方法。
在本研究中药物在小组织笼内的半衰期明显大于在大组织笼内的半衰期,差异显著(P<0.05),在相同大小的组织笼内随着药物浓度的增加半衰期表现为增长。据报道药物在牛组织笼内的半衰期随着药物的不同和组织笼大小也存在着差异,在相同大小的组织笼内,随着药物浓度的增加,药物的半衰期增加,这与本研究的结果相同,但对于笼的大小与半衰期关系的结果却与本研究相反[5-6]。根据分析这主要是由于本研究中使用的组织笼大小和形状设计与Greko对组织笼的大小和形状设计不同导致的。在Greko的研究中,使用的大小组织笼只是长短上有差异,笼端面积,即笼内液体与笼外组织接触面积是相同的,所以结果表现为药物在大笼(长组织笼)内半衰期长,而在小笼(短组织笼)内半衰期短。本研究使用的大小组织笼直径不同,长短差异较小,故药物在小组织笼内半衰期长,而在大组织笼内半衰期短的特点。
制作感染笼并直接向组织笼中注入药物,可以确切了解局部感染用药后的治疗效果,如果已经明确某药物在该局部的药动学特征,就可以通过改变组织笼的大小和形状,控制药物在组织笼内的半衰期,使其与该局部的药动学特征相符。使用此研究方法,对研究动物用药后某部位的具体疗效具有指导作用。
3.3 药物对猪组织笼内细菌的杀菌动力学曲线
由组织笼内细菌暴露于不同浓度药物后3 h内活菌数减少值可见,在动物组织笼内恩诺沙星的药效与药物浓度有关,药效呈随浓度增加而增加趋势,此规律在体外模型的研究中已有报道[16],说明在猪体内恩诺沙星的杀菌规律与体外结果一致。由于体内条件下还涉及到宿主的免疫因素,因此体内试验更接近客观事实。
在以前的报道中,认为峰浓度和AUC是氟喹诺酮类药物发挥抗菌作用的关键因素,且氟喹诺酮类药物的peak/MIC比率对于临床疗效和减少耐药性是最重要参数[14-16]。本研究中,大组织笼内注入2MIC的恩诺沙星后,细菌在被抑制9 h后,出现再生长现象,大组织笼内注入5MIC或8MIC的恩诺沙星后,细菌的杀菌曲线几乎重合,这说明5MIC和8MIC的杀菌强度相同,并都在24 h后检测不到组织笼内细菌。而在小组织笼内注入2MIC的恩诺沙星后,细菌在被抑制 12 h后,出现再生长现象,小笼注入5MIC的药物浓度后,笼内在24 h后检测不到细菌,而注入8MIC药物浓度的小笼,在注药12 h后,组织笼内就检测不到大肠杆菌。由以上结果表明,当药物浓度较低时,细菌可出现再生长现象,半衰期决定了药物出现再生长的时间,半衰期长的出现再生长的时间较晚。当浓度较高时细菌可被完全杀灭,但完全杀灭的时间也与半衰期有关,相同的药物浓度,半衰期长的杀灭细菌的速度快。此结果在体外药动药效同步模型研究中被发现[17],Blaser等在使用体外模型研究依诺沙星对几种细菌的体外药效时,也观察到细菌的再生长现象,在所有的peak/MIC比率中,只有peak/MIC>8,才能避免细菌在模型内的再生长[18]。本试验中peak/MIC>5,组织笼内的细菌就不会出现再生长现象。这说明,如果药物在体内消除慢,可以适当减少抗菌药物的用量。恩诺沙星对大肠杆菌的药效与浓度有直接关系,如药物在感染部位的半衰期长,用药量可适当减少。
[1] Vogelman B,Gudmundsson S,Leggett J,et al.Correlation of antimicrobial pharmacokinetic parameters with therapeutic efficacy in an animal model[J].J Infect Dis,1988,158(4):831-847.
[2] Legget J E,Ebert S,Fantin B,et al.Comparative dose-effect relations ant several dosing intervals for betalactam,aninoglycoside and quinolone antibiotics against gram-negative bacilli in murine thigh-infection and pneumonitis models[J].Scand J of Infect Dis.1990,74(Suppl.):179-184.
[3] Ramadan A,Afifina,Osman K M,et al.Pharmacokinetics and pharmacodynamics of gentamicin in experimentally pseudomonas aeruginosa-infected Chickens[C]//.Proceedings of 6th international Congress.Boston:Blackwell Scientific Publications,1994:61-62.
[4] Wright D H,Brown G H,Peterson M L,et al.Application of fluoroquinlone pharmacodynamics[J].J Antimicrob Chemoth,2000,46(5):669-683.
[5] Bengtsson B,Greko C.Simulation of concentration-time profiles of benzyl-penicillin,enrofloxacin and dihydrostreptomycin in tissue cages in calves[J].J vet Pharmacol.Therap,2002,25(5):389-392.
[6] Greko C,Finn M,Ohagen P,et al.A tissue cage model in calves for studies on pharmacokinetic/pharmacodynamic interactions of antimicrobials[J].Int J Antimicrob Ag,2003,22(4):429-438.
[7] Kaye D,Parsons J N,Carrizosa,et al.Treatment of experimentalStaphylococcus aureusabscesses:Comparison of cefazolin,cephalothin,cefoxitin,and cefamandole[J].Antimicrob Agents Ch,1979,15(2):200-203.
[8] Roos K,Brorson J E,Holm S E.Studiesin vivoon the killing rate and refractory period of penicillin V in an experimental streptococcal infection[J].J Antimicrob Chemoth,1985,15(5):587-595.
[9] Readle R E,Short C R,Corstvet R E,et al.Characteriztion of a soft tissue infection model in the horse and its response to intravenous cephapirin administration[J].J Vet Pharmacol Ther,1989,12(1):73-86.
[10] Clark C R,Short C R,Corstvet R E,et al.Effect ofPasteurellahaemolytica infection on the distribution of sulfadiazine and trimethoprim into tissue chambers implanted subcutaneously in cattle[J].Am J Vet Res,1989,50(9):1551-1565.
[11] Cagni A,Chuard C,Vaudaux P E,et al.Comparison of sparfloxacin,temafloxacin and ciprofloxacin for prophylaxis and treatment experimental foreign body infection by methicillin resistantStaphylococcus aureus[J].Antimicrob Agents Ch,1995,39(8):1655-1660.
[12] Xuan D,Zhong M,Mattoes H,et al.Streptococcuspneumoniae reponse to repeated moxifloxacin or levofloxacin exposure in a rabbit tissue cage model[J].Antimicrob Agents Ch,2001,45(3):794-799.
[13] 杨雨辉,李笑春,韩新畴,等.恩诺沙星在猪血清和组织液中对大肠杆菌的半体内药动-药效同步模型的研究[J].畜牧兽医学报,2011,42(1):92-98.
[14] Chambers S T,Peddie B A,Begg E J,et al.Antimicrobial effects of lomefloxacinin vitro[J].J Antimicrob Chemoth,1991,27(4):481-489.
[15] Drusano G L,Johnson D E,Rosen M,et al.Pharmacodynamics of a fluoroquinolone antimicrobial agent in a neutropenic rat model of pseudomonas sepsis[J].Antimicrob Agents Ch,1993,37(3):483-490.
[16] Marchbanks C R,Mckiel J R,Gilbert,et al.Dose ranging and fractionation of intravenous ciprofloxacin againstPseudomonas aeruginosaandStaphylococcus aureusin anin vitromodel of infection[J].Antimicrob Agents Ch,1993,37(9):1756-1763.
[17] 杨雨辉,丁焕中,杨东,等.体外药动学模型中恩诺沙星对猪大肠杆菌的药效研究[J].中国兽医科学,2007,37(7):636-640.
[18] Blaser J,Stone B B,Groner M C,et al.Comparative study with enoxacin and netilmicin in apharmacodynamic modelto determine importance of ratio of antibiotic peak concentration to MIC for bactericidal activity and emergency of resistance[J].Antimicrob Agents Ch,1987,31(7):1054-1060.
