犬γ干扰素多克隆抗体的制备及生物活性检测
2012-08-08李一经唐丽杰葛俊伟乔薪瑗姜艳平
李一经,吴 昱,唐丽杰,葛俊伟,乔薪瑗,崔 文,姜艳平
(东北农业大学动物医学学院,哈尔滨 150030)
IFN-γ为II型干扰素或免疫干扰素,主要由活化T淋巴细胞和NK细胞产生,是一种具有广谱抗病毒、抗肿瘤和免疫调节功能的分泌性蛋白,相对于IFN-α和IFN-β,IFN-γ相关研究较少。Hiummler等率先开始犬IFN-α基因的研究[1],随后Devos等克隆了犬IFN-γ基因[2],夏春、汪明等也克隆过德国牧羊犬和拉布拉多犬IFN-α基因序列[3]。2002年杨琪等克隆了犬IFN-γ cDNA并在鼠骨髓瘤细胞(SP20)中进行了表达[4]。IFN-γ具有抑制病毒复制、抑制细胞分裂以及免疫调节作用[5]。主要表现在:①促进MHCI类及II类抗原的加工提呈,提升CD4+T细胞的肽特异性活性[6-7]。②介导T细胞对巨噬细胞的激活,增强巨噬细胞杀伤微生物的能力。③活化NK细胞,提高NK细胞的杀伤活性,同时活化的NK细胞也能分泌IFN-γ。④促进NO的合成,是IFN-γ杀伤胞内病原体、抗肿瘤以及抑制病毒复制的分子机制之一[8]。
本研究构建了含有CaIFN-γ基因原核表达载体,并实现高效表达;进一步对复性后的包涵体进行干扰素抗病毒活性检测;并将切胶纯化后的包涵体免疫家兔,制备兔抗犬IFN-γ的多克隆抗血清,为开发新型基因工程苗、新型免疫佐剂及免疫治疗剂奠定基础。
1 材料与方法
1.1 材料
大肠杆菌DH5α,E.coliRosetta,MDCK细胞,原核表达载体pET30a由东北农业大学预防兽医学微生物教研室保存,重组pJLA605-CaIFN-γ质粒由东北农业大学预防兽医学微生物教研室构建并经序列鉴定;水疱性口炎病毒(Vesicular stomatitis virus,VSV)为哈尔滨兽医研究所惠赠;IPTG(购自TaKaRa公司);弗氏完全佐剂和弗氏不完全佐剂(购自Sigma公司);限制性内切酶SalI、EcoR I及DNA Marker、T4DNA ligase、Taq酶(购自宝生物工程(大连)有限责任公司);小量质粒DNA提取试剂盒与小量胶回收试剂盒均购自中科瑞泰生物有限公司;MTT购自Fluka公司,其他试剂均为国产分析纯。实验动物为2月龄家兔(购自哈尔滨兽医研究所实验动物中心)。
1.2 方法
1.2.1 引物设计合成
根据2005年张海峰[9]发表的CaIFN-γ基因序列设计引物用于重组载体的构建。P1:5'AGATCTTTCTTTAAAGAAATTG 3',P2:5'GTCGA CTCACTATTTACTTGCTCTA 3'。
1.2.2 CaIFN-γ原核表达载体的构建及工程菌的诱导表达
pJLA605-CaIFNγ质粒和pET30a载体经EcoR I、SalI双酶切,通过琼脂糖凝胶电泳得到的酶切产物在T4DNA连接酶作用下16℃连接过夜,转化到DH5a感受态中,挑菌落过夜培养后提取质粒,双酶切与PCR鉴定[10]。阳性重组质粒命名为pET30a-caIFNγ。将阳性质粒热转到E.coliRosetta感受态中,挑阳性克隆菌于含卡那霉素(30 μg·mL-1)的LB培养液,37℃过夜振荡培养后,将菌液按1:50接种于含有卡那霉素的 100 mL锥形瓶中,37℃培养至OD600约为0.4,加入IPTG至终浓度为2 mmol·L-1,继续诱导培养并每小时取样。
1.2.3 表达产物的SDS-PAGE分析和Western-blot鉴定
将IPTG诱导前和诱导后每小时的1 mL菌液12 000 r·min-1离心1 min,弃上清,加入50 μL PBS和等量2 x SDS(含DTT),煮沸10 min,取10 μL经15%SDS-PAGE分析。将表达量最大的诱导菌液的上清和沉淀分别处理,确定蛋白表达形式。用半干转印仪经50 mA、40 min转印到硝酸纤维素(NC)膜上,再将NC膜在PBS配制的5%脱脂乳中封闭2 h,以1:1 000稀释的his单抗室温作用2 h,DAB显色。
1.2.4 目的蛋白的复性
诱导的菌液,通过尿素梯度法进行包涵体粗提,采用切胶纯化反复冻融的方法得到包涵体[11],分5次加入到pH为8.0,0.5 mmol·L-1精氨酸复性液中,使蛋白终浓度为0.15 mg·mL-1,4℃作用24 h,然后将复性液放入透析袋中,浸入pH 7.2,0.15 mmol·L-1PBS中充分透析,用PEG6000浓缩至1/10体积,然后以0.22 μm的滤膜进行过滤除菌,用于细胞检测蛋白的生物活性[12]。
1.2.5 抗病毒活性检测
在96孔板上长满单层的MDCK细胞中,加入以培养基进行2倍倍比稀释的重组干扰素复性蛋白作用24 h(蛋白初始浓度为1.5 mg·mL-1,每个梯度做4个平行孔,共8个梯度),弃液,加入100 TCID50的VSV作用24~30 h,同时做细胞和病毒对照组,当细胞病毒组80%~90%病变时,进行结晶紫染色。通过细胞病变抑制法对重组干扰素抗病毒活性进行分析[12]。
1.2.6 多克隆抗血清的制备
取切胶纯化浓度为2 mg·mL-1的重组蛋白1 mL加入1 mL弗氏完全佐剂,充分乳化后,颈部背部皮下多点注射2月龄家兔。首免后14和28 d分别用纯化蛋白1 mL加入弗氏不完全佐剂,进行加强免疫,于末次免疫后10 d,采血并分离血清。用间接ELISA方法测定抗体水平[13]。
2 结果与分析
2.1 重组表达质粒的鉴定
重组质粒pET30a-caIFNγ经EcoR I、SalI单、双酶切和PCR鉴定。0.8%琼脂糖凝胶电泳显示,双酶切和PCR检测的插入片段长约440 bp,与预期结果相符。表明成功将编码CaIFN-γ成熟蛋白的基因正确插入到原核表达载体的目的位点(见图1)。
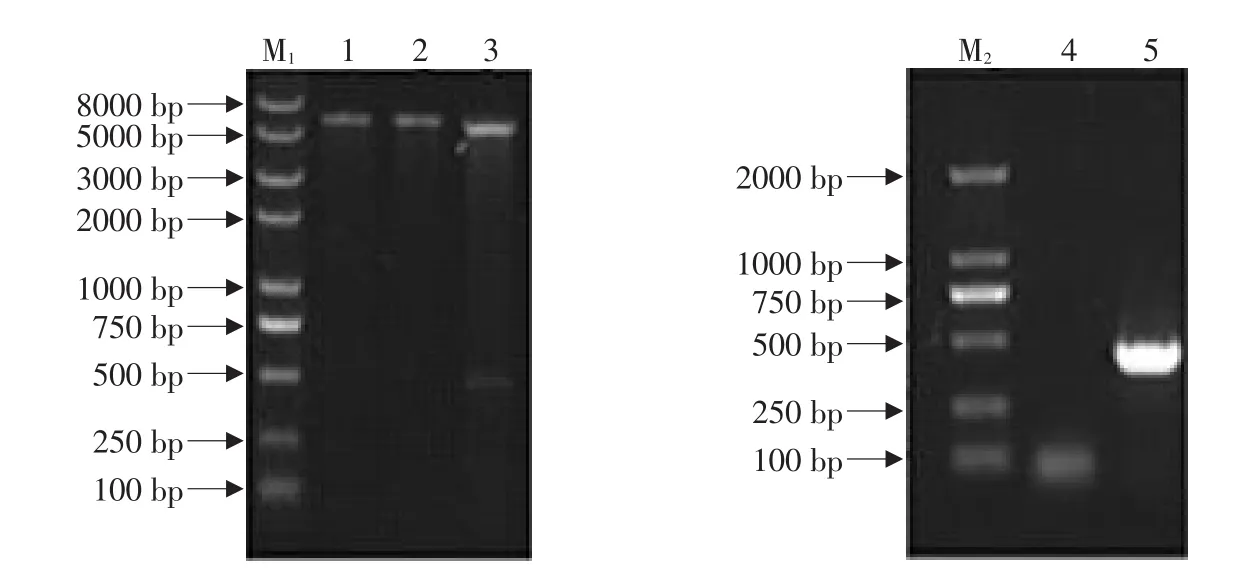
图1 重组质粒pET30a-caIFNγ的酶切和PCR鉴定Fig.1 Enzyme digestion and PCR identification of recombinant plasmid of pET30a-caIFNγ
2.2 融合蛋白的表达、鉴定
15%SDS-PAGE分析表明,与诱导前比较,每小时诱导样品均有一条明显的蛋白带,该蛋白的相对分子质量约为23 ku,并且在诱导后5 h重组蛋白表达量达到最大,重组蛋白约占菌体总蛋白含量的63%。见图2。
将第5 h诱导的菌体沉淀进行超声处理,分别进行上清和沉淀的SDS-PAGE分析表明,蛋白主要以包涵体的形式存在,见图3。Western Blot检测可见重组蛋白与抗His标签的单抗发生特异性反应,结果表明重组的犬γ干扰素蛋白在大肠杆菌中获得了表达。见图4。
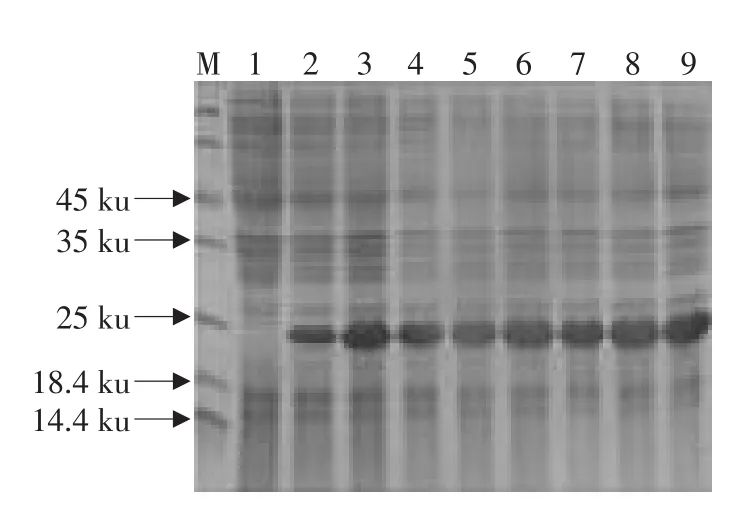
图2 重组菌pET30a-CaIFN-γ/Rosetta不同时间的蛋白表达Fig.2 Expression of recombinant strains pET30a-CaIFN-γ/Rosetta in different Time
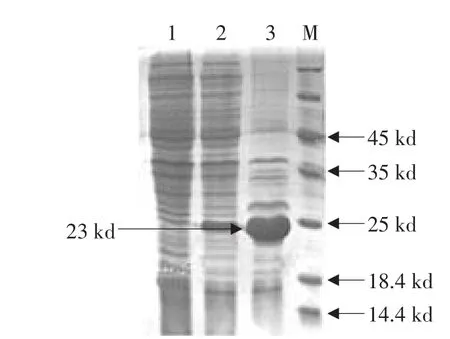
图3 重组蛋白CaIFN-γ的表达形式分析Fig.3 Expression of the inclusion body of recombinant protein CaIFN-γ
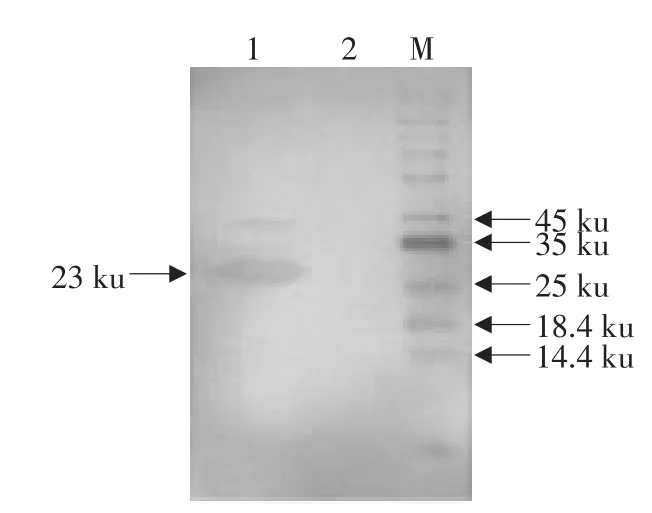
图4 重组蛋白CaIFN-γ的Western-blot分析Fig.4 Western blot analysis of recombinant protein CaIFN-γ
2.3 重组蛋白CaIFN-γ的纯化与复性
结果见图5。
由图5可知,经尿素梯度法粗提的包涵体,进行切胶反复冻融之后浓缩平衡得到纯度较高的目的蛋白。复性后,在约23 ku处有条清晰的重组CaIFN-γ目的蛋白带。
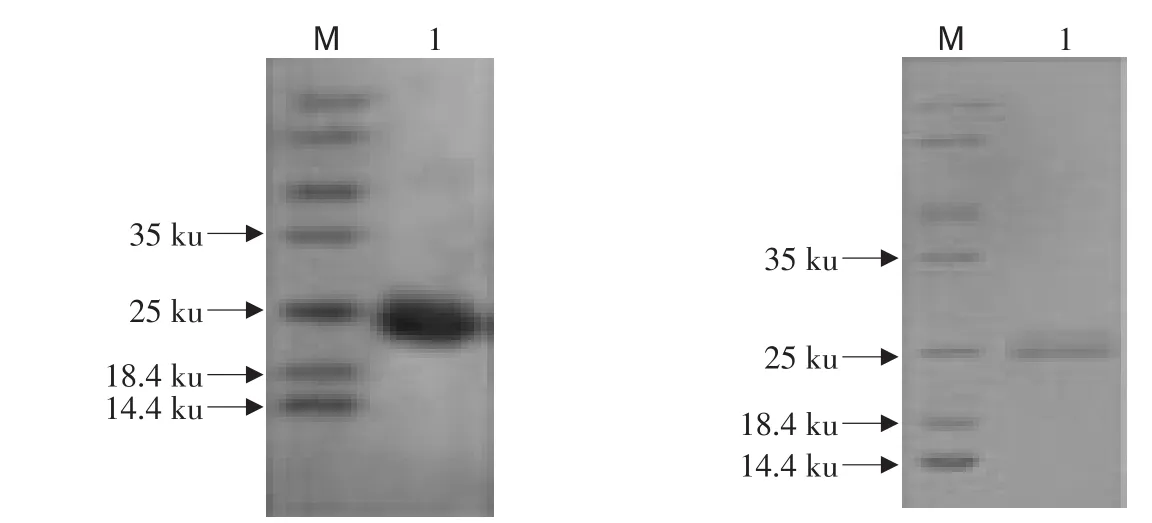
图5 重组CaIFN-γ蛋白的切胶纯化和复性后的SDS-PAGE分析Fig.5 SDS-PAGE analysis of recombinant protein CaIFN-γ by gel isolation and renaturation
2.4 重组CaIFN-γ蛋白复性后活性检测
2倍倍比稀释的重组CaIFN-γ蛋白作用于MDCK细胞,在2-4稀释度(蛋白终浓度为0.09 mg·mL-1)于24 h之内对接种VSV病毒的MDCK细胞有完全保护作用,见图6。超过24 h后有不同程度的细胞病变产生。通过细胞病变抑制法结果显示犬γ干扰素的抗病毒比活性为5.71×105U·mg-1。

图6 重组CaIFN-γ对100TCID50VSV增殖24 h后的抑制作用Fig.6 Inhibition effect for the recombinant CaIFN-γ on replication of VSV after 24 h
2.5 多抗血清效价间接ELISA结果
以纯化后浓度为1.25 μg·mL-1的重组蛋白包被ELISA反应板,每孔100 μL,于4℃包被过夜,用1×PBS稀释的5%脱脂乳于室温封闭2 h,将待检血清以2倍倍比稀释后加入反应板室温作用2 h,对照采用未免疫健康兔血清并倍比稀释,二抗1:5 000室温作用2 h,计算结果。最后测定血清效价为1:12 800。
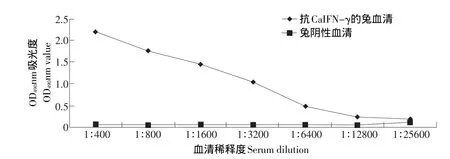
图7 血清抗体效价测定结果Fig.7 Titrations of the antiserum prepared from immunized rabbit by ELISA coated with recombinant protein CaIFN-γ
3 讨论与结论
干扰素因干扰病毒复制而得名,大量研究表明,干扰素除抗病毒外,还具有重要的免疫调节作用[14]。干扰素的抗病毒作用是间接地通过自分泌或旁分泌途径,与细胞膜上的相应受体结合后,活化多条细胞信号传导通路上的蛋白分子来调节细胞的生长、分化,产生抗病毒效应及免疫反应等效应[15]。
本试验用前期获得的犬γ干扰素基因与pET30a原核表达载体成功构建重组质粒,经鉴定正确后,热转于大肠杆菌表达菌Rosetta中进行高效表达。通过对SDS-PAGE的分析表明,诱导5 h后,蛋白表达量达到峰值,同时上清和菌体的分别处理进一步确定蛋白以包涵体表达为主,这与大肠杆菌的结构及强启动子表达系统有关。一定程度上,利于蛋白的纯化,防止被蛋白酶降解。
虽然大肠杆菌表达的γIFN没有糖基化修饰,但研究表明仍具有生物活性[16]。各种动物IFNγ的氨基酸同源性不同,但其基本的空间结构类似。IFN的生物学效应具有高度的种属特异性,即人IFN对动物没有生物学活性,反之亦然[17]。本试验中,将复性后的蛋白进行生物活性检测发现,2-4倍稀释的蛋白在24 h内对细胞有较好的保护作用,但随着时间变化,病毒的繁殖,24 h后会有不同程度的病变。而2-1,2-2,2-3稀释度蛋白有一定的毒性作用,未接种病毒时,对细胞已经造成损伤,这可能与加入目的蛋白浓度过高,大肠杆菌内毒素以及细胞营养成分不充分有关。而2-5,2-6,2-7,2-8会有不同程度的细胞病变,这可能跟目的蛋白稀释后浓度过低,抗病毒作用减弱有关。
与昂贵而繁琐的镍柱纯化相比,本试验采用反复冻融切胶纯化法纯化蛋白,此方法适用于包涵体形式的高表达量蛋白纯化,操作方便,试验周期短,价格低廉,应用范围广。而且采用KCl染色,不影响蛋白抗原性及后续纯化。
本研究获得的具有体外抗病毒活性的重组γ干扰素蛋白和抗γ干扰素蛋白的多克隆抗体,为γ干扰素的深入研究和在生产应用奠定基础。
[1] HimmLer A,Hauptmann R,Adolf G R.Structure and expression inEscherichia coliof canine interferon alpha genes[J].J Interferon Res,1987,7:173-183.
[2] Devos K,Duerinck F,van Audenhove K,et al.Cloning and expression of the canine interferon-gammar gene[J].J Interferon Res,1992(12):95-102.
[3] 夏春,汪明,夏兆飞.拉布拉多犬和德国牧羊犬干扰素alpha基因克隆及测序[J].农业生物技术学报,1999,7(3):245-247.
[4] 杨琪,夏春.犬干扰素γcDNA的克隆及其在鼠骨髓瘤细胞SP20中表达[J].生物工程学报,2002,18(3):365-368.
[5] Billiau A.Interferon-gamma:biology and role in pathogenesis[J].Adv Immunol,1996,63:61-130.
[6] Schroder K,Hertzog P J,Ravasi T,et al.Interferon-gamma:An overview of signals,mechanisms and functions[J].J Leukoc Biol,2004,75(2):163-189.
[7] Decker T,Stockinger S,Karaghiosoff M,et al.IFNs and STATs in innate immunity to microorganisms[J].J Clin Invest,2002,109(10):1271-1277.
[8] 郑拓,吴长德.犬干扰素的研究进展[J].中国兽医杂志,2012,48(1):77-78.
[9] 张海峰,李景荣,唐丽杰,等.重组犬IFN-γ在大肠杆菌中的高效表达[J].农业生物技术学报,2005,13(5):639-643.
[10] Sambrook,Russell D W.Molecular cloning:A laboratory manual[M].3rd Edtion.American:ColdSpringHarborLaboratoryPress,2001:103-105.
[11] 于在江,马学恩,周建华.切胶纯化表达蛋白包涵体的可行性分析[J].生物技术,2007,15(3):559-564.
[12] 陈忠广,张桂红,夏春丽,等.犬干扰素-γ的稀释复性及活力测定[J].东北农业大学学报,2008,39(9):82-86.
[13] 姚火春.兽医微生物学实验指导[M].2版.北京:中国农业出版社,2005:55-56.
[14] Schroder K,Hertzog P J,Ravasi T.Interferon-gamma:an overview of signals mechanisms and functions[J].J Leukoc Biol 2004,75(2):163-189.
[15] Le P C,Genin P,Baines M G,Hiscott J.Interferon activation and innate immunity[J].Rev Immunogenet,2000,2(3):374-386.
[16] 代丽,单安山,孙进华,等.鸡γ-干扰素的可溶性表达及纯化产物的抗NDV活性[J].东北农业大学学报,2011,4(9):37-42.
[17] 杨生海,殷宏.干扰素γ研究进展[J].生物技术通报,2010(8):29-34.
