牛病毒性腹泻病毒基因Ⅱ型HLJ-10分离株全基因组克隆及其序列特征分析
2012-08-07付培芬刘晓玫张海丽商云鹏高明春张文龙王君伟
刘 华,付培芬,李 岩,温 凯,贾 莹,刘晓玫,张海丽,商云鹏,高明春,马 波,张文龙,王君伟
(东北农业大学动物医学院,黑龙江哈尔滨150030)
牛病毒性腹泻/黏膜病(Bovine viral diarrhea/Mucosal disease,BVD/MD)是由 BVD病毒(BVDV)引起的一种呈多临床类型的疾病,主要表现为感染牛粘膜糜烂溃疡、腹泻、免疫抑制,怀孕母牛流产、产死胎、畸形胎以及持续感染等[1-2]。BVDV为黄病毒科瘟病毒属成员,为单股正链RNA,全长约为12 300~12 500个核苷酸(nt),由5'非编码区(5'UTR)、一个大的开放性阅读框(ORF)和3'UTR组成[3]。BVDV存在两个生物型:致细胞病变(CP)型和非致细胞病变(NCP)型。根据5'UTR序列不同分为两个基因型,Ⅰ型和Ⅱ型。BVDV各种基因型和生物型与其致病性之间没有必然的联系[4]。
本研究采用重叠RT-PCR的方法对实验室已分离的BVDV基因Ⅱ型HLJ-10分离株进行全基因组分段克隆及测序,并与GenBank中登录的BVDV全基因组序列进行同源性比较和遗传进化分析,初步阐明了该分离株的基本分子生物学特点以及在系统发生树中所处的位置。为构建BVDV的感染性克隆、探讨其基因功能及致病机理等奠定了基础。
1 材料和方法
1.1 病毒株、菌株与细胞 BVDV基因Ⅱ型HLJ-10分离株为本实验室2010年分离自某国产商品化血清;Escherichia coliTG1为本实验室制备并保存;牛肾传代细胞(MDBK)为本实验保存。
1.2 主要试剂 病毒总RNA提取试剂盒EZNA?Viral RNA Kit购自OMEGA公司;鼠源反转录酶M-MLV购自Promega公司;高保真DNA聚合酶、pEASY-Blunt Simple载体购自北京全式金生物技术有限公司;限制性内切酶购自TaKaRa公司;DNA胶回收试剂盒购自百泰克生物技术有限公司。
1.3 参考病毒株基因序列及登录号 NADL(AJ133738/USA)、Oloss(M96687/Germany) 、Oregon(AF091605/USA)、 Singer(DQ088995/Argetina)、 SD-1(M96751/SD-1)、 VEDEVAC (AJ585412/Hungany)、CP7(U63479/USA)、XJ-04(FJ527854/China)、NewYork'93(AF502399/USA)、SH-28 (HQ258810/China)、 890(U18059/Canada)、 JZ05(GQ888686/China)、 Hokutai(AB567658/Japan)、p11Q(AY149215/Canada)、KZ91CP(AB359933/Japan)和 p24515(AY149216/Canada)。
1.4 引物的设计与PCR扩增 参考GenBank中登录的序列,采用Primer5.0、DNAMAN等生物学软件设计覆盖全基因组的14对引物(如读者需要作者可以提供),均由上海生工生物工程技术服务有限公司合成。
1.5 病毒总RNA的提取 参照病毒RNA提取试剂盒说明书提取病毒的总RNA。
1.6 目的基因扩增与测序 分别以各自的上下游引物进行RT-PCR反应扩增目的片段。将回收的PCR产物与pEASY-Blunt Simple载体连接,筛选阳性重组质粒,由上海生工生物工程技术服务有限公司进行测序。
1.7 生物信息学分析
1.7.1 核酸序列的同源性比较 采用软件Vector NTI Advance 10将分离株各段基因的测序结果拼接成完整的全长基因组序列,与参考病毒株的核苷酸做同源性分析。
1.7.2 基于5'UTR的系统进化分析 采用ClustalX 1.83软件对GenBank中登录的瘟病毒属序列进行比对后,截取5'UTR部分220 bp的核苷酸序列做初步的系统进化分析。应用MEGA4.0.2软件,采用邻接法,设置1 000次bootstrap检测支持度[5-6]。
1.7.3 结构蛋白糖基化位点的分析 应用NetNG-lyc1.0软件预测 BVDV标准株 NADL(Ⅰ型)、New'York93株(Ⅱ型)、加拿大P11Q株(Ⅱ型)、我国分离株HLJ-10、XJ-04株及SH-28株(均为Ⅱ型)结构蛋白的糖基化位点,并进行比较分析。
1.7.4 瘟病毒属E2基因差异性分析 将GenBank中20组瘟病毒属序列的E2基因以正确的ORF翻译为氨基酸后,应用MEGA4.0.2软件对序列进行P-distance 分析[7]。
2 结 果
2.1 目的基因的扩增 利用14对特异性引物,扩增出各个目的片段(图1)。测序结果表明各片段大小分别为 572 bp、479 bp、1 554 bp、512 bp、612 bp、722bp、1634 bp、839 bp、759 bp、1 087 bp、1 566 bp、1 538 bp、1 164 bp、1 298 bp。
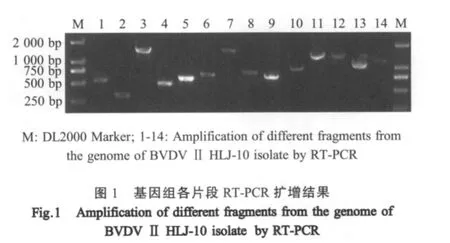
2.2 全序列拼接及同源性比对 将各片段的测序结果拼接成完整的全基因组序列,并录入GenBank(JF714967)。结果显示,HLJ-10分离株全长12 284 nt,5'UTR为385 nt,编码区为11 694 nt,共编码3 897个氨基酸,3'UTR为205 nt(表1)。
将HLJ-10分离株的全基因及各区段的核苷酸序列同参考病毒株进行同源性比较(表2)。非结构蛋白比结构蛋白相对保守,在结构蛋白中,E1和E2基因相对变异较大。非结构蛋白中,NS2/3和NS4A基因相对保守。此外,5'UTR比3'UTR更为保守。
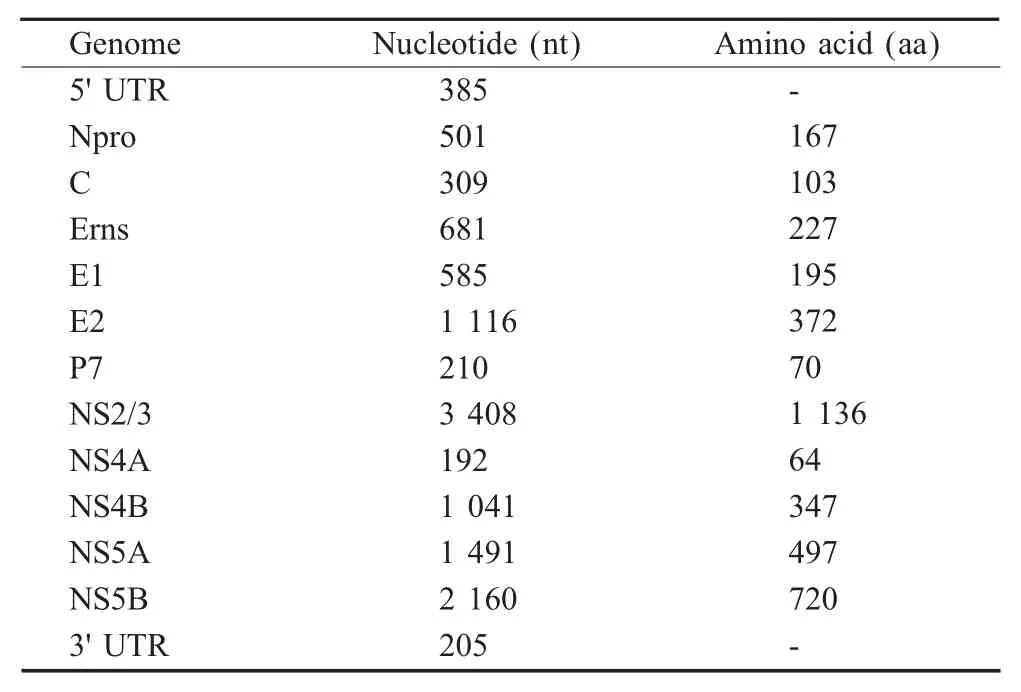
表1 BVDV基因Ⅱ型HLJ-10分离株基因组的组成Table 1 The genomic constitution of HLJ-10 isolate
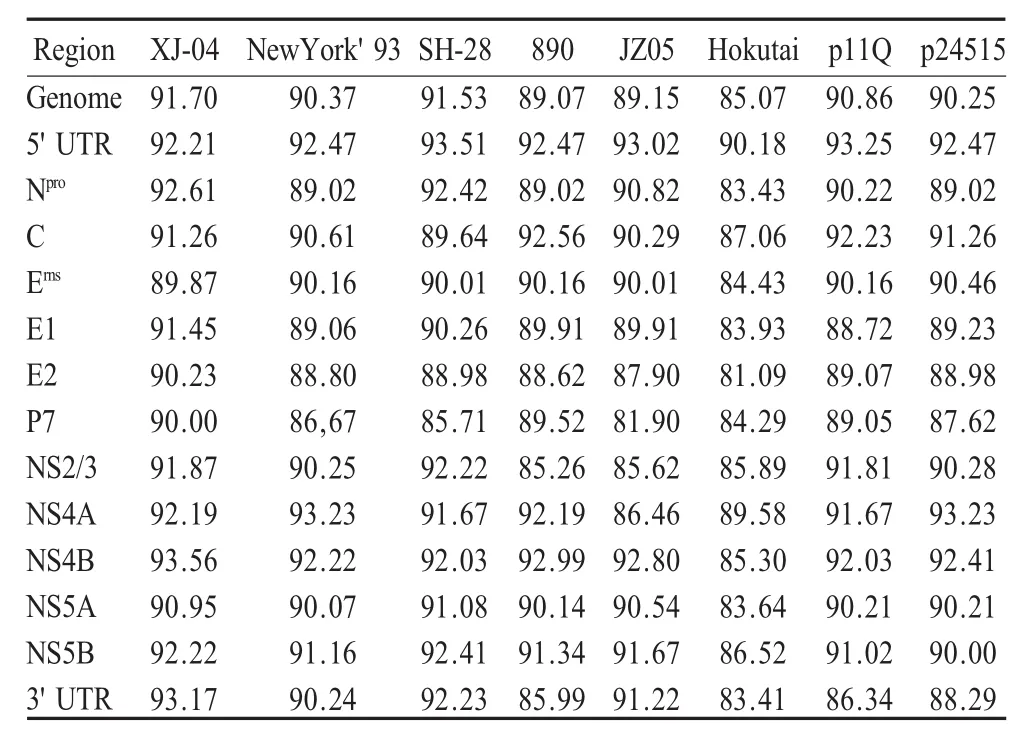
表2 HLJ-10分离株同参考病毒株的核苷酸同源性比较(%)Table 2 Nucleotide sequence comparison of HLJ-10 with other strains in each region(%)
2.3 HLJ-10分离株系统进化树分析 根据该分离株5'UTR部分区域绘制的系统进化树表明,HLJ-10属于BVDV基因Ⅱ型,与SH-28和KZ91CP两株进化关系较为密切,并且该分离株可能属于单一的分支(图2),还有待于进一步分析和研究。
2.4 结构蛋白的糖基化位点分析 HLJ-10分离株ORF编码3 897个氨基酸的单一多聚蛋白,分子量为438.3 ku。分析结果表明,该分离株与BVDV基因Ⅰ型NADL株差异较大。与其它4株BVDV基因Ⅱ型病毒株比对结果表明,点突变主要发生在结构蛋白上(Erns、E1、E2)。有4株BVDVⅡ型病毒株(p11Q株除外,其在非结构蛋白中缺失一个氨基酸)的多聚蛋白均含有22个潜在并且完全一致的N-糖基化位点(特征为Asn-X-Ser或Asn-X-Thr),其中有15个位于结构蛋白上(Erns、E1、E2),并且位置相同。而BVDVⅠ型NADL株在结构蛋白E2上的糖基化位点与其它病毒株不同,在951位氨基酸位置上少了一个糖基化位点,其它24个糖基化位点的位置也不相同(表 3)。
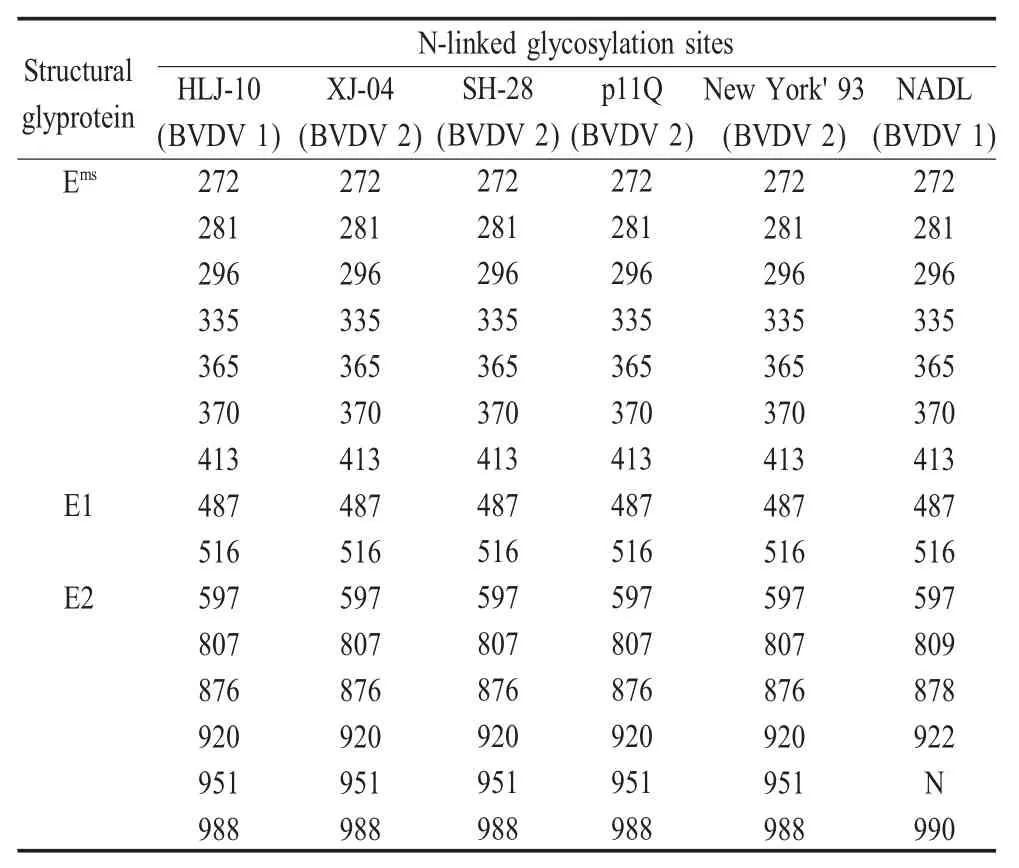
表3 HLJ-10与参考病毒株结构蛋白Erns、E1、E2上潜在的N-糖基化位点分析与比较Table 3 Potential N-linked glycosylation sites of HLJ-10 in structural proteins Erns,E1 and E2 among reference strains

2.5 瘟病毒属E2基因的氨基酸差异性分析 将该分离株E2蛋白与NCBI上已发表的BVDV、CSFV和BDV全基因组序列E2基因进行氨基酸差异性分析。分析表明E2蛋白的氨基酸序列在瘟病毒属中变异性较大,平均P-distance为0.38,最大P-distance为0.63。
3 讨 论
BVDV既是危害养牛业的重要病原之一,又是牛源生物制品(血清、冻精、冷冻胚胎及疫苗等)的污染源[8],给畜牧业生产和相关领域造成严重的经济损失,本研究中的BVDV基因Ⅱ型病毒即分离于商品化血清。造成血清中含有BVDV的原因很多,主要是由于病毒经胎盘感染后导致免疫低下的胎牛成为隐性感染者[9],其次是经常规方法检测BVDV后仍不能排除病毒存在的可能性等。
由于5'UTR在病毒基因组翻译起始部分,并且有稳定的二级结构,在病毒进化过程中很保守[10],因此选择该基因的部分序列进行系统进化分析,研究BVDV系统发生关系。核苷酸和氨基酸的同源性分析显示,HLJ-10与SH-28同源性最高,与进化树分析结果一致。该分离株与SH-28核苷酸同源性为91.53%,氨基酸同源性为95.18%,氨基酸同源性比核苷酸同源性高,这体现了密码子简并性和氨基酸利用的多样性。由于KZ91CP株的全基因序列尚未公布,因此无法做出进一步的同源性比较。
蛋白质的糖基化是蛋白产生抗原性的主要原因,糖基化位点的结构是天冬酰胺(N)-任何氨基酸-丝氨酸(S)或者苏氨酸(T),糖基化位点的位置和个数可能对蛋白的抗原性也有一定的影响。分析表明该分离株与BVDV基因Ⅱ型病毒株在糖基化位点方面并无太大的差异,而与BVDV基因Ⅰ型病毒株差异较大。E2基因是瘟病毒的主要保护性抗原编码基因,在瘟病毒结构蛋白基因中变异较大,代表着病毒株的遗传特性[11]。该蛋白在宿主免疫系统中直接发挥重要作用[12],并且最容易发生突变,通过对E2基因P-distance的分析也显示了这一点。
[1]Brock K V.The persistence of bovine viral diarrhea virus[J].Biologicals,2003,31(2):133-135.
[2]Hamers C,Lecomte C,Kulcsar G.Persistently infected cattle stabilise bovine viral diarrhea virus leading to herd specific strains[J].Vet Microbiol,1998,61:177-182.
[3]Moennig V,Liess B.Pathogenesis of intrauterine infections with bovine viral diarrhea virus[J].Vet Clin North Am Food Anim Pract,1995,11(3):477-487.
[4]Collett M,Larson R,Gold C,et al.Molecular cloning and nucleotide sequence of the pestivirus bovine viral diarrhea virus[J].Virology,1988,165(1):191-199.
[5]Nagai M,Hayashi M,Sugita S,et al.Phylogenetic analysis of bovine viral diarrhea viruses using five different genetic regions[J].Virus Res,2004,99(2):103-113.
[6]Xia Hong-yan,Liu Li-hong,Wahlberg N,et al.Molecular phylogenetic analysis of bovine viral diarrhoea virus:A Bayesian approach[J].Virus Res,2007,130(1-2):53-62.
[7]李岩,聂明非,温凯,等.牛病毒性腹泻病毒NS3基因的序列分析、表达与抗原性鉴定[J].生物工程学报,2010,26(3):311-316.
[8]Paton D J,McGodrick A.Genetic typing of classical swine fever virus[J].Vet Microbiol,2000,73(2-3):137-157.
[9]Moennig V,Liess B.Pathogenesis of intrauterine infections with bovine viral diarrhea virus[J].Vet Clin North Am Food Anim Pract,1995,11:477-487.
[10]Makoschey B.Bovine viral diarrhoea virus antigen in foetal calf serum batches and consequences of such contamination for vaccine production[J].Biologicals,2003,31:203-208.
[11]Rumenapf T,Unger G.Processing of the envelope glycoproteins of pestiviruses[J].J Virol,1993,67(6):3288-3294.
[12]Bolin S R,Ridpath J F.Specificity of neutralizing and precipitating antibodies induced in healthy calves by monovalent modified-live bovine viral diarrhea virus vaccines[J].Am J Vet Res,1989,50(6):817-821.
