鸭甲肝病毒鸡胚化弱毒MY株Vp1重组蛋白的免疫保护效果试验
2012-08-07刘内生
路 娇,罗 薇,刘内生,刘 群
(西南民族大学生命科学与技术学院,四川 成都 610041)
鸭病毒性肝炎是由鸭甲肝病毒(duck hepatitis A virus,DHAV)引起雏鸭的一种以肝脏呈现出血性炎症为特征的急性、高度接触性和致死性传染病。该病呈世界性分布,我国以Ⅰ型鸭病毒性肝炎为主,严重危害了养鸭业的发展。目前我国普遍采用接种鸭肝炎弱毒活疫苗或注射高免卵黄抗体的方式预防该病,虽有效果,但存在病毒株变异、弱毒株返强、免疫安全等问题。因此,开拓疫苗研究的新领域是当前的热点问题。Ⅰ型鸭甲肝病毒(DHAV-1)是小RNA病毒中的一员,其结构蛋白Vp1位于病毒壳体的表面,具有主要的型特异性抗原中和位点,已被证明具有良好的反应原性[1],但其是否具有诱导机体产生中和抗体,使动物获得保护的能力还不得而知。本试验以表达纯化的I型鸭甲肝病毒鸡胚化弱毒MY株Vp1重组蛋白为抗原,制备Vp1重组蛋白亚单位疫苗免疫雏鸭,采用间接ELISA方法对雏鸭的免疫保护效果进行检测,通过动物攻毒试验评价免疫保护效果。
1 材料
1.1 菌毒株 Ⅰ型鸭甲肝病毒鸡胚化弱毒MY株Vp1基因原核表达工程菌(pET32a+Vp1,BL21(DE3)PlysS),由本实验室构建并保存[1];Ⅰ型鸭甲肝病毒鸡胚化弱毒MY株,由西南民族大学动物医学实验室经鸡胚传代致弱[2],TCID50=10-14.62/200 μL;攻毒毒株:西南民族大学动物医学实验室分离并鉴定的自临床分离DHAV-1野毒,LD50=2-4/0.2mL。
1.2 试验动物 购自四川省广汉周边地区DVH抗体阴性的1日龄非免疫雏鸭,本实验室饲养至试验适日龄。健康成年家兔,雄性,体重2~3kg,购自四川省实验动物专委会养殖场。
1.3 血清 DHAV-1阳性血清(中和效价1∶320,批号:011012)、DHAV-1阴性血清,购自中国兽医药品监察所。
2 方法
2.1 Ⅰ型鸭甲肝病毒鸡胚化弱毒MY株Vp1蛋白的原核表达、纯化及浓度测定 将MY株Vp1基因原核表达工程菌按文献[1]的方法进行大量诱导表达,收集菌体,PBS缓冲液悬浮,超声波裂解,离心后收集沉淀和上清,沉淀用适量的PBS重悬。用含1%Triton-100、2mol/L尿素的 PBS反复洗涤,离心收集沉淀,再用含8mol/L尿素的PBS溶解沉淀,离心收集上清,然后进行透析、浓缩,SDS-PAGE电泳观察。BCA蛋白定量试剂盒测定样品中的蛋白浓度。
2.2 兔抗MY株Vp1重组蛋白的多克隆抗体对细胞的中和保护力评价
2.2.1 抗MY株Vp1重组蛋白免疫血清的制备按照文献[3]方法将高纯度的MY株Vp1融合蛋白液(2mg/mL)作为抗原,与油佐剂按1∶1的比例配制成Vp1重组蛋白亚单位油乳剂疫苗,无菌检验后免疫家兔。将制得的MY株Vp1重组蛋白亚单位疫苗背部皮下6点注射,每只家兔接种1mL(蛋白终浓度为1mg/mL)。免疫3次,每次免疫间隔10d,三免后7d耳缘静脉采血1mL,分离血清,琼脂扩散试验检测血清免疫效价,采用琼脂扩散试验测定免疫血清的抗体效价。待琼脂免疫扩散法试血的血清效价≥1∶32时心脏采血,取血清分装,-20℃保存备用。
2.2.2 细胞中和试验(固定病毒-稀释血清法) 取少量兔抗MY株Vp1重组蛋白高免血清56℃灭活30min,按 2-1、2-2……2-6进行稀释。再将100TCID50/0.1mL的MY株鸡胚化弱毒稀释液与倍比稀释的血清1∶1混合,37℃感作1h,向已培养好的鸡胚成纤维细胞培养板加入不同稀释度的0.2 mL病毒-血清混合液,同时做细胞对照、标准阳性血清+抗原对照和被检血清毒性对照,置于温箱吸附2h,继续培养观察,记录细胞病变情况,6d后终判。
2.3 MY株Vp1重组蛋白亚单位疫苗免疫雏鸭后抗体水平监测及攻毒保护试验
2.3.1 动物分组与免疫 将ELISA检测结果为阴性的3日龄非免疫雏鸭200只随机分成A、B、C、D、E 5组,每组40只,右腿腿肌注射接种。免疫组A、B、C接种MY株Vp1蛋白亚单位疫苗,接种蛋白含量分别为50μg/只、100μg/只、200μg/只;免疫组D接种DHAV-1鸡胚化弱毒MY株,免疫量为~ELD50/只;组E注射生理盐水作为阴性对照组,0.2mL/只。
2.3.2 免疫雏鸭后抗体水平监测及攻毒保护试验免疫后第3、5、7、9、14、21天分别从每组随机抽取3只雏鸭采血,用纯化重组Vp1蛋白作为包被抗原,间接ELISA法检测血清中的Vp1蛋白抗体效价,监测免疫后各组雏鸭产生抗体的消长情况;同时,在各采血时间点随机抽取5只雏鸭,用4LD50的临床分离DHAV-1毒进行攻毒,观察记录每组鸭的死亡及存活情况,攻毒后第7天进行终判,统计各组的保护率。
3 结果与分析
3.1 Ⅰ型鸭甲肝病毒鸡胚化弱毒MY株Vp1蛋白的原核表达、纯化及浓度的测定 SDS-PAGE电泳结果显示,得到了大小为47kDa的Vp1重组蛋白,依次用含1%Triton-100、2mol/L尿素的PBS洗涤包涵体得到了高纯度的重组Vp1蛋白(图1)。BCA蛋白定量法测得纯化蛋白终浓度为983μg/mL。
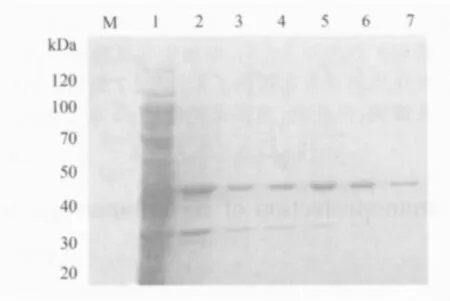
图1 Vp1重组蛋白的表达及纯度的测定
3.2 兔抗MY株Vp1重组蛋白的多克隆抗体对细胞的中和保护力试验 琼扩试验检测制备兔抗MY株Vp1重组蛋白高免血清效价≥64,将免疫血清与MY株鸡胚化弱毒在鸡胚成纤维细胞上进行细胞中和试验,Reed-Muench法计算结果。TCID50=10-1.65=1/45,即1/45为该兔抗 MY株 Vp1重组蛋白高免血清的中和抗体效价。同时,测得标准阳性血清的中和效价为1/53。结果表明,制备的兔抗MY株Vp1重组蛋白高免血清能够对被MY株鸡胚化弱毒感染的细胞产生保护,具有中和抗体的作用(图2,3,4)。



图4 7d血清中和对照
3.3 MY株Vp1重组蛋白亚单位疫苗免疫雏鸭后抗体消长及免疫攻毒试验
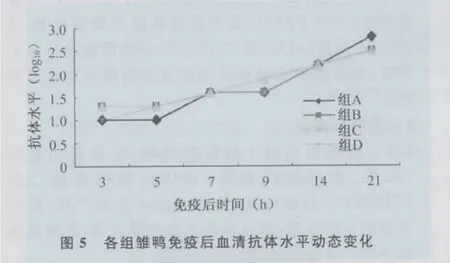
3.3.1 间接ELISA方法检测不同剂量Vp1重组蛋白免疫后雏鸭血清的抗体效价 ELISA检测结果表明,各组免疫雏鸭在免疫后的第3天均已产生抗体,在免疫后21d内,皆呈上升趋势;各免疫组与阴性对照组比较差异极显著(P<0.01),各免疫组之间抗体水平差异不明显(P>0.05),见图5。
3.3.2 免疫攻毒试验 用4×LD50的临床分离DHAV-1病毒进行攻毒,免疫组A、B、C(每组n=30只)雏鸭的存活率分别为47%、50%,57%,均高于组E(未免疫组)的20%,免疫组与未免疫组之间差异显著(P<0.05),组 A、B、C之间差异不明显(P>0.05)。但重组 Vp1各免疫组均低于组 D(MY株弱毒免疫组)的存活率83%。
4 讨论
目前对DHAV的免疫预防主要依靠弱毒疫苗和灭活疫苗。但近年的流行病学调查发现,我国华南地区DHAV有不同的基因型和血清型病毒株的出现,而DHAV不同血清型之间不能产生交叉保护,因此,使弱毒疫苗免疫保护力有所下降,也是疫苗不能产生交叉保护的主要原因[4]。由于传统疫苗存在的固有缺陷,如潜在的毒力返强威胁和免疫鸭疫苗株与野毒株难以区别等,为DHAV的控制带来了困难,因此研制安全有效的DHAV疫苗是亟待解决的问题,确定病毒中与免疫相关的位点则非常重要。
本试验将DHAV-1MY株Vp1重组蛋白为抗原制成的亚单位疫苗免疫家兔,将制备的兔抗MY株Vp1重组蛋白高免血清与MY株鸡胚化弱毒进行细胞中和试验,结果表明,制备的兔抗 MY株Vp1重组蛋白高免血清和标准阳性血清一样能够对被MY株鸡胚化弱毒感染的细胞产生保护,具有中和抗体的作用。同时,动物攻毒试验结果表明,重组Vp1免疫雏鸭的存活率均高于未免疫组(P<0.05),但低于组 MY株弱毒免疫组,且差异显著(P<0.05)。结果表明,重组Vp1蛋白免疫后使雏鸭获得了一定的免疫保护。这与裴宗飞[3]报道的Vp1-C3d-pcDNA3基因疫苗免疫效果的研究结论相符,单一蛋白抗原诱导机体产生抗体的保护力偏低。但也有学者认为Vp1重组蛋白以没有活性的包涵体形式表达,在复性过程中形成了一些无活性的多聚体,不具有蛋白的天然构象,从而丢失了一些抗原表位[5],使最终的免疫效果受到影响;何冉娅等[4]发现其在2007~2009年华南地区分离的DHAV毒株的RGD或QSD基序存在变异,变异会改变病毒粒子与细胞受体之间的关系,引起免疫效果降低;近来也有试验证明,DHAV-1结构蛋白VP3同样具有免疫原性[6],提示DHAV-1亚单位疫苗的研制要趋向于多个抗原组合的应用,才能获得更高的免疫保护[7-8];这些还尚需要进一步的试验确认。
[1]向毅勇,罗薇,靳艳玲,等.鸭肝炎病毒鸡胚化弱毒 MY株Vp1基因克隆、原核表达及抗原性分析[J].中国畜牧兽医,2010,37(12):68-73.
[2]罗薇,张金灵,刘内生,等.Ⅰ型鸭肝炎病毒鸡胚致弱毒 MY株的培育及实验研究[J].内蒙古农业大学学报,2010,31(1):9-14.
[3]裴宗飞.鸭病毒性肝炎C3d新型分子佐剂基因疫苗的研究[D].山东:山东农业大学,2009.
[4]何冉娅,于淼,张玉玲,等.2007~2009年华南地区鸭肝炎病毒流行病学调查及分离株的Vp1基因变异分析[J].中国动物传染病学报,2010,18(1):7-15.
[5]刘利芳.乳胶凝集试验、间接ELISA诊断鸭病毒性肝炎方法的建立[D].福州:福建农林大学,2009.
[6]刘家森,甘一迪,姜骞,等.鸭肝炎病毒Ⅰ型VP3基因的克隆及原核表达[J].中国兽医学报,2008,38(7):587-590.
[7]Bosch H V D,Frey J.Interference of outer membrane protein PalA with protective immunity against Actinobacillu spleurop neumoniae infections in vaccinated pigs[J].Vaccine,2003,21:3601-3607.
[8]曹素芳,黄青云.禽多杀性巴氏杆菌C48-1成熟外膜蛋白H重组亚单位疫苗免疫效果的研究[J].中国兽医科学,2006,36(6):464-467.
