清眩颗粒对伴及不伴睡眠呼吸暂停高血压患者内皮功能的影响
2012-08-04张京春陈懿宇刘建刚邬春晓
张京春 陈懿宇 陈 静 刘建刚 邬春晓 马 玲
(中国中医科学院西苑医院心血管病中心,北京 100091)
OSA为高血压的独立危险因素,对高血压合并OSA患者进行内皮损伤机制及药物干预的研究,将对探索降压机制、靶器官的保护,进而预防心脑血管事件产生积极的意义〔1〕。本研究拟在常规降压治疗基础上,对伴OSA的高血压患者和不伴OSA的高血压患者予以中药干预,从而观察血管内皮功能相关指标的变化,为探讨高血压伴OSA患者的内皮损伤机制,选择适宜的中药干预提供科学依据。
1 资料与方法
1.1 研究对象 2010年1月至2010年12月中国中医科学院西苑医院门诊就诊的高血压患者,根据是否合并OSA分为伴OSA和不伴OSA两个亚组。
1.2 诊断标准
1.2.1 高血压诊断标准 参照2003年WHO/ISH高血压防治指南〔2〕,以及2005 年《中国高血压防治指南》〔3〕。
1.2.2 中医证候诊断标准 参照卫生部2002年《中药新药临床研究指导原则》中高血压阴虚阳亢证标准〔4〕。
1.2.3 睡眠呼吸暂停低通气OSA诊断标准 参照2002年4月中华医学会呼吸病学分会睡眠呼吸疾病学组制定的《阻塞性睡眠呼吸暂停低通气综合征诊疗指南(草案)》〔5〕和《睡眠呼吸暂停与心血管专家共识》〔6〕。
1.2.4 病例纳入标准及排除标准 高血压患者纳入标准:(1)符合1级和2级高血压患者诊断标准和中医阴虚阳亢之辨证分型标准。(2)原发性高血压,过去未用降压药或经洗脱后1 w内不同日三次测压,血压达到诊断标准。(3)未用药,或已服用降血压药物但经2 w洗脱期后血压达到上述标准者。(4)1级高血压病程在3个月以上者。(5)年龄在18~75岁之间。(6)知情同意并签署知情同意书者。排除标准:(1)妊娠,或近期准备妊娠,或哺乳期妇女。(2)继发性高血压。(3)收缩压(SBP)≤140 mmHg或≥180 mmHg,舒张压(DBP)≤90 mmHg或≥110 mmHg。(4)3级高血压或单纯收缩期高血压者。(5)合并有精神病。(6)半年内有心肌梗死或明显脑卒中史。(7)过敏体质或对多种药物过敏者。(8)近3个月内接受过其他新药临床试验者。(9)洗脱期结束后未达到高血压诊断标准者。(10)合并心、脑、肾等严重脏器损害者。(11)因中枢神经系统脑部外伤疾病及先天颌面结构畸形而致打鼾患者。(12)有颌面结构发育障碍及单纯性耳鼻喉科疾病引起打鼾者。病例的剔除标准:(1)病例选择不符合纳入标准,符合排除标准,本不应当进行随机化。(2)未曾使用研究用药。(3)在随机化之后没有任何数据。资料统计分析前,由统计人员及主要研究者讨论判断研究病例是否剔除。
1.3 方法 本试验严格遵照《赫尔辛基宣言》进行,并经中国中医科学院西苑医院伦理委员会批准。采用分层随机双盲安慰剂对照法。
1.3.1 研究流程 本研究为分层随机双盲、安慰剂对照试验。将纳入的符合高血压诊断标准的患者,详细记录血压、治疗情况、心率、身高、体重、颈围、颈长、腰围、臀围、理化检查指标、中医症状积分、epworth量表、生活质量量表等,检查肝功、肾功、血脂、尿常规、血常规、心电图等安全性指标。洗脱期2 w。根据便携式睡眠仪检查得到的患者OSA情况,按是否伴有OSA分层,运用SAS9.2统计软件,按伴OSA和不伴OSA两个亚组的病例分配数及随机比例生成随机数字分组表,将每个亚组的患者随机分为试验组和对照组。所有患者在西药治疗(氨氯地平)的基础上,再加中药清眩颗粒或安慰剂干预2个月后,检查相关指标,评价疗效。对于需要持续正压通气治疗(CPAP)的中重度OSA患者,在结束2个月药物治疗后,再推荐使用CPAP治疗。
1.3.2 观察药物 清眩颗粒:杜仲30 g,钩藤30 g,天麻30 g,黄芩15 g,苦丁茶15 g,由四川新绿色药业科技发展股份有限公司提供。中药安慰剂:安慰颗粒剂在外观、气味、包装等方面和清眩颗粒相同,由四川新绿色药业科技发展股份有限公司提供。氨氯地平片:5 mg,络活喜,辉瑞制药有限公司提供。
1.3.3 观察指标及方法
1.3.3.1 便携式多导睡眠仪 在治疗前患者均接受便携式多导睡眠仪(采用美国凯迪泰公司SW-SM2000CB便携型多导睡眠分析诊断系统)记录鼻气流、鼾声、胸式呼吸、腹式呼吸、血氧、脉率、体位等。对于诊断有OSA的高血压患者,在治疗结束后再复查。OSA相关指标包括:最长暂停时间、平均暂停时间、睡眠呼吸暂停低通气指数(apnea hypopnea index,AHI)、睡眠呼吸暂停指数(apnea index,AI)、低通气指数(hypopnea index,HI)、最低SaO2%、平均SaO2%、氧减指数。
1.3.3.2 内皮依赖性血管舒张功能 (flow-mediated dilation,FMD) 参照Celermajer等介绍的方法进行〔7〕。被检者在安静遮光的房间中平卧15 min以上开始检查,使用7.5 MHz的15L8W线阵探头(西门子ACUSON Sequola 512型超声诊断仪)。受试者取仰卧位,右上肢充分暴露,外展15°,手心向上,在右肘窝上方2~5 cm处显示肱动脉长轴图像然后冻结,测量同步心电图R波顶点时,即肱动脉在心室舒张末期基础内径(D1),取3个心动周期的平均值,在检测部位皮肤上作标记以便重复操作。在测定D1后进行反应性充血实验,以袖带血压计缚于右上肢前臂,充气加压至200 mmHg,维持4 min后迅速放气,60~90 s内在原来同一部位超声检测肱动脉内径(D2),记录加压放气后舒张期肱动脉内径值(D2),与静息时基础内径相减,以百分率表示肱动脉变化率,加压放气后肱动脉内径增宽即血流介导的FMD。以FMD(%)大小判断肱动脉FDM。FMD(%)=(D2-D1)/D1×100%。
1.3.3.3 血管活性物质检查 (1)ET-1:非平衡放射免疫方法;PRA:放射免疫方法测定;AngⅡ:直接测定放射免疫方法;ALD:采用放射免疫学检测法。以上指标所用的放射免疫测定试剂盒均由北京华英生物技术研究所提供,操作过程严格按说明书操作程序进行。(2)NO:硝酸还原酶法测定,操作过程严格按说明书操作程序进行。
1.4 统计学方法 用SAS8.1软件统计分析,计量数据以±s表示,计量资料采用t检验,计数资料采用χ2检验。在本研究中,治疗后各效应指标上升或下降的差值,除了和所接受的药物不同有关,还受到治疗前各指标基线水平不同的影响,也受到是否伴有OSA的影响,故本文采用广义线性模型来分析这些因素对结果的影响。其中将是否接受试验组用药设为因素a,是否伴有OSA设为因素b,各指标治疗前基线水平设为因素c,这些因素共同影响治疗后各指标变化的差值(设为应变量Y),所有实际差值需转化为修正均数D(即最小二乘均数)再比较大小。
2 结果
2.1 患者一般资料 90例阴虚阳亢型轻中度高血压患者中伴OSA者46例(51.11%),不伴OSA者44例(48.89%)。年龄31~75岁,平均(55.11±10.07)岁。男性34例,其中伴OSA者 21例(61.67%);女性 56例,伴 OSA者 25例(44.64%),男性高血压患者OSA比例高于女性高血压患者。90例患者平均腰围(93.43±10.244)cm,平均臀围(105.088±7.89)cm,腰/臀0.88±0.06,平均颈围(38.38 ±7.28)cm,平均颈长(8.75±2.16)cm,平均 BMI(26.34±3.36)kg/m2。
伴中重度OSA患者和轻度OSA的高血压患者比较,FMD%、NO、NO/ET、ET-1、PRA、AngⅡ、ALD 水平没有统计学差异(P>0.05)。伴中重度OSA患者和不伴OSA的高血压患者相比,FMD%、NO、NO/ET 比值较低,ET-1、PRA、AngⅡ、ALD 水平更高,差异均有统计学意义(P<0.05)。伴轻度OSA患者和不伴OSA的高血压患者相比,FMD%、NO、NO/ET比值较低,AngⅡ、ALD水平较高,有统计学差异(P<0.05)。见表1。
表1 根据AHI分组后的各组血管活性物质比较(±s)
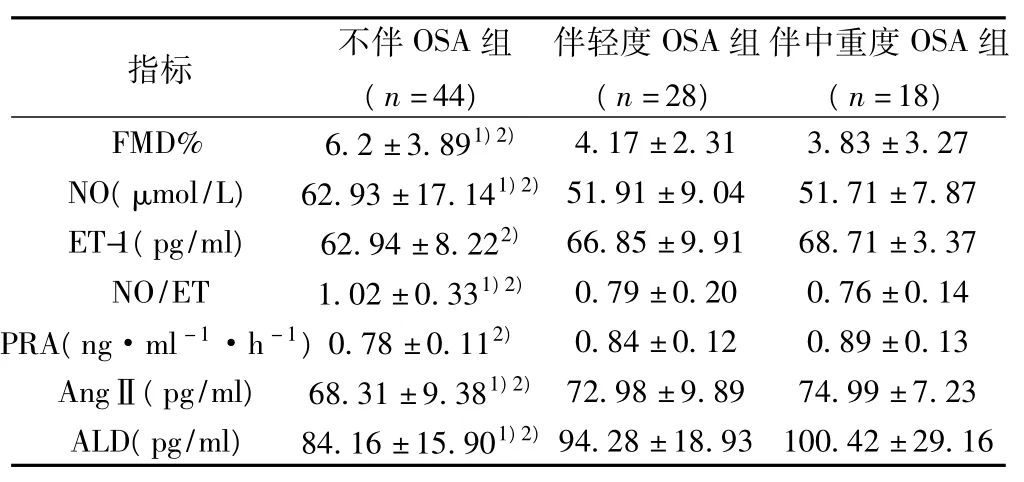
表1 根据AHI分组后的各组血管活性物质比较(±s)
与伴轻度OSA组比较:1)P<0.05;与伴中重度OSA组比较:2)P<0.05
指标 不伴OSA组(n=44)伴轻度OSA组(n=28)伴中重度OSA组(n=18)4.17±2.31 3.83±3.27 NO(μmol/L) 62.93±17.141)2)51.91±9.04 51.71±7.87 ET-1(pg/ml) 62.94±8.222) 66.85±9.91 68.71±3.37 NO/ET 1.02±0.331)2) 0.79±0.20 0.76±0.14 PRA(ng·ml-1·h-1)0.78±0.112) 0.84 ±0.12 0.89 ±0.13 AngⅡ(pg/ml) 68.31±9.381)2) 72.98±9.89 74.99±7.23 ALD(pg/ml) 84.16±15.901)2)FMD% 6.2±3.891)2)94.28±18.93 100.42±29.16
2.2 治疗前后相关指标的比较
2.2.1 治疗前后内皮功能的改变
2.2.1.1 治疗前后内皮依赖性血管舒张功能改变 各组均比治疗前本组FMD升高(P<0.05);总体患者、不伴OSA患者的FMD试验组比治疗后对照组高(P<0.05)。总体患者FMD升高幅度试验组D(-2.04)大于对照组 D(-0.31)(P(a)=0.013);是否伴有OSA影响FMD的升高(P(b)=0.0027),伴OSA患者 D(-0.08)升高幅度低于不伴 OSA患者 D(-2.33)。亚组内分析,不伴OSA者FMD的升高幅度试验组D(-2.95)高于对照组D(0.04)(P<0.05),伴OSA的高血压患者试验组和对照组 D比较没有统计学差异(P>0.05)。见表2。
2.2.1.2 治疗前后血管活性物质测定 与本组治疗前比较,各试验组ET-1值下降;且不伴OSA组和总体患者中试验组比治疗后对照组ET-1值低(P<0.05)。NO/ET比值各试验组均比本组治疗前升高(P<0.05);且试验组比治疗后对照组NO/ET比值高(P<0.05)。AngⅡ各试验组均比本组治疗前AngⅡ降低(P<0.05);且试验组比治疗后对照组低(P <0.05)。总体患者试验组和对照组相比(P(a)),能增加ET、NO/ET比值、AngⅡ的下降或升高幅度。伴 OSA和不伴OSA患者相比(P(b)),OSA 能减弱 NO、NO/ET、PRA、AngⅡ、ALD 的下降或升高幅度。亚组内分析:不伴OSA的患者:ET-1下降幅度试验组D(3.80)高于对照组D(-1.38)(P<0.05);NO/ET比值升高幅度试验组D(-0.14)均大于对照组D(-0.01)(P<0.05);AngⅡ下降幅度试验组D(3.88)高于对照组D(0.90)(P<0.05)。伴OSA:NO/ET比值升高幅度试验组D(-0.15)均大于对照组D(-0.05);AngⅡ下降幅度试验组D(7.69)高于对照组D(2.55)。见表3。
2.2.2 治疗前后OSA患者相关指标的变化 对46例伴OSA患者的睡眠呼吸暂停相关指数进行分析,OSA患者试验组的HI比治疗前降低,差异有统计学意义(P<0.05)。其他睡眠相关指标比治疗前有改善的趋势,但无显著差异(P>0.05);试验组与治疗后对照组比无显著差异(P>0.05)。见表4。
表2 治疗前后FMD比较( ± s,%)
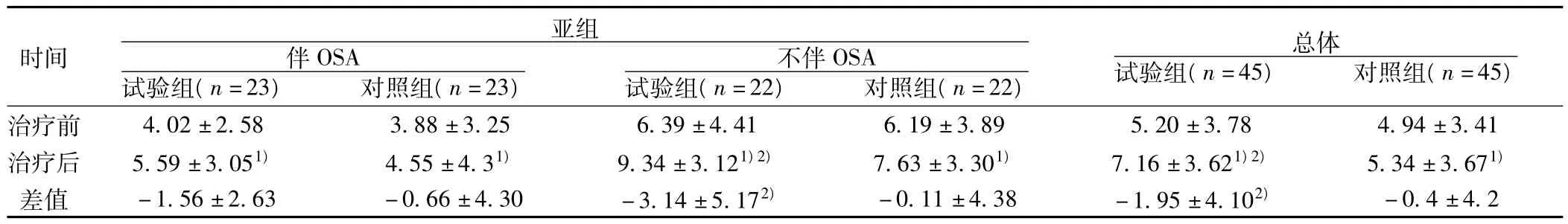
表2 治疗前后FMD比较( ± s,%)
与本组治疗前比较:1)P<0.01;与治疗后对照组比较:2)P<0.05
时间亚组伴OSA试验组(n=23) 对照组(n=23)不伴OSA试验组(n=22) 对照组(n=22)总体试验组(n=45) 对照组(n=45)治疗前 4.02±2.58 3.88±3.25 6.39±4.41 6.19±3.89 5.20±3.78 4.94±3.41治疗后 5.59±3.051) 4.55±4.31) 9.34±3.121)2) 7.63±3.301) 7.16±3.621)2) 5.34±3.671)差值 -1.56±2.63 -0.66±4.30 -3.14±5.172) -0.11±4.38 -1.95±4.102)-0.4±4.2
表3 治疗前后血管活性物质比较(±s)

表3 治疗前后血管活性物质比较(±s)
与本组治疗前比较:1)P<0.05,2)P<0.01;与治疗后对照组比较:3)P<0.05
指标亚组伴OSA试验组(n=23) 对照组(n=23)不伴OSA试验组(n=22) 对照组(n=22)总体试验组(n=45) 对照组(n=45)NO(μmol/L)5 4.02±25.73 2.97±28.19治疗前 51.60±6.78 51.96±10.11 61.85±19.65 64.01±14.58 56.61±15.30 57.86±13.77治疗后 56.52±11.49 53.32±10.33 69.01±16.80 64.90±15.91 62.63±15.51 58.98±14.47差值 -4.92±13.07 -1.34±12.05 -7.16±27.27 -0.89±24.00 -6.01±21.02 -1.12±18.64 ET-1(pg/ml)治疗前 68.38±9.58 66.78±9.12 64.04±8.43 61.84±8.05 66.26±9.20 64.37±8.88治疗后 60.72±6.991) 65.13±9.12 59.19±5.341)3) 64.27±8.64 59.97±6.211)3) 64.71±9.35差值 7.66±10.62 1.64±10.82 4.84±8.203) -2.42±12.60 6.28±9.513) -0.34±11.77 NO/ET治疗前 0.77±0.16 0.79±0.20 0.98±0.37 1.05±0.30 0.87±0.30 0.92±0.28治疗后 0.94±0.221)3) 0.83±0.23 1.17±0.301)3) 1.03±0.29 1.05±0.282)3) 0.93±0.27差值 -0.17±0.293) -0.04±0.27 -0.18±0.513) 0.03±0.45 -0.17±0.413) -0.006±0.37 PRA(ng·nl-1·h -1)治疗前 0.86±0.13 0.86±0.12 0.77±0.11 0.80±0.10 0.82±0.13 0.83±0.12治疗后 0.80±0.10 0.82±0.10 0.76±0.07 0.78±0.095 0.78±0.093 0.80±0.10差值 0.057±0.18 0.033±0.16 0.01±12.46 0.01±0.16 0.034±0.15 0.023±0.16 AngⅡ(pg/ml)治疗前 72.49±8.67 75.04±9.16 68.22±9.55 68.40±9.42 70.40±9.26 71.79±9.78治疗后 66.29±7.601)3) 71.00±8.09 64.43±7.961)3) 67.40±7.18 65.38±7.741)3) 69.24±7.79差值 6.20±12.643) 4.04±13.27 3.78±12.443) 0.99±12.71 5.02±12.463) 2.55±12.94 ALD(pg/ml)治疗前 96.75±28.09 96.62±18.07 83.36±17.24 84.97±14.81 90.20±24.13 90.92±17.39治疗后 91.96±21.14 92.13±18.54 80.14±21.39 83.59±21.56 86.18±21.86 87.95±20.31差值 4.78±25.84 4.49±27.09 3.22±26.19 1.38±29.8
表4 治疗前后伴OSA患者相关指标的变化(±s)
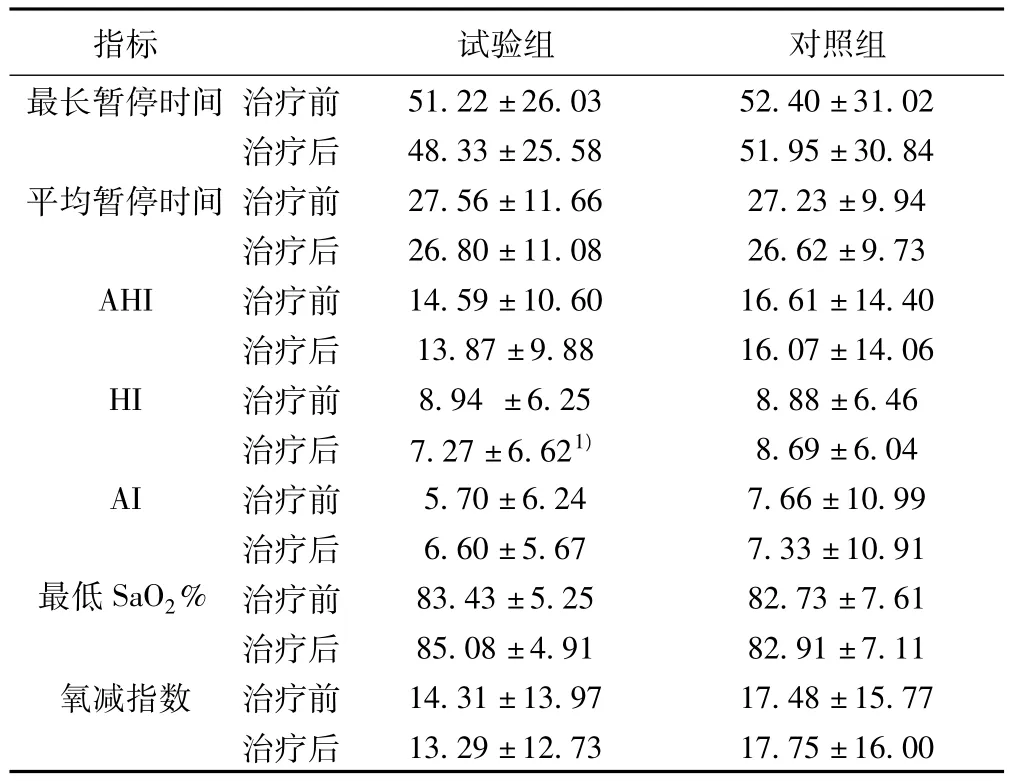
表4 治疗前后伴OSA患者相关指标的变化(±s)
与本组治疗前比较:1)P<0.05
指标 试验组 对照组最长暂停时间 治疗前51.22±26.03 52.40±31.02治疗后 48.33±25.58 51.95±30.84平均暂停时间 治疗前 27.56±11.66 27.23±9.94治疗后 26.80±11.08 26.62±9.73 AHI 治疗前 14.59±10.60 16.61±14.40治疗后 13.87±9.88 16.07±14.06 HI 治疗前 8.94±6.25 8.88±6.46治疗后 7.27±6.621) 8.69±6.04 AI 治疗前 5.70±6.24 7.66±10.99治疗后 6.60±5.67 7.33±10.91最低SaO2% 治疗前 83.43±5.25 82.73±7.61治疗后 85.08±4.91 82.91±7.11氧减指数 治疗前 14.31±13.97 17.48±15.77治疗后13.29±12.73 17.75±16.00
3 讨论
治疗前伴OSA的高血压患者FMD明显低于不伴OSA的高血压患者,可见伴OSA的高血压患者内皮依赖性血管舒张功能损伤比不伴OSA的高血压患者更为严重。治疗后不伴OSA的高血压患者试验组FMD高于对照组,差异有统计学意义;而伴OSA的高血压患者试验组和对照组之间没有差异。可见OSA引起内皮依赖性血管舒张功能损伤更为严重,中药清眩颗粒可以改善损伤较轻的患者,对损伤较为严重的OSA患者则没有显著作用。本研究对治疗前后FMD的差值进行协方差分析,结果显示OSA影响FMD的改善,同时试验组FMD增加的幅度高于对照组,提示清眩颗粒可以改善血管内皮功能。
动物研究发现清眩胶囊对自发性高血压大鼠(SHR)和二肾一夹(2KIC)大鼠具有一定降压作用,其中清眩胶囊对2KIC大鼠降压有剂量依赖性;清眩胶囊降压机制可能与抑制循环RAAS活性、纠正ET/CGRP紊乱有关〔8〕。本次临床研究发现总体患者试验组和对照组相比,清眩颗粒能增加AngⅡ 和ET-1的下降幅度,以及NO/ET比值的上升幅度。从而推测其可能可以降低RAAS活性,调整NO/ET比值使其平衡,与上述动物实验结论相似。
本研究选用的药物清眩颗粒主要是在清眩胶囊的基础上简化方药制成,主要包括杜仲30 g、钩藤30 g、天麻30 g、黄芩15 g、苦丁茶15 g,用以平肝潜阳。其中以天麻、钩藤平肝潜阳熄风,苦丁茶散肝风、清头目、活血脉为主,辅以杜仲补益肝肾,黄芩清肝热、平肝阳,共奏益肝肾、清肝热、滋肝阴、平肝阳之功。现代药理学研究证实如上药物具有明确的降压作用,未出现明显的毒副反应。其中杜仲主要通过促进内皮细胞释放NO舒张血管,还可以通过抑制血管平滑肌细胞的Ca2+通道等途径舒张血管,对血管紧张素Ⅱ(AngⅡ)生成亦有持久的抑制作用。钩藤提取物可以抑制血管内皮细胞生成自由基,保护内皮功能,对早期高血压可能有血管保护作用。天麻的主要成分天麻多糖对RHR大鼠具有良好的降压作用,其作用机制促进内源性舒血管物质NO的生成,抑制内源性缩血管物质ET和AngⅡ的释放,最终恢复二者拮抗效应的平衡〔7〕。黄芩对血管内皮细胞的钙通道具有阻滞作用,这可能与其扩张血管、降压作用机制有关。苦丁茶提取液能增加心脑血流量,降低血管的阻力和压力,对血管有一定扩张作用,能调整血管功能,对于治疗高血压病有较好疗效〔9〕。
同时为观察清眩颗粒对OSA的影响,本研究将46例伴OSA的高血压患者治疗前后OSA情况进行了比较,发现OSA患者试验组的低通气指数HI比治疗前降低,差异有统计学意义。其他睡眠相关指标比治疗前都有改善的趋势,但没有统计学意义;治疗后试验组和对照组比较,差异也没有统计学意义。可见对伴OSA的高血压患者用氨氯地平不会加重其OSA的病情,加上中药清眩颗粒以后,可以改善OSA患者的低通气次数。这在临床上是值得进一步关注的。
1 Ramar K,Caples SM.Vascular changes,cardiovascular disease and obstructive sleep apnea〔J〕.Future Cardiol,2011;7:241-9.
2 Whitworth JA,World Health Organization,International Society of Hypertension Writing Group.2003 World Health Organization(WHO)/International Society of Hypertension(ISH)statement on management of hypertension(Guidelines and recommendations)〔J〕.J Hypertens,2003;21:1983-92.
3 中华人民共和国卫生部.中国高血压防治指南(2005年修订版)〔S〕.2005.
4 郑筱萸.中药新药临床研究指导原则〔M〕.北京:中国医药科技出版社,2002:73-7.
5 中华医学会呼吸病学分会睡眠呼吸疾病学组.阻塞性睡眠呼吸暂停低通气综合征诊治指南(草案)〔J〕.中华结核和呼吸杂志,2002;25(3):195-8.
6 睡眠呼吸暂停与心血管疾病专家共识组.睡眠呼吸暂停与心血管专家共识〔J〕.中华内科杂志,2009;48(12):1059-67.
7 缪化春,沈业寿.有关天麻多糖的降压作用〔J〕.高血压杂志,2006;14(7):531-3.
8 卢全生,雷 燕,陈可冀.AT1R基因多态性与原发性高血压中医证型及降压中药疗效的关系〔J〕.中国中西医结合杂志,2005;25(8):682-5.
9 苏金平,刘干中,彭继道.五种中草药对钙通道阻滞作用的初步研究〔J〕.中药药理与临床,2006;22(6):45-6.
