胰岛素对痴呆鼠的保护作用及机制
2012-08-04姜礼红裴立春滕宗艳宋芳芳张一娜
姜礼红 裴立春 滕宗艳 孟 佳 宋芳芳 张一娜
(哈尔滨医科大学第二附属医院老年病科,黑龙江 哈尔滨 150086)
阿尔茨海默病(AD)是德国医生于1896年发现的一种脑细胞逐渐减少的疾病,是导致痴呆的主要原因〔1〕。痴呆是一种与认知功能下降相关的症候群,随着人口老龄化进程的加快,AD发病率明显呈上升趋势,给家庭和社会带来的负担非常严重,引起了社会的广泛关注〔2〕。AD发病机制中已经被广为接受的一种观点是:脑中淀粉样斑块积聚是引发AD系列病理改变的触酶〔3〕。越来越多的实验已证明Aβ淀粉样蛋白的神经毒性可能是导致AD重要原因之一,那么寻找使Aβ减少的特殊药物,则可称之为一种“治本”的方法。胰岛素作为一种激素,其发挥的血糖调节作用已为人们所知。已有研究证实,在大脑主要的认知功能区存在大量的胰岛素受体,可以认为胰岛素是通过刺激特定的中枢位点来调整记忆功能,脑室内胰岛素给药能改善大鼠记忆的形成〔4〕。本实验利用大鼠AD模型,采用皮下注射胰岛素作为干预,对大鼠认知行为、病理以及海马区Aβ1~40表达进行了观察,为进一步探讨胰岛素对AD的作用,合理应用胰岛素治疗AD提供一定的理论依据。
1 材料与方法
1.1 材料
1.1.1 主要试剂和仪器 Aβ1~40(美国 Sigma公司提供),大鼠脑立体定位仪(STW-1三维推进器,成都仪器厂),台式牙科钻(307-6,上海齿科医械厂),电子婴儿秤(ACS-20-YE,无锡市衡器厂),微量进样器(YY0088-92,宁波市镇海三爱仪器厂),数显电热恒温水浴箱(HH.W21.600S,上海跃进医疗器械厂),Morris水迷宫(中国医学科学院药物研究所),摄影显微镜(OLYMPUS U-SPT型),胰岛素(批号:XV60220,诺和诺德制药有限公司),抗Aβ1~40多克隆抗体(美国Sigma公司提供),免疫组化检测试剂盒(武汉博士德公司)。
1.1.2 实验动物分组 健康雄性Wistar大鼠(黑龙江省哈尔滨兽医研究所提供),体重(300±20)g,分笼饲养,每笼8只,自由饮食,室内常温下配方料喂养,光照、黑暗各12 h。将大鼠随机分为4组,每组8只:(1)正常对照组:不进行任何处置;(2)模型组:立体定向双侧海马CA1区注射Aβ1~40;(3)盐水治疗组:造模1 d后每日8点给予0.9%生理盐水(1 ml/kg)腹部皮下注射,用药21 d;(4)胰岛素组:造模1 d后每日8点给予正规速效胰岛素(0.1 U/kg)腹部皮下注射,用药21 d,根据文献〔5〕及预试验结果选择此给药剂量,该剂量不会引起大鼠血糖下降,不影响相应检测时间点大鼠的活动能力。术后14 d,4组分别作行为学检测,术后21 d取脑做病理学观察和免疫组化。
1.2 方法
1.2.1 Aβ1~40的预处理 用无菌生理盐水将Aβ1~40(美国Sigma公司提供)稀释成2 μg/μl,置入电热恒温箱37℃孵育1 w,使其变为凝聚态的Aβ1~40。
1.2.2 AD动物模型的复制〔6〕手术大鼠麻醉后,参照大鼠脑立体定位图谱〔7〕,经预实验确定进针点(AP=3.0 mm,ML=2.0 mm,DV=4.0 mm),选择双侧海马CA1区为注射靶区缓慢注入凝聚态 Aβ1~405 μl,5 min 内注射完毕,留针 5 min 以保证溶液充分弥散。所有操作均在无菌条件下进行。
1.2.3 行为学检测 水迷宫:平台置于第Ⅲ象限的中间,在其他3个象限中任选一入水点,实验每天训练2次,每次采用不同的入水点,每次训练2 min的方案。训练5 d,分别记录每只动物的潜伏期、游过的路程(定向航行实验)以及在训练的最后1 d,将平台移走,分别用秒表记录每只大鼠第一次经过平台的时间即测试潜伏期,并记录每只大鼠在2 min内经过平台的次数以及在平台所在象限内逗留的时间(空间探索试验),作为评价大鼠学习成绩的指标。
1.2.4 病理学观察 行为学测试后进行心血管灌注固定法。各组大鼠经10%水合氯醛(3 ml/kg)腹腔麻醉后,先以冰生理盐水100 ml快速灌注,再以4%多聚甲醛(4℃)150 ml灌注固定,冰台快速取脑做冠状切面,投入4%多聚甲醛溶液中固定,经固定、石蜡包埋,连续冠状组织切片,片厚5 μm,取海马部位的切片裱于经多聚赖氨酸处理的清洁玻片上,60℃烤箱内烘烤2 h后放入4℃冰箱保存,分别行HE、刚果红染色。
1.2.5 免疫组织化学检查 免疫组化染色采用PV二步法,具体操作过程按试剂盒说明书进行。阴性对照用PBS代替一抗,其余步骤相同。
1.2.6 图像分析 以海马神经细胞膜或胞浆出现棕黄色颗粒沉着为阳性结果。每组取8张脑片,每张细胞片在海马CA1区针道附近随机观察5个具有代表性的中倍视野,每个视野计数100个细胞,计算出各个视野中阳性细胞数,由两名人员独立观察,最后取平均值。
1.3 统计学处理 统计数据采用SPSS13.0软件进行分析,所有数值以±s表示,逃避潜伏期采用重复测量方差分析,其他数据采用单因素方差分析。
2 结果
2.1 定向航行试验 大鼠造模14 d后,用Morris水迷宫法检测4组大鼠的定向航行、空间探索能力。定向航行试验结果见图1,4组的逃避潜伏期均不断缩短。开始各组间无显著差异,经过5 d的训练组间出现差异。正常组经过5 d训练潜伏期明显缩短,说明这一组别有学习和记忆能力。胰岛素组测试潜伏期与正常组相比无显著差异(P>0.05),表明胰岛素治疗组有学习和记忆能力。与模型组和盐水组相比差异显著(P<0.01),但胰岛素组的潜伏期明显缩短可能是实验例数较少的缘故。模型组与正常组相比有显著差异(P<0.01),表明模型组学习记忆能力受损。盐水组和模型组相比无显著差异,说明盐水对AD模型影响不大。
2.2 空间探索试验 在第5天撤去平台,以大鼠穿越平台次数及大鼠在第Ⅲ象限活动时间作为衡量记忆好坏指标,模型组穿越站台次数比正常组少55%,模型组大鼠在第Ⅲ象限活动时间比正常组少40%,胰岛素组与正常组比较无显著差异(P>0.05),与模型组和盐水组相比差异显著(P<0.01)。模型组和盐水组与正常组相比有显著差异(P<0.01)。见图2。
2.3 Aβ1~40海马注射后局部病理改变 光镜下正常组大鼠海马区未见神经元损伤,神经元排列规则、紧密、形态完整。模型组及盐水对照组大鼠海马区注射点附近可见颗粒细胞带明显受损,局部神经元大量缺失,细胞排列疏松紊乱,部分细胞缺失,注射点附近出现弥漫性胶质细胞反应,细胞增生、聚集,核小深染,成扁圆形,判断为胶质细胞增生,锥体细胞数量较对照组明显减少。胰岛素注射组颗粒细胞带轻度受损,神经元排列尚规则,与模型组之间有明显差异见图3。刚果红染色模型组可见细胞排列紊乱,胞浆内可见深染,提示为淀粉样蛋白聚集,正常组染色较浅,细胞排列规则,且胞浆未见异常改变,胰岛素组染色较浅,细胞形态完整,接近正常组见图4。2.4 海马CA1区Aβ1~40的表达 模型组及盐水对照组海马CA1区可见大量棕褐色阳性细胞〔(57.53±2.99)和(58.10±4.26)〕,胞质及轴突、树突均清晰着色,正常组大鼠海马CA1区偶见Aβ1~40免疫阳性神经元(7.15±0.62);同拟AD模型组比较,胰岛素组大鼠海马 CA1区Aβ1~40免疫阳性神经元明显减少或消失(24.05±0.84,P<0.01),同正常组比较其他三组Aβ1~40免疫阳性神经元明显受损(P<0.01),差异有统计学意义。见图5。

图1 大鼠空间定向航行能力
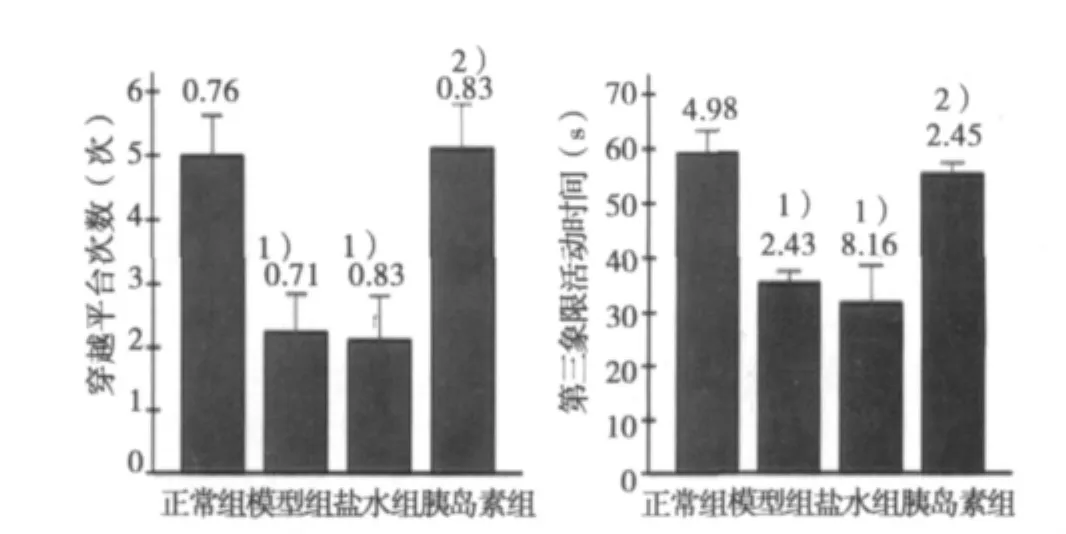
图2 大鼠空间探索能力

图3 各组海马HE染色病理学图片(×40)
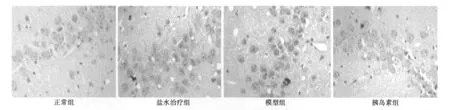
图4 各组海马刚果红染色病理学图片(×40)
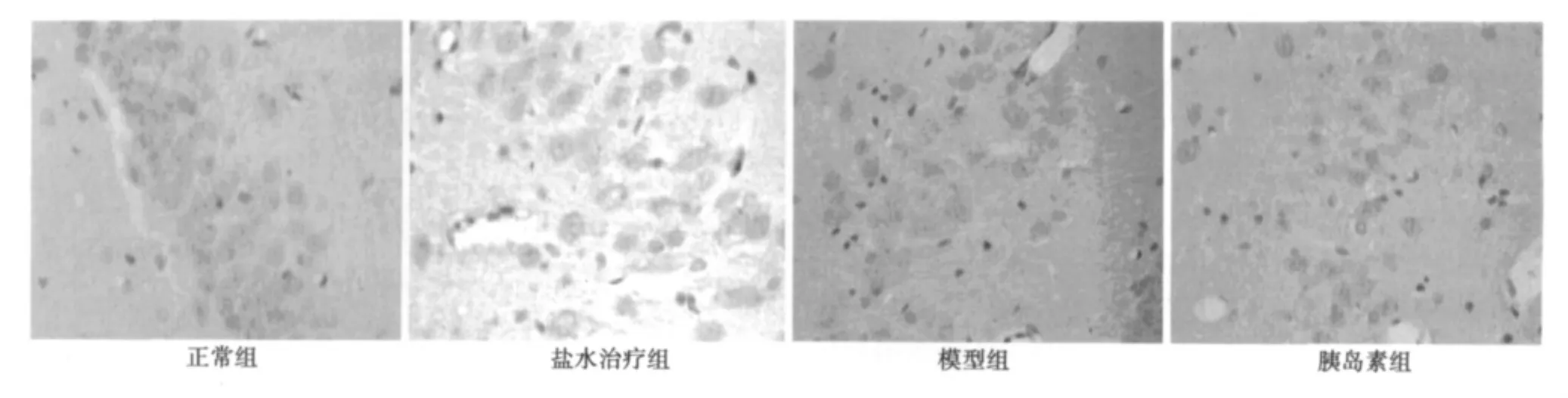
图5 各组大鼠海马CA1区Aβ1~40表达(DAB,×40)
3 讨论
AD是一种以慢性进行性记忆、认知等智能障碍为主要临床表现、与增龄相关的中枢神经系统退行性疾病,其典型的病理变化是脑内出现大量的因β-淀粉样蛋白积聚所形成的老年斑、因tau蛋白异常磷酸化导致的神经原纤维缠结和神经元丢失等。海马作为边缘系统的重要组成部分,是近记忆回路的重要结构,是学习记忆的重要解剖基础和神经中枢,海马结构的序化板层构筑和神经元相对独立分布等特点使其成为最理想的学习记忆的研究模型,海马不同区域的功能不尽相同,其中CAl区在学习、记忆中担负重要作用〔8〕,许多研究表明,海马与机体衰老、AD及癫痫发作有着非常密切的关系〔9〕。
自从1978年在大鼠脑组织提取物中发现有胰岛素存在的证据以来,相继证实人类及哺乳动物中枢神经系统的广泛区域中存在胰岛素及其受体,胰岛素在神经系统中有着特殊的生物学效应,在调节脑能量代谢,促进神经生长发育,调节神经元生长活动和递质释放等方面起着重要作用〔10~12〕。对人和动物的研究表明,当与认知有关的大脑皮层、海马等部位得不到充分的胰岛素或对胰岛素失去反应时,可发生记忆减退的轻型Alzheimer病〔13〕。对大鼠脑室内注射链脲佐菌素以破坏IR,可造成严重的学习和记忆损伤〔14〕。
本实验采用海马微量注射凝聚态Aβ1~40的方法建立拟AD大鼠模型,对注射部位、注射量及注射药物的孵化作了改进,本实验评价学习记忆障碍的设备是带摄像装置及分析软件的水迷宫,实验数据不受人为因素影响,更客观、真实可靠。
本实验胰岛素剂量选用0.1 U/kg皮下注射,参考相关文献及预实验结果,该剂量不会影响大鼠血浆血糖水平,但胰岛素组大鼠出现毛色无光泽,且体重增长不明显。同时为避免在行为学习时胰岛素组出现高胰岛素水平,因为胰岛素有巩固情感记忆的作用,因此给药在行为学习之后进行。在过去研究中有的直接计算每天的平均逃避潜伏期后再进行t检验或方差分析,或根据大鼠的逃避潜伏期在定位航行试验后3 d趋于稳定的情况,仅对后3 d的平均逃避潜伏期进行t检验或方差分析。但趋于平稳的后3 d的平均逃避潜伏期代表记忆水平,仅在生理状态下的大鼠才表现如此。而实验记忆损伤组大鼠后3 d的逃避潜伏期仍然持续下降。且在给予某种处理后,在不同的时间点上从同一受试对象上重复测量获得的数据受多种因素影响,同一受试动物的不同时间点所测得的逃避潜伏期存在高度的自相关性,据此我们试验中定位航行试验的逃避潜伏期采用重复测量数据的方差分析。然后分别对第1天最初潜伏期和第5天测试潜伏期进行单因素方差分析。
本实验发现AD大鼠模型组大鼠的学习记忆能力明显下降,而应用胰岛素后,大鼠在定向航行试验、空间探索试验中学习记忆能力均明显改善,表明胰岛素具有改善AD大鼠学习记忆的作用。但胰岛素组的潜伏期明显缩短可能是实验例数较少的缘故。虽已有证据表明脑组织可自身合成胰岛素,然而这种合成功能仅局限于少数脑区,且合成量甚微。动物实验证明,I125标记的胰岛素能通过兔的血脑屏障,中央隆起和微血管中存在血浆胰岛素的专一吸收位点。因此本实验采用皮下注射胰岛素的方法既避免了脑室内给药造成大脑机械性损伤的可能,也说明外周胰岛素水平可以影响脑内胰岛素的含量,对拟AD大鼠模型有治疗作用。在海马HE、刚果红染色方面,模型组表现颗粒细胞带明显受损,局部神经元大量缺失,细胞排列疏松紊乱,部分细胞缺失,注射点附近出现弥漫性胶质细胞反应,胰岛素组颗粒细胞带轻度受损,神经元排列尚规则。胰岛素皮下注射3 w的拟模型大鼠与模型组比较,CA1区Aβ1~40表达明显减少或消失,提示胰岛素具有改善拟 AD模型大鼠脑组织病理改变及降低Aβ1~40表达的作用,证实了胰岛素的治疗作用。该实验治疗时间较长共21 d,大鼠学习记忆能力改善明显,但仍不能完全改变已形成的病理变化,如停止给药病理变化可能会继续进展,因此还应进行延长胰岛素治疗时间的实验,以探讨长期应用胰岛素治疗AD疗效。
对AD患者的研究发现,AD患者脑内IR增加,但信息传导途径障碍,即存在与2型糖尿病相似的信号转导,认为胰岛素能通过抑制人神经细胞株糖原合成激酶-3的活性,抑制细胞外淀粉样蛋白的沉积。据此推论,胰岛素皮下注射拟AD模型大鼠使Aβ1~40表达减少可能是大鼠学习记忆能力改善的原因之一,但这一机制还需进一步探究。本实验未对外周及脑内Aβ1~40及胰岛素水平进行检测,并与临床资料进行比对,该模型是否符合AD的病理生理进展过程还需要进一步验证。
1 Vicioso BA.Dementia:when is it not Alzheimer disease〔J〕?Am J Med Sci,2002;324(2):84-95.
2 Song IU,Kim JS,Kim YI,et al.Clinical significance of silent cerebral infarctions in patients with Alzheimer disease〔J〕.Cogn Behav Neurol,2007;20(2):93-8.
3 Selkoe DJ.Clearing the brain′s amyloid cobwebs〔J〕.Neuron,2001;32(2):177-80.
4 Collin RP,Randy JS,Craft S,et al.Intracerbroventricular insulin enhances memory in a passive-avoidance task〔J〕.Physiol Behavior,2000;68:509-14.
5 Zhang G,Fei Z,Zhang X,et al.Therapeutic window of insulin treatment for cerebral ischemic reperfusion injury in rats〔J〕.J Fourth Mil Med Univ,2000;219:1083-5.
6 姜礼红,张一娜,宋芳芳,等.凝聚态Aβ1~40海马内注射致AD大鼠在体神经毒性作用〔J〕.南京医科大学学报,2007;27(12):1373-6.
7 诸葛启钏.大鼠脑立体定位图谱〔M〕.第3版.北京:人民卫生出版社,2005:27-38.
8 Kudo K,Wati H,Qiao C,et al.Age-related disturbance of memory and CREB phosphorylation in CA1 area of hippocampus of rats〔J〕.Brain Res,2005;1054(1):30-7.
9 Sanderson DJ,Pearce JM,Kyd RJ,et al.The importance of the rat hippocampus for learning the structure of visual arrays〔J〕.Eur J Neurosci,2006;24(6):1781-8.
10 Gasparini L,Gouras GK,Wang R,et al.Stimulation of beta-amyloid precursor protein trafficking by insulin reduces intraneuronal beta-amyloid and requires mitogen-activated protein kinase signaling〔J〕.J Neurosci,2001;8:2561-70.
11 Guidetti C,Paracchini S,Lucchini S,et al.Prevention of neuronal cell damage induced by oxidative stress in vitra effect of different Ginkgo biloba extracts〔J〕.J Pharmacol,2001;53(3):387-92.
12 Hoyer S.The brain insulin signal transduction system and sporadic(type II)Alzheimer disease:an update〔J〕.J Neural Transm,2002;109:341-60.
13 Hoyer S.Glucose metabolism and insulin receptor signal transduction in Alzheimer disease〔J〕.Eur J Pharmacol,2004;490(1-3):115-25.
14 Sharma M,Gupta YK.Intracerebroventricular injection of streptozotocin in rats produces both oxidative stress in the brain and cognitive impairment〔J〕.Life Sci,2001;68(9):1021-9.
