grb14基因的功能及其研究进展
2012-08-04高晓猛张春雷房兴堂
高晓猛,张春雷,房兴堂,陈 宏*,2
(1.江苏师范大学细胞与分子生物学研究所,江苏 徐州 221116;2.西北农林科技大学动物科技学院,陕西省农业分子生物学重点实验室,陕西 杨凌 712100)
Grb7家族(growth factor receptor-bound protein 7family,生长因子受体衔接蛋白7家族)受体分子包括 Grb7(growth factor receptor-bound protein 7,生长因子受体衔接蛋白7),Grb10(growth factor receptor-bound protein 10,生长因子受体衔接蛋白10)和Grb14,它们每一个都有若干个剪接变体。像其它受体分子一样,Grb7家族蛋白功能是在调节不同细胞功能上,间接把多样的细胞表面受体结合到下游区信号途径。它们在序列上有显著的同一性。本文仅就其中的一个生长因子GRB14的研究现状做一个介绍。
1 GRB14的基本结构和染色体定位
目前对Grb14的结构特征已经研究的比较清楚。通过比较Grb7/10/14三个成员之间的结构,发现它们之间存在显著的序列同一性,存在一个保守的分子结构。Grb14在结构上包括三个部分:羧基末端存在一个高度保守的SH2区域,中央存在一个称为GM(Grb/Mig)的区域,氨基末端包含一个保守性很强的区域,此区域富含脯氨酸。
grb14基因在人体上定位于第2号染色体的2q22-q24区[1],含有14个外显子,编码产生具有540个氨基酸残基的蛋白质[2,3]。人grb14基因的mRNA在肝脏,肾脏,胰脏,卵巢,睾丸,心脏和骨骼肌中高度表达,而且也大量存在于肾胚胎细胞,一些前列腺癌细胞系和乳癌细胞中[4],显著存在于ER-阳性 细 胞 系 中[4,5]。grb14 基 因 有 三 种 剪 接 变 体(2.3kb,2.4kb和2.5kb)[4]。黑猩猩和小鼠的grb14基因定位于第2号染色体上,大鼠的grb14基因定位于第3号染色体上[2]。在小鼠和大鼠上grb14基因编码产生538个氨基酸残基的蛋白质,在对胰岛素敏感的器官如肝脏,心脏,骨骼肌,胰脏,脑和白脂肪组织中表达,能够产生2.5kb和1.9kb的剪接变体[6]。小鼠grb14基因序列与大鼠相比有93%的相似性,和人体grb14基因序列有85%的相似性[7]。牛的grb14基因定位于第2号染色体,编码产生540个氨基酸,128 975bp,含有5'UTR 176 bp,CDS区1 623bp,3'UTR 850bp。
2 GRB14的功能及其相应机理
2.1 GRB14在胰岛素活性上的作用
2.1.1 GRB14抑制胰岛素受体的催化活性
GRB14在小鼠肝脏与胰岛素受体结合后,胰岛素显示出的强烈兴奋可以证明在胰岛素信号上GRB14能够起作用。目前发现到GRB14能够特异性地结合到胰岛素受体酪氨酸激酶环上,导致有可能这种相互作用会改变这些受体的催化活性。Bereziat等[8]在体外进行了酪氨酸激酶的分析实验,证明GRB14通过改变受体的自磷酸化作用能直接抑制胰岛素受体对底物的催化活性。Bereziat和Stein等[8,9]研究了GRB14蛋白和胰岛素受体结合时的结构域,发现胰岛素受体的催化活性的抑制,是由于它结合到了GRB14的PIR结构域(位于中央GM区)上,而不是独自结合到SH2区域,同样对于GRB7和GRB10来说负责抑制IR酪氨酸激酶活性的也是PIR结构域。这就说明结合能力与PIR结构域抑制作用之间的联系,说明GRB14在调节胰岛素受体催化活性上起到中枢作用。Bereziat和Stein等[8,9]在体外实验中,发现了GRB7和GRB10也抑制胰岛素受体催化活性,但是要比GRB14的效应差。综合考虑这些发现表明GRB14在胰岛素受体催化活性上具有特殊的抑制效应。
2.1.2 GRB14对细胞内胰岛素活性的作用
Saltiel等[10]指出,在胰岛素结合到相应受体上后,细胞内胰岛素活性的第一步是诱导胰岛素受体的酪氨酸残基进行自磷酸化作用。然后这些残基就作为细胞内特异效应器的结合位点,比如胰岛素受体家族或含有SH2结构域的蛋白,从而使胰岛素信号得以传递。Bereziat等[8]指出在GRB14蛋白存在时,细胞外信号调节激酶1和细胞外信号调节激酶2的活性会被降低。因此,可以得出结论,GRB14蛋白在胰岛素受体催化活性上的直接抑制效应有可能是在胰岛素信号的早期阶段。
Bereziat等[8]在中国仓鼠卵巢-胰岛素受体细胞中发现,如果过表达GRB14蛋白将会导致胰岛素受体的持续磷酸化,它会维持在最高水平高达90 min。一种解释是GRB14蛋白与活化的胰岛素受体结合,会在空间上妨碍酪氨酸磷酸酶的活性,比如PTP1B(protein tyrosine phosphatase1B,蛋白酪氨酸磷酸酶1B),因此才使胰岛素受体维持在一个磷酸化的状态。综合得出GRB14和PTP1B是通过两种不同的机制来降低胰岛素受体的催化活性:PTP1B通过脱磷酸作用使胰岛素受体失去活性,而GRB14是通过结合磷酸化的酪氨酸激酶环来直接抑制它的催化活性。Cariou等[11]把GRB14显微注射进入非洲蟾酴卵母细胞中,发现可以阻断胰岛素诱导的减数分裂。如果把蛋白激酶C zeta干扰蛋白(ZIP)一起注射进入细胞的话,就会出现GRB14的抑制作用。这种效应需要蛋白激酶C zeta的募集反应。因此,发现了一个新的胰岛素信号负反馈通路(图1)。

图1 grb14介导胰岛素信号抑制作用时ZIP的作用模型(来自参考文献[11])
2.2 GRB14在纤维母细胞生长因子信号途径上的作用
纤维母细胞生长因子(FGF)是一个超过20多个生长因子的家族,是脊椎动物发育,组织生长和发育的决定性调节器。Grose等[12]指出FGFs的突变或者表达和活性的失调都会导致产生发育异常和肿瘤发生。FGF信号的转导是通过一个含有四种跨膜酪氨酸激酶家族来完成。Eswarakumar等[13]发现通过配体之间的结合会诱导受体形成二聚体结构,细胞质中酪氨酸激酶结构域的磷酸化和激活作用,然后就会出现多方面的信号转导级联反应。如果加入靶蛋白,那么它们之间就会通过SH2结构域和活化受体的特殊磷酸化酪氨酸残基相互作用。
Bertrand Cariou等[14]指出,纤维母细胞生长因子受体(FGFR)是继胰岛素受体之后的第二个在细胞中能够与GRB14相互作用的受体酪氨酸激酶。像胰岛素那样,GRB14的过表达会抑制由纤维母细胞生长因子诱导的细胞增生,并且发现了不能结合到FGFR上的GRB14SH2-突变体的表达能够使FGF产生效应,这就预示GRB14与还未被鉴定的下游区效应器能够相互作用,对FGFR的催化活性没有影响。因此,GRB14对胰岛素的抑制作用机制和对FGF在细胞增生活性上的作用机制可能不同。
Daly等[15]发现grb14mRNA在大量的人乳腺和前列腺癌细胞中被高度表达。这就可能表明在这个细胞系中,GRB14在细胞增生作用上能起到正向作用。但是还不清楚GRB14蛋白的表达水平是否被增加,还有它是否是一个野生型或者是GRB14的突变体。Reilly等[16]发现GRB14能够与活化的FGF受体结合。Edith Browaeys-Poly等[17]实验发现在已经敲除了grb14基因的小鼠胚胎成纤维细胞中,与没有敲除的相比,FGF诱导的Akt磷酸化被增强了。而且经免疫共沉淀实验证实了GRB14-FGFR复合物的形成(图2)。综合分析这些结构,表明GRB14在FGF信号途径上起到非常重要的作用。
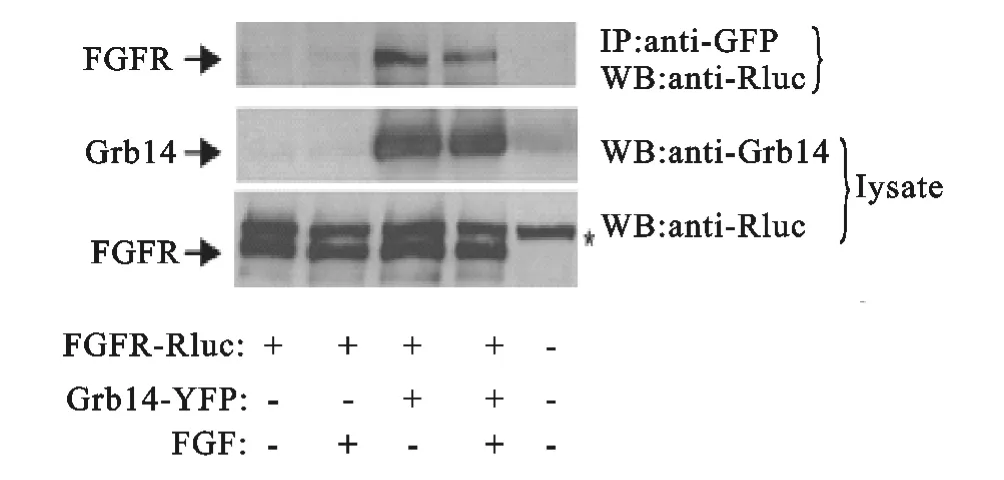
图2 FGFR在活细胞中与GRB14相互作用(来自参考文献[17])
3 grb14基因的研究进展
目前对grb14基因的研究主要集中于人和小鼠上,在牛上还没有见到相关的报导。2004年Bertrand Cariou等在综述中分析了GRB14的结构和功能[14]。2010 年 Edith Browaeys-Poly等[17]经 实验发现GRB14能够与FGFR相互作用,而纤维母细胞生长因子(FGF)是脊椎动物发育和组织生长和发育的决定性调节器,因此,GRB14可能在脊椎动物的生长发育上起作用。目前为止,grb14基因的多态性与牛生长发育性状的相关性研究还尚未见报道。
4 展望
鉴于目前在小鼠和人上的研究发现GRB14在胰岛素信号和FGF信号途径上具有重要作用。因此,GRB14可能在脊椎动物发育中起着一定的作用,它可能对肉牛的生长发育起到非常重要的影响。所以我们可以把grb14基因作为一个候选基因,利用SSCP和RFLP等分子遗传标记方法来研究其在动物遗传育种上的作用[18]。研究grb14基因的突变性对家畜经济性状的影响无疑具有非常重要的理论和经济意义,以便为黄牛品种改良和选育工作提供理论依据。
[1] E Lucas-Fernández,I García-Palmero,A.Villalobo:Genomic,Organization and Control of the Grb7Gene Family[J].Current Genomics,2008,9:60-68.
[2] Ensembl Genome Database.http://www.ensembl.org/index.html
[3] GenBank NCBI Database.http://www.ncbi.nlm.nih.gov/sites/entrez?db=gene
[4] Daly R J,Sanderson G M,Janes P W,et al.Cloning and characterization of GRB14,a novel member of the GRB7gene family[J].J.Biol.Chem.,1996,271:12502-12510.
[5] Kairouz R,Parmar J,Lyons R J,et al.Hormonal regulation of the Grb14signal modulator and its role in cell cycle progression of MCF-7human breast cancer cells[J].J.Cell.Physiol,2005,203:85-93.
[6] Kasus-Jacobi A,Perdereau D,Auzan C,et al.Identification of the rat adapter Grb14as an inhibitor of insulin actions[J].J.Biol.Chem.,1998,273:26026-26035.
[7] Reilly J F,Mickey G,Maher P A.Association of fibroblast growth factor receptor 1with the adaptor protein Grb14:characterization of a new receptor binding partner[J].J.Biol.Chem.,2000,275:7771-7778.
[8] Bereziat V,Kasus-Jacobi A,Perdereau D,et al.Inhibition of insulin receptor catalytic activity by the molecular adapter Grb14[J].J Biol Chem,2002,277:4845-4852.
[9] Stein E G,Gustafson T A,Hubbard S R.The BPS domain of Grb10inhibits the catalytic activity of the insulin and IGF-1receptors[J].FEBS Lett,2001,493:106-111.
[10] Saltiel A R.New perspectives into the molecular pathogenesis and treatment of type 2diabetes[J].Cell,2001,104:517-529.
[11] Cariou B,Perdereau D,Cailliau K,et al.The adapter protein ZIP binds Grb14and regulates its inhibitory action on insulin signaling by recruiting Protein Kinase C zeta[J].Mol Cell Biol,2002,22:6959-6970.
[12] Grose R,Dickson C.Fibroblast growth factor signaling in tumorigenesis[J].Cytokine Growth Factor Rev,2005,16:179-186.
[13] Eswarakumar V P,Lax I,Schlessinger J.Cellular signaling by fibroblast growth factor receptors[J].Cytokine Growth Factor Rev.,2005,16:139-149.
[14] Bertrand Cariou,Veronique Bereziat,Karine Moncoq,et al.Regulation and functional roles of GRB14[J].Frontiers in Bioscience,2004,9:1626-1636.
[15] Daly R J,Sanderson G M,Janes P W,et al.Cloning and char-acterization of GRB14,a novel member of the GRB7family[J].J.Biol.Chem,1996,271:12502-12510.
[16] Reilly J F,Mickey G,Maher P A.Association of fibroblast growth factor receptor 1with the adaptor protein Grb14.Characterization of a new receptor binding partner[J].J.Biol.Chem,2000,275:7771-7778.
[17] Browaeys-Poly E,Blanquart C,Perdereau D,et al.Grb14inhibits FGF receptor signaling through the regulation of PLCγ recruitment and activation[J].FEBS Letters,2010,584:4383-4388.
[18] 田万强.分子遗传标记与家畜育种进展[J].中国牛业科学,2008,34 (5):40-43.
