不同缺血后处理对大脑中动脉闭塞/再灌注大鼠排斥导向分子a表达的影响
2012-08-02孔渝菡秦新月郭振委
孔渝菡 秦新月 郭振委
(重庆医科大学附属第一医院神经内科 重庆市神经病学重点实验室,重庆 400016)
脑缺血后处理(IPC)即在脑缺血后再灌注(I/R)初期通过各种物理或药物方式实施的一种干预手段,是近年来发现的能减少缺血性脑损伤的方法,但其最佳实施策略及具体保护机制仍存在争议〔1〕。本研究拟探讨对大脑中动脉闭塞(MCAO)/再灌注大鼠实施不同方式的IPC对其梗死体积的影响,同时观察海马排斥导向分子a(RGMa)这一神经再生中的排斥性导向分子在几种缺血后处理中的表达,以寻找最有效的IPC方法及推测其可能机制。对于临床上缺血性脑血管疾病的防治具有积极的作用。
1 材料与方法
1.1 实验动物及分组 成年(12周龄)SD大鼠,雌雄各半共90只,由重庆医科大学实验动物中心提供,实验动物生产许可证号SCXK(渝)2007-0001。成年SD大鼠随机分为假手术组、大脑中动脉IR模型组、IPC-S组(颈总动脉10 s×6次循环)、IPC-M组(颈总动脉5 min×3次循环)、远隔缺血后处理(RIPC)组、延迟后处理(DIPC)组。实验过程中动物饲养及取材均遵守实验动物管理和保护有关规定。
1.2 主要试剂和仪器 2,3,5-三苯基氯化四唑(TTC)(美国Amresco公司)、兔多克隆抗RGMa抗体(英国Abcam公司)、免疫组化试剂盒、二氨基联苯胺(DAB)显色试剂盒(北京中杉生物技术有限公司)、RNA提取液Trizol、RT-PCR反应试剂盒(大连宝生物工程有限公司)、焦碳酸二乙酯(DEPC)(美国Sigma公司)、逆转录聚合酶链反应(RT-PCR)引物合成(重庆升博生物技术公司)、PCR预混酶(天根生化科技有限公司)、凝胶扫描成像系统 ChemiDoc xRS(美国 Bio-Rad公司)、梯度 PCR仪(美国 Bio-Rad 公司)。
1.3 脑梗死模型及缺血后处理实施方案 大鼠用3.5%水合氯醛(1 ml/100 g)腹腔注射麻醉,根据Longa等〔2〕方法制作线栓法大脑I/R模型。IPC-S组:同时阻断双侧颈总动脉血流10 s,恢复血流10 s,如此进行6次缺血/再灌注循环过程;IPCM组:双颈总动脉5 min×3次循环;RIPC组:右股动脉5 min×3次循环;DIPC组:缺血24 h后双颈总动脉5 min×3次循环。1.4 脑梗死体积测定 大鼠I/R 48 h后,腹腔注射3.5%水合氯醛深度麻醉并处死取脑。在大脑中动脉供血区域前后做2 mm厚连续冠状切片5片,脑片置于2%TTC溶液中于37℃水箱避光孵育30 min,用0.1 mol/L磷酸缓冲溶液(PBS)冲洗2~3次,4%多聚甲醛缓冲液(PFA)固定。数码相机拍照后使用Image-Pro Plus(IPP)6.0分析软件 (美国 Media Cybernetics公司)计算脑梗死容积。
1.5 RT-PCR检测不同 IPC组 RGMa mRNA表达 从 Gene Bank中找出RGMa和β-actin的基因序列,设计上、下游引物分别 为 5′-GCTGGATGGATGGGTATGGG-3′和 5′-GCCGCAGTGAGTGTAGTTGG-3′扩增片段长度 456 bp。β-actin 为内参对照其上、下游引物分别为 5′CGTAAAGACCTCTATGCCAACA-3′和 5′-CGGACTCATCGTACTCCTGCT-3′,扩增片段长度 229 bp。取各组缺血侧大脑中动脉供血区皮质及海马于液氮中保存。Trizol法提取总RNA,经逆转录及PCR反应,扩增产物5 μl在2%琼脂糖凝胶上电泳,凝胶成像仪下观察并照相。用Quantity One(美国Bio-Rad公司)分析,以扩增后RGMa与β-actin电泳条带平均光密度比值表示RGMa mRNA的相对表达量。
1.6 免疫组织化学检测RGMa蛋白表达 大鼠过度麻醉后经心脏灌注PBS 200 ml和4%PFA 400 ml后立即断头取脑,放入4%PFA中固定,24 h后石蜡包埋,制作4 μm石蜡切片用作免疫组织化学观察。在显微镜下观察阳性细胞并拍照,用IPP 6.0分析软件测量分析其光密度值。
2 结果
2.1 不同IPC对脑梗死体积的影响 假手术组脑片呈深红色,无缺血区,再灌注后的其他组均可见明显的呈白色不规则的梗死灶,I/R梗死体积百分比明显升高(P<0.01)。与I/R组比较,IPC-S组梗死体积百分比明显降低(P<0.01),RIPC与IPC-M组也有不同程度降低(P<0.05),DIPC组梗死面积减少不明显。见表1,图1。
表1 各组大鼠脑梗死体积、缺血侧及不同缺血后处理RGMa mRNA及蛋白表达比较(±s,n=15)

表1 各组大鼠脑梗死体积、缺血侧及不同缺血后处理RGMa mRNA及蛋白表达比较(±s,n=15)
与假手术组相比:1)P<0.01,2)P<0.05;与I/R组相比:3)P<0.01,4)P<0.05
组别 假手术组 I/R组 IPC-S组 RIPC组 DIPC组 IPC-M组梗死体积(%) 0.00±0.00 33.14±6.151) 16.38±3.681)3) 25.64±4.911)3) 30.60±4.151) 26.82±4.291)4)皮质 0.31±0.06 0.70±0.171) 0.44±0.101)3) 0.51±0.101)4) 0.62±0.061) 0.53±0.121)4)海马 0.34±0.05 0.63±0.041) 0.43±0.062)3) 0.51±0.081)3) 0.58±0.071) 0.53±0.031)3)
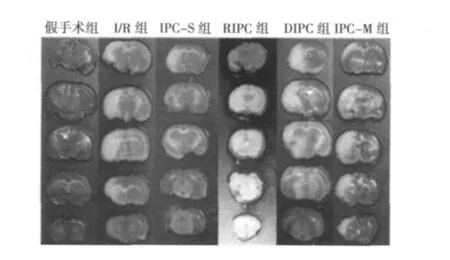
图1 TTC染色检测脑梗死体积
2.2 不同IPC对大鼠缺血侧RGMa mRNA表达的影响 见表1,图2,图3。与假手术组相比,缺血MCAO/再灌注48 h后模型组和缺血IPC各组缺血侧皮质RGMa mRNA的表达明显增高(P<0.01);各IPC组与MCAO/再灌注组比较显示,除延迟后处理组外,各缺血后处理后缺血侧皮质RGMa mRNA的表达均有不同程度减少(P<0.01或P<0.05)。

图2 大鼠缺血皮质部位RGMa mRNA表达
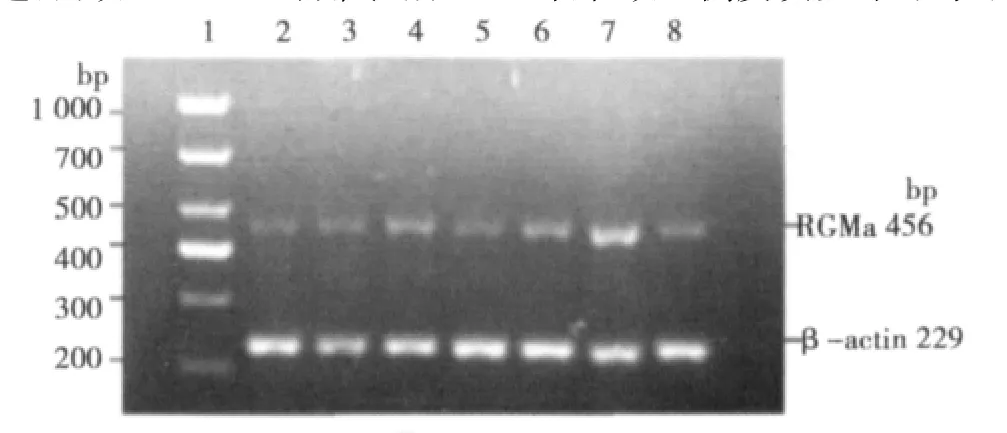
图3 大鼠缺血海马部位RGMa mRNA表达
2.3 不同方式缺血处理对大鼠缺血侧RGMa蛋白表达的影响在假手术组,皮质及海马区域可见少量RGMa蛋白阳性表达,而缺血MCAO/再灌注后48 h时,在缺血侧皮质及海马均可见RGMa蛋白阳性表达明显增高,与假手术组相比较有显著性差异(P<0.01);在给予IPC之后,RGMa蛋白的阳性表达水平明显降低(P<0.01),但是仍未恢复到缺血前水平(P<0.01)。见表 2,图 4。
表2 各组大鼠缺血侧RGMa蛋白表达(±s,n=15)

表2 各组大鼠缺血侧RGMa蛋白表达(±s,n=15)
组别 假手术组 IR IPC-S组 RIPC组 DIPC组 IPC-M组皮质 0.34±0.08 0.77±0.081) 0.57±0.071)3) 0.67±0.041)3) 0.73±0.041) 0.69±0.041)2)海马 0.30±0.05 0.73±0.051) 0.55±0.041)3) 0.60±0.071)3) 0.70±0.041) 0.67±0.041)2)
与假手术组相比:1)P<0.01;与I/R组相比:2)P<0.01;与I/R组相比:3)P<0.05
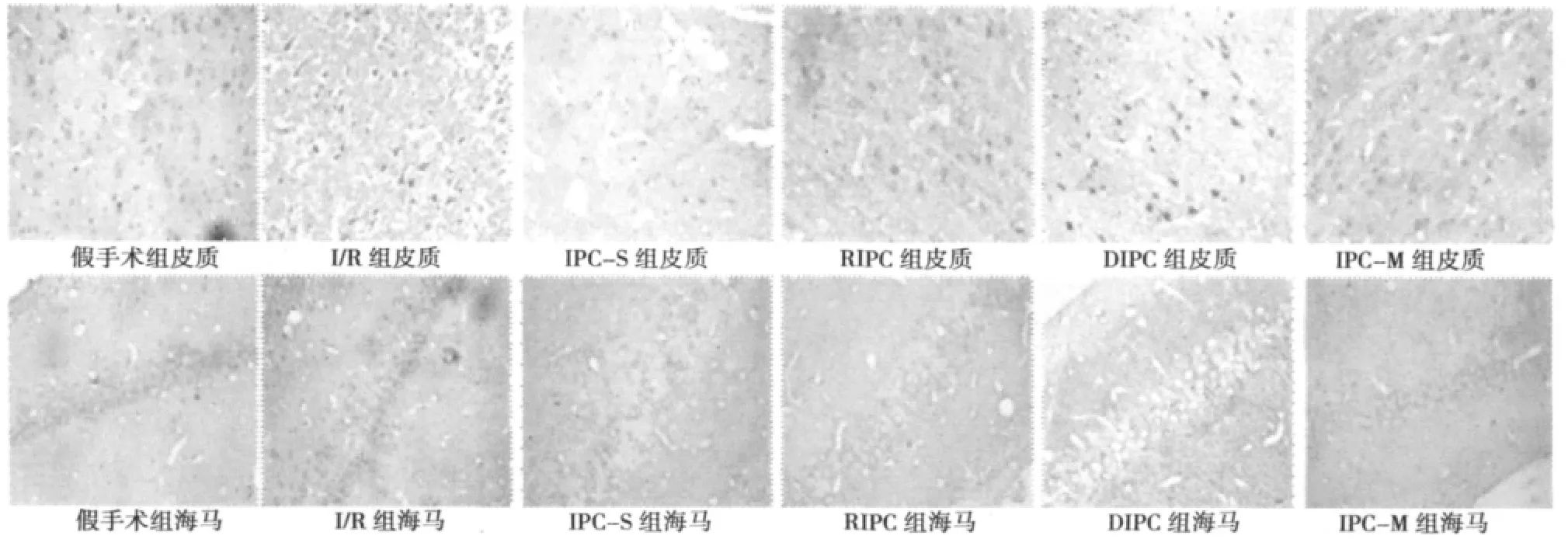
图4 不同缺血后处理后缺血侧RGMa表达(×200)
3 讨论
早期意义上的IPC是偶然发现的几例心肌梗死的病人中,由于短暂的逐渐恢复冠状动脉血供减少了后来发生的心房纤颤,研究人员逐渐开始关注这种方式的心脏保护作用〔3〕。相比缺血预处理在外科范围的应用,IPC具有更广泛的临床上的可观察、可操控性。本实验设计的两种不同时间的近端IPC,一种肢体远隔后处理及一种延迟后处理方式,意义在于它们均可临床中通过按、捆压的方式实现,同时本文观察了这几种缺血后处理方式能够实现的脑保护效果。
本研究发现在再灌注初期进行的夹闭双侧颈总动脉持续数秒至数分钟的几个循环均能起到减少脑梗死体积的作用,并且再灌注初期进行下肢的远隔后处理每个循环数分钟也能起到类似的效果。然而再灌注24 h后进行的IPC却未能达到脑保护作用,这说明IPC存在治疗时间窗的问题。Burda等〔4〕报道在脑缺血48 h后进行后处理发现能减少脑损伤,于是提出IPC的延迟治疗时间在48 h内,但其所用的动物模型是全脑缺血模型,和本研究观察的局灶性缺血模型不一致。而Ren等〔5〕研究使用MCAO在缺血3、6、12 h后进行后处理,发现6 h内进行后处理均有不同程度的脑保护效果,未有进行更长时间的尝试。Pignataro等〔6〕在体外实验也尝试皮质神经元糖氧剥夺后10、30或60 min后处理只有10 min组具有神经保护作用,提出后处理的起始时间和处理时长对结果有重要影响。这与本实验的结论基本一致。说明局灶性缺血模型的后处理治疗时间窗还有待确定,至少并没有全脑缺血模型中提到的那么乐观。目前公认的还是只有早期的后处理才能达到理想的效果。
目前已知的可能参与IPC器官保护的机制包括减少自由基产生、改善内皮功能、保护血脑屏障的完整、减少炎症、抑制凋亡通路以及减少活性氧(ROS)相关分子的激活〔1,6,7〕,RGMa 是近年来新发现的一种轴突导向分子,它与其受体Neogenin结合后导致生长锥塌陷,抑制轴突再生〔8~10〕。本研究提示RGMa在缺血的过程中被激活而可能参与IR损伤后神经损伤及修复,而IPC-S组神经损伤最少。结合目前国内外研究现状,本研究认为IPC采用早期、短时程的多次循环是最佳策略,且方式可以是近端阻断颈总动脉及远端阻断肢体大动脉血流等多种方式,其中在离缺血灶更近的血管实施可取得更好疗效。IPC脑保护的分子机制可能与抑制RGMa及其受体结合,减少轴突损伤有关。
1 Zhao H.Ischemic postconditioning as a novel avenue to protect against brain injury after stroke〔J〕.J Cereb Blood Flow Metab,2009;29(5):873-85.
2 Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats〔J〕.Stroke,1989;20(1):84-91.
3 Na HS,Kim YI,Yoon YW,et al.Ventricular premature beat-driven intermittent restoration of coronary blood flow reduces the incidence of reperfusion-induced ventricular fibrillation in a cat model of regional ischemia〔J〕.Am Heart J,1996;132(1 Pt 1):78-83.
4 Burda J,Danielisova V,Nemethova M,et al.Delayed postconditionig initiates additive mechanism necessary for survival of selectively vulnerable neurons after transient ischemia in rat brain〔J〕.Cell Mol Neurobiol,2006;26(7-8):1141-51.
5 Ren C,Gao X,Niu G,et al.Delayed postconditioning protects against focal ischemic brain injury in rats〔J〕.PLoS One,2008;3(12):e3851.
6 Pignataro G,Meller R,Inoue K,et al.In vivo and in vitro characterization of a novel neuroprotective strategy for stroke:ischemic postconditioning〔J〕.J Cereb Blood Flow Metab,2008;28(2):232-41.
7 Zhou Y,Fathali N,Lekic T,et al.Remote limb ischemic postconditioning protects against neonatal hypoxic-ischemic brain injury in rat pups by the opioid receptor/akt pathway〔J〕.Stroke,2011;42(2):439-44.
8 尹红蕾,秦新月.RGMa及其在缺血性脑损伤后中枢神经再生中的作用〔J〕. 神经损伤与功能重建,2008;3(3):199-200.
9 Schnichels S,Heiduschka P,Julien S.Different spatial and temporal protein expressions of repulsive guidance molecule a and neogenin in the rat optic nerve after optic nerve crush with and without lens injury〔J〕.J Neurosci Res,2011;89(4):490-505.
10 Endo M,Yamashita T.Inactivation of Ras by p120GAP via focal adhesion kinase dephosphorylation mediates RGMa-induced growth cone collapse〔J〕.J Neurosci,2009;29(20):6649-62.
