福建省商业猪种MUC13、IGF2和RYR1基因主效位点的遗传变异分析
2012-08-01阮国荣肖石军刘亚轩陈金雄江宵兵
阮国荣,肖石军,徐 盼,刘亚轩,陈金雄,江宵兵
(1.福建农业职业技术学院,福建 福州 350119;2.江西农业大学 动物生物技术国家重点实验室培育基地,江西南昌 330045;3.福建光华百斯特生态农牧有限公司,福建 尤溪 365100;4.福建省畜牧畜医总站,福建 福州 350003)
随着养猪业集约化、专业化水平的不断提高,培育杜洛克、长白、大白等主流商业品种内各具特色的专门化新品系,通过配合力测定建立配套系已成为世界种猪业发展的主导方向,国际大型猪育种公司都已把培育多元化品系作为应变未来不同市场需求的策略。鉴别和应用重要经济性状的主效基因或分子标记,建立分子标记聚合育种、全基因组选择等新型高效育种手段,结合常规育种技术,以配套系的形式持续选育提高引进商业猪种,是未来我国养猪业发展的必由之路[1-3]。
本研究选择3个对养猪生产具有显著影响的主效基因位点,包括决定新生仔猪产肠毒素大肠杆菌(ETEC)F4ac腹泻易感性的MUC13基因[4],影响生长速度和背膘厚的类胰岛素生长样因子2(IGF2)基因内含子3 g.3072G>A突变[5-9],决定氟烷敏感抗性的兰定尼受体1(RYR1)基因 c.1843 C>T位点[10-11],采用PCR-RFLP或PCR-SNaPshot方法,在福建厦门、福清、三明、龙岩等6家大型种猪场的杜洛克、长白、大白等引进猪种核心育种群中,对MUC13、IGF2和RYR1基因主效突变位点进行检测,应用于各猪场核心群的选育改良,以期降低猪群的腹泻发病率,提高猪产肉量,剔除氟烷应激敏感基因。
1 材料与方法
1.1 实验动物
实验动物来自福建光华百斯特生态农牧发展有限公司、厦门国寿种猪开发有限公司、福建永诚畜牧有限公司、龙岩市龙马畜牧饲料有限公司种猪场、龙岩市万龙原种猪发展有限公司、龙岩市晨兴养殖有限公司等6家种猪场。样本总数1 879头,其中杜洛克629头,长白627头,大白623头。采样时将待检测猪的耳尖用酒精消毒后,用耳号钳剪取耳组织样品2~3 g,放入盛有体积分数为75%酒精的1.5 mL Eppendorf管内,低温保存。采用常规的苯酚/氯仿/异戊醇法提取基因组DNA,统一稀释至20 ng/μL。
1.2 基因型判定
PCR引物由上海生工生物有限公司合成。各主效基因位点的引物序列及其判型方法见表1。PCR反应体系总体积为 20 μL,包括模板 DNA 40 ng,10 × buffer 2.0 μL,25 mmol/LMgCl21.2 μL,10 mmol/L dNTP 0.3 μL,Fp 0.4 μL,Rp 0.4 μL,Taq 聚合酶 0.5 μL,超纯水 13.2 μL。PCR 循环参数:94℃变性3 min,94℃ 30 s,退火温度(表1)30 s,72℃延伸45 s,共36个循环。

表1 PCR引物及其判型方法Tab.1 PCR primer and genotyping methed
1.2.1 PCR-SNaPshot法 采用PCR-SNaPshot判定MUC13和IGF2基因型,反应体系为5 μL,包含1.5 μL 纯化后PCR 产物,2 μL SNaPshot multiplexmix(含Taq聚合酶和荧光标记的dd -NTPs),1.2 μL 去离子水,0.3 μL SNaPshot引物。SNaPshot反应体系的扩增程序为:96 ℃ 10 s,50 ℃ 5 s,60 ℃ 30 s,25个循环。然后,在SNaPshot反应产物中加0.57 μL 1 × NEB buffer和0.1 μL的CIP纯化酶,37℃反应60 min以清除荧光标记的ddNTPs,随后75℃反应15 min灭活纯化酶。最后,每1 μL SNaPshot反应产物加8 μL Hi-Di formamide与GeneScan 120 LiZ size standard混合物(两者比例为20∶1),经变性后上样于 ABI 3130XL 遗传分析仪(ABI,USA)进行电泳,利用 GeneMapper Software version 4.0(ABI,USA)进行基因型判定和数据收集。
1.2.2 PCR-RFLP法 利用 Hha I PCR-RFLP法检测 RYR1.c.1843 C>T位点的基因型,PCRRFLP检测酶切反应体系及条件为:PCR产物6 μL,Hha I内切酶1U(NEB,英国),酶切缓冲液1.5 μL,加水至总体积为15 μL。37℃水浴4 h以上或过夜。当RYR1基因型为NN时,Hha I可将PCR扩增的659 bp特异片段酶切成493 bp和166 bp两条带;当HAL基因型为nn时,HhaI限制酶识别位点消失,电泳后只有659 bp 1条带;当HAL基因型为Nn时,可以观察到659 bp、493 bp、166 bp 3条带。
2 结果与分析
2.1 MUC13基因的基因频率和基因型频率
各品种的MUC13基因型频率及基因频率的分布见表2。结果表明,各品种均有一定程度的有利等位基因,杜洛克有利(抗性)等位基因频率最高,达0.892。
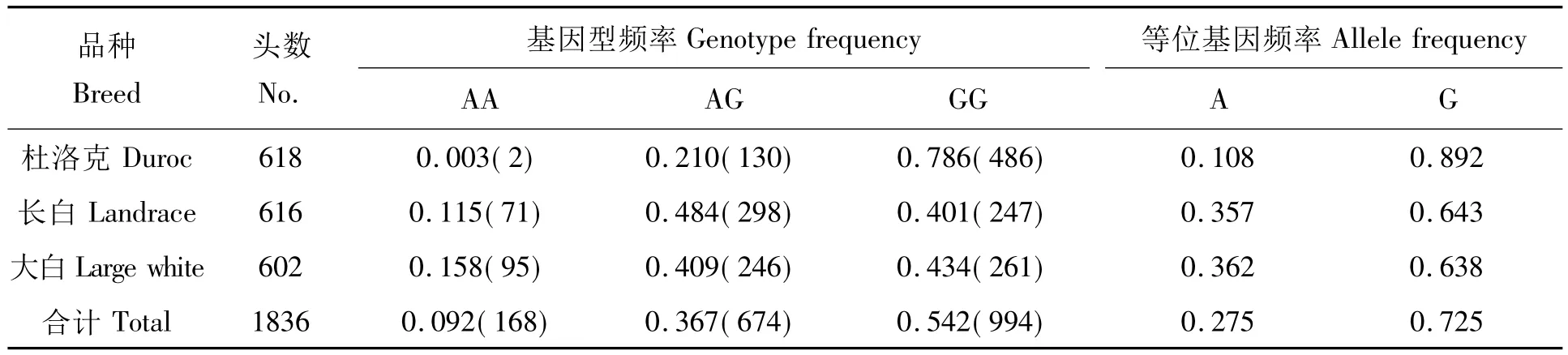
表2 各品种MUC13基因的基因型频率和基因频率Tab.2 The genotype and allele frequency of MUC13 in the tested breed
2.2 IGF2基因的基因频率和基因型频率
各品种IGF2 intro3 g.3072G>A基因型频率及基因频率的分布见表3。结果表明:杜洛克群体有利基因频率为0.933,A等位基因在杜洛克中已基本纯合,这与Objeda等[12]研究结果一致。长白猪和大白猪均有较高的A等位基因频率,分别为0.742和0.826。
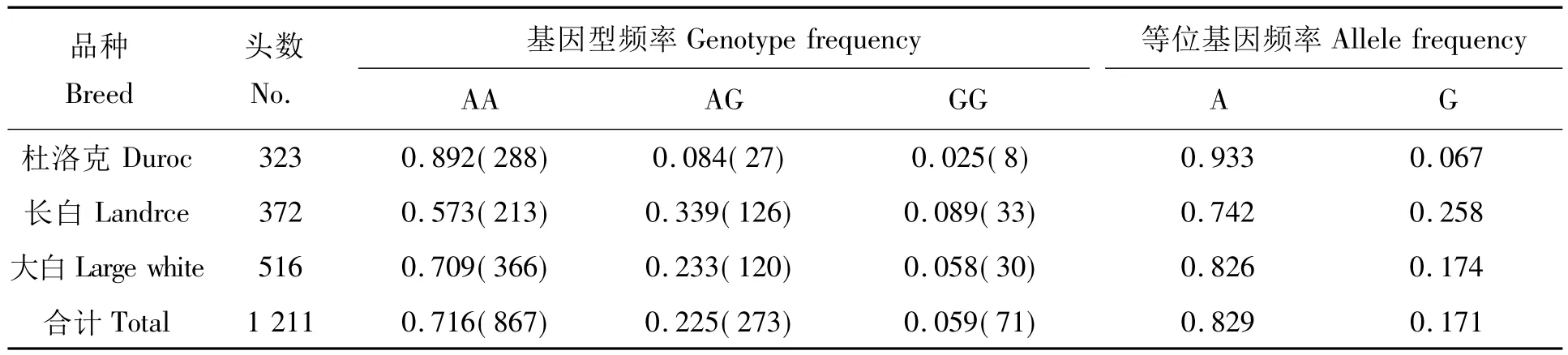
表3 各品种IGF2基因的基因型频率和基因频率Tab.3 The genotype and allele frequency of IGF2 in the tested breed
2.3 RYR1基因的基因频率和基因型频率
各品种RYR1 c.1843 C>T基因型频率及基因频率的分布见表4。结果表明:各品种群体均有极高的有利基因型频率,仅有1家猪场有1头nn基因型氟烷应激个体;每个猪场杜洛克、长白、大白群体有少量的Nn基因型杂合子,以杜洛克群体Nn基因型个体比例为高,达10.2%。
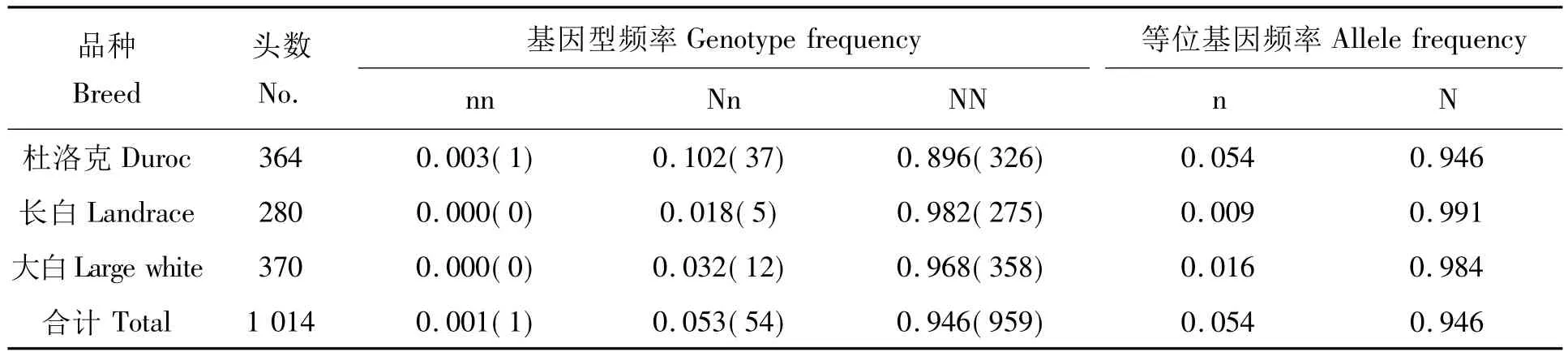
表4 各品种RYR1基因的基因型频率和基因频率Tab.4 The genotype and allele frequency of RYR1 in the tested breed
2.4 不同品种RYR1、IGF2与MUC13的基因型组合分布
杜洛克、长白、大白猪群RYR1、IGF2与 MUC13基因型组合分布见图 5,6,7。
结果表明:在所检测的群体
中,杜洛克猪群 RYR1、IGF2、MUC13基因均为有利基因型组合NN/AA/GG的个体数为212头,占群体总量的65.4%(212/324);长白猪群有利基因型组合
NN/AA/GG的个体数为73头,占群体总量的19.9%(73/367);大白猪群有利基因型组合NN/AA/GG的个体数为143头,占检测群体总量的 28.4%(143/503)。
3 讨论
3.1 关于MUC13基因的选育
断奶前仔猪腹泻是养猪生产中的常见疾病,给世界养猪业造成了巨大的经济损失。据保守估计,我国每年至少有1 000万头断奶前仔猪腹泻致死病例,由此
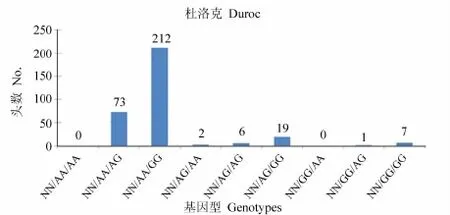
图1 杜洛克猪群RYR1、IGF2与MUC13的基因型组合分布图Fig.1 Distribution of RYR1,IGF2,MUC13 genotype combinations in duroc pigs
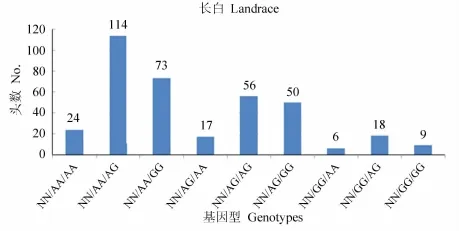
图2 长白猪群RYR1、IGF2与MUC13的基因型组合分布图Fig.2 Distribution of RYR1,IGF2,MUC13 genotype combinations in landrace pigs
造成巨额经济损失。而产肠毒素大肠杆菌(ETEC)F4ac是引发断奶前仔猪腹泻的最主要致病菌。江西农业大学动物生物技术国家重点实验室培育基地自2002年以来,通过全基因组连锁定位分析、目的区域的断点重组分析和远缘群体的高通量SNPs标记关联性分析等严谨的遗传研究手段,确定了MUC13为决定断奶前仔猪腹泻易感性的ETEC F4ac受体基因。通过来自292头纯种及1 315杂种个体的屠宰测定验证,发现了对ETEC F4ac易感和抗性个体鉴别准确率大于97%的关键突变位点,由此建立了高精准度的、具有完全自主知识产权的断奶前仔猪腹泻抗病育种新技术。
本研究对MUC13的关键变异位点进行了检测,结果显示,杜洛克群体有利(抗性)等位基因频率很高,这与生产上杜洛克种猪腹泻比例总体较低现状吻合,杜洛克猪群只需进行少量个体的淘汰,其中AA基因型公母猪、AG基因型公猪一次性淘汰,AG基因型母猪根据生产性能尽量减少选留,经过2~3个世代选育即可育成抗断奶前ETEC F4ac腹泻纯系。长白、大白猪群不利等位基因频率较高,表明需要经过多世代选育,在兼顾表型选择和性能测定的前提下,逐世代加大GG纯合抗性个体的选留比例,逐步淘汰AA和GA易感型个体,使育种群中有利基因频率加大,以增加种群对仔猪腹泻的抗性。
现场选种实践中,为了提高新生仔猪腹泻抗性,建议采用两阶段选育的育种策略。在仔猪出生时采集耳样进行MUC13基因检测,根据基因型选择合适数量的群体进行性能测定,性能测定结束后,利用个体性能测定数据结合系谱信息,根据EBV指数的高低排序,由高至底进行选种。具体选配时优先选择抗性公猪配种;需要使用易感公猪时,尽量使用杂合子个体;尽量避免抗性母猪与易感公猪配种。然而,仔猪腹泻受多种因素影响(细菌/病毒/寄生虫/营养/饲养管理),在开展基因育种的同时,仍需兼顾免疫、饲料和环境控制等方面,以进一步降低仔猪(特别是断奶仔猪)腹泻的发病率。
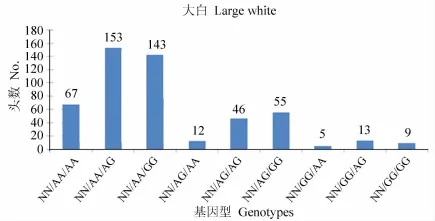
图3 大白猪群RYR1、IGF2与MUC13的基因型组合分布图Fig.3 Distribution of RYR1,IGF2,MUC13 genotype combinations in large white pigs
3.2 关于IGF2基因的选育
杜洛克、长白、大白是目前我国养猪生产中的主流商业猪种,均为高度选育品种,特别在产肉性能方面经历了强选择压力。本研究揭示IGF2增加产肉量的有利基因频率在这些品种中的频率较高,符合品种的选育历史现状。在选育过程中,对于专门化父系,建议淘汰GG型个体,GA个体若是母猪可以保留;若是公猪,在条件许可的情况下予以淘汰。通过2~3个世代的选育,有望将有利等位基因A在种群中固定。在纯繁或杂交生产商品猪时,尽量选择AA型公猪个体,以提高后代的生长性能。
Stinckens等[13]在大规模生产母猪群体(包括555头来自合成系母猪以及111 330头纯种长白母猪)中开展了IGF2基因g.3073 G>A的检测及其与母猪繁殖性状的相关性分析,结果表明来自父本的有利于肌肉生长和瘦肉率的AA等位基因型与母猪的产仔数及使役年限呈显著负相关,并推测这种负面效应可能是由于瘦肉率的增加和低脂肪沉积所致。该研究揭示了IGF2基因QTN(g.3073 G>A)效应对于种母猪具有两面性:一方面能够增加胴体瘦肉率与降低背膘厚,另一方面会造成母猪的产仔数及使役年限的下降。基于此,针对IGF2基因的专门化品系选育最佳模式为:父系应该持续选留能够增加瘦肉率的AA基因型个体,而母系应该选择能够提高母猪繁殖力的GG型个体。由于IGF2基因为父本印迹基因[14-15],来自于母本的G等位基因在后代中被沉默,因而不会影响商品代个体的瘦肉率。采用这种模式进行配套系选育时,最终的商品猪既可提高生长速度,又可兼顾产仔数。本研究中的IGF2 g.3073 G>A的检测结果将有利于受试种群的分化定向选育改良。
3.3 关于RYR1基因的检测
在本研究中,各受试群体的氟烷敏感抗性基因频率很高,但一部分群体仍存在一定频率的敏感基因携带者,特别是部分杜洛克群体,这与采样调研时所了解到的种猪曾引进过台系杜洛克或掺有皮特兰血缘的杜洛克品系有关。根据本检测结果,各采样场杜洛克、长白、大白种群尽量选留NN基因型进行纯种繁育,可建立氟烷敏感应激阴性猪群。
3.4 关于多基因聚合育种
RYR1、IGF2与MUC13的NN/AA/GG有利等位基因型组合个体比例在各猪场、各品种差异较大,以杜洛克群的65.4%为最高,大部分小于20%,由此可见,在兼顾表型和性能测定的情况下,需经过多世代选育才能达到将此三个主效位点有利等位基因选育纯合的目的,杜洛克选育较之大白、长白更易于育成纯合品系。
致谢:感谢厦门国寿种猪开发有限公司、福建永诚畜牧有限公司、福建光华百斯特生态农牧发展有限公司、龙岩市龙马畜牧饲料有限公司种猪场、龙岩市万龙原种猪发展有限公司、龙岩市晨兴养殖有限公司等积极协助本实验样品采集;感谢江西农业大学任军博士对基因检测实验的指导和论文的修改。
[1]Andersson L,Georges M.Domestic-animal genomics:deciphering the genetics of complex traits[J].Nature Review Genetics,2004,5:202 -212.
[2]Evans G J.Identification of quantitative trait loci for production traits in commercial pig populations[J].Genetics,2003,164:621-627.
[3]Andersson L.Genetic dissection of phenotypic diversity in farm animals[J].Nat Rev Genet,2001(2):130 - 138.
[4]Ren J,Tang H,Yan X M,et al.A pig-human comparative RH map comprising 20 genes on pig chromosome 13q41 that harbours the ETEC F4ac receptor locus[J].Journal of Animal Breeding and Genetics,2009,126:30 -36.
[5]Van Laere A,Nguyen M,Braunschweig M,et al.A regulatory mutation in IGF2 causes a major QTL effect on muscle growth in the pig[J].Nature,2003,425:832 -836.
[6]Jeon J T.A paternally expressed QTL affecting skeletal and cardiac muscle mass in pigs maps to the IGF2 locus[J].Nature Genet,1999,21:157 -158.
[7]Yang G C,Ren J,Guo Y M,et al.Genetic evidence for the origin of an IGF2 quantitative trait nucleotide in Chinese pigs[J].Animal Genetics,2006,37:179 -180.
[8]Florini J R,Ewton D Z,McWade F J.IGFs,muscle growth,and myogenesis[J].Diabetes Rev,1995(3):73 -92.
[9]Amarger V.Comparative sequence analysis of the Insulin - IGF2 - H19 gene cluster in pigs[J].Mamm Genome,2002,13:388-398.
[10]Fujii J.Detection of the HAL gene in swine:a point mutation in the skeletal muscle rynodine receptor gene(RYR1)[J].Animal Genetics,1993,21:56 -61.
[11]丁能水,周利华,黄路生,等.氟烷基因对猪繁殖性能影响的研究[J].江西农业大学学报,1999,21(4):552-554.
[12]Ojeda A,Huang L S,Ren J,et al.Selection in the making:A worldwide survey of haplotypic diversity around a causative mutation in porcine IGF2[J].Genetics,2008,178:1639 -1652.
[13]Stinckens A,Mathur P,Janssens S,et al:Indirect effect of IGF2 intron3 g.3072G > A mutation on prolificacy in sows[J].Anim Genet,2010,41:493 -498.
[14]Constancia,M.Deletion of a silencer element in Igf2 results in loss of imprinting independent of H19[J].Nature Genet,2000,26:203 -206.
[15]De Koning D J.Genome-wide scan for body composition in pigs reveals important role of imprinting[J].Proc Natl Acad Sci USA,2000,97:7947 -7950.
