阿托伐他汀对慢性肺心病缓解期患者循环EPCs、肺功能及血浆hs-CRP、IL-8的影响
2012-07-31
(聊城市人民医院,山东聊城 252000)
低氧性肺动脉高压(Hypoxic pulmonary artery hypertension,HPH)是临床常见的病理生理过程,是慢性阻塞性肺疾病(COPD)等多种心肺疾病发生、发展的重要环节,其主要病理改变为肺血管内皮功能失调和肺血管重建。肺细小动脉内皮损伤、管腔狭窄或堵塞及肺小动脉储备数量的减少在HPH发生、发展过程中起非常重要的作用[1],促进内皮修复和血管新生可能是一种有效的治疗策略。此外,HPH的发病与气道、肺实质、肺血管的慢性炎症反应密切相关,表现为中性粒细胞、T淋巴细胞和巨噬细胞在肺组织内增多;激活的炎症细胞释放一系列炎性介质,包括IL-8、高敏-C反应蛋白(hs-CRP)和其他能够破坏肺组织结构的介质。近年研究发现,内皮祖细胞(EPCs)是能直接分化为血管内皮细胞的前体细胞,参与出生后血管新生和内皮损伤后的修复过程[2,3];他汀类药物还有改善内皮功能、抗炎、抗氧化、抑制细胞增殖、诱导细胞凋亡等多种独立于调脂作用外的功能[4]。2008年9月~2010年12月,我们观察了阿托伐他汀对慢性肺源性心脏病(肺心病)缓解期患者循环EPCs数量、黏附及迁移功能与肺功能的影响,旨在为慢性肺心脏病的干细胞治疗及药物治疗提供理论依据。
1 资料与方法
1.1 临床资料 同期于我院确诊的慢性肺心病患者68例,男43例,女25例;年龄60~87(64.9±8.2岁,病程9~27 a。均符合1997年全国第2次肺源性心脏病专业会议修订的诊断标准,血气分析显示PaO2为(7.42 ±0.73)kPa,PaCO2为(8.35 ±0.41)kPa。纳入标准:处于疾病稳定期,即第1秒用力呼气容积(FEV1)占预计值百分比≤65%、FEV1/用力肺活量(FVC)≤70%,肺动脉收缩压>30 mmHg(1 mmHg=0.133 kPa);年龄≥60岁;按美国纽约心脏病学会NYHA分级方案心功能Ⅰ~Ⅱ级。排除标准:心脏瓣膜病、先天性心脏病、外伤、溃疡、视网膜病、近期外科手术、急性炎症、肿瘤及慢性肝、肾疾病史者,近3个月有急性心肌梗死发生。将68例患者随机分为治疗组33例和对照组35例。另选择本院同期健康体检者30例为正常组,其中男17例、女13例,年龄 60~85(62.4±9.3)岁。三组性别、年龄等一般资料具有可比性。
1.2 治疗方法 68例慢性肺心病患者均予鼻导管持续低流量吸氧、控制呼吸道感染、止咳化痰、平喘等治疗(见表1),在此基础上治疗组加用阿托伐他汀20 mg口服,每晚1次,连续治疗6个月。

表1 68例慢性肺心病患者的基线治疗(例)
1.3 临床指标观察
治疗组及对照组分别于治疗前及治疗后6个月,正常组于入组后次日检测下列指标(全部血浆标本的采集均在空腹、静卧状态下进行)。
1.3.1 循环EPCs数量及迁移、黏附能力 ①EPCs的分离、培养和鉴定:采用密度梯度离心法从受试者外周静脉血中分离单个核细胞(MNC),将其接种于包被有人纤维连接蛋白(HFN)的24孔培养板上,培养至第7天,分离贴壁细胞,加入DiL标记的乙酰化低密度脂蛋白(acLDL-DiL),37℃温育1 h,多聚甲醛固定,PBS浸洗,再加入FITC标记的荆豆凝集素I(FITC-UEA-I),温育1 h,于倒置荧光显微镜下观察,摄取acLDL-DiL并结合FITC-UEA-I(即双染色阳性)者为正在分化的EPCs。②EPCs数量:采用集落形成试验。在6孔板每孔置入5×106个MNC,孵育2 d时收集未贴壁细胞(包括EPCs),置入24孔板中,调整密度为1×106细胞/孔,继续培养5 d,计数每个样本中每孔的克隆数。③EPCs黏附能力:消化、收集培养的贴壁细胞,将同等数目的EPCs接种在24孔培养板上,培养30 min,用PBS洗去未贴壁的细胞,计数贴壁细胞。④EPCs迁移能力:消化、收集培养的贴壁细胞,将EBM-2培养液加入改良Boyden小室的下室,将 2×104个 EPCs悬浮在EBM-2培养基后注入上室,37℃培养24 h,刮去滤膜上面未移动的细胞,用甲醇固定,Giemsa染色,随机选择3个显微镜视野,计数迁移到底层的细胞。
1.3.2 肺功能、肺动脉压(PAP) 应用QuarkPFT4肺功能仪(意大利COSMED公司)测定肺功能指标FEV1及FVC;采用PhilipiE33彩色多普勒超声仪测定三尖瓣反流速度(V),用Bernoulli(柏努利)公式计算 PAP,PAP=4V2。
1.3.3 血浆hs-CRP、IL-8水平 采用 ELISA 法,严格按试剂说明书检测血浆hs-CRP、IL-8水平。hs-CRP试剂盒购自北京晶美生物工程有限公司,IL-8试剂盒购自eBioscience公司。
1.3.4 不良反应 主要包括血清AST、肌酸激酶升高及肌痛等。
1.4 统计学方法 采用SPSS11.0统计软件处理数据。计量数据以±s表示,均数间比较用方差分析、成组t检验或配对t检验。以P≤0.05为差异有统计学意义。
2 结果
2.1 循环EPCs数量及迁移、黏附能力 分离获得的MNC培养7 d后形成了梭形的内皮样细胞,具有EPCs的特性,可吞噬acLDL-DiL,结合凝集素后在倒置荧光显微镜下分别显示红色和绿色、双染色后呈黄色。治疗组和对照组治疗前循环EPCs数量及迁移、黏附能力均无显著差异,但两组均显著低于正常组(P均<0.01);治疗后治疗组上述指标均显著升高,且显著高于对照组(P均<0.05),见表2。
2.2 肺功能及PAP、hs-CRP、IL-8水平 治疗前治疗组和对照组肺功能指标及PAP、hs-CRP、IL-8比较P>0.05,但两组血浆 hs-CRP、IL-8 水平、PAP 均显著高于正常组(P均 <0.01),FVC、FEV1、FEV1/FVC等肺功能指标显著低于正常组(P均<0.01);治疗后治疗组FEV1、FEV1/FVC等肺功能指标明显升高(P<0.05),PAP、hs-CRP、IL-8 较同组治疗前和对照组均有明显降低(P均<0.05),见表3。
2.3 不良反应 治疗组口服阿托伐他汀期间1例出现AST升高2.8倍,1例出现肌痛、肌酸激酶升高2.2倍,停药后均降至正常。
表2 三组循环EPCs数量及迁移、黏附能力比较(±s)
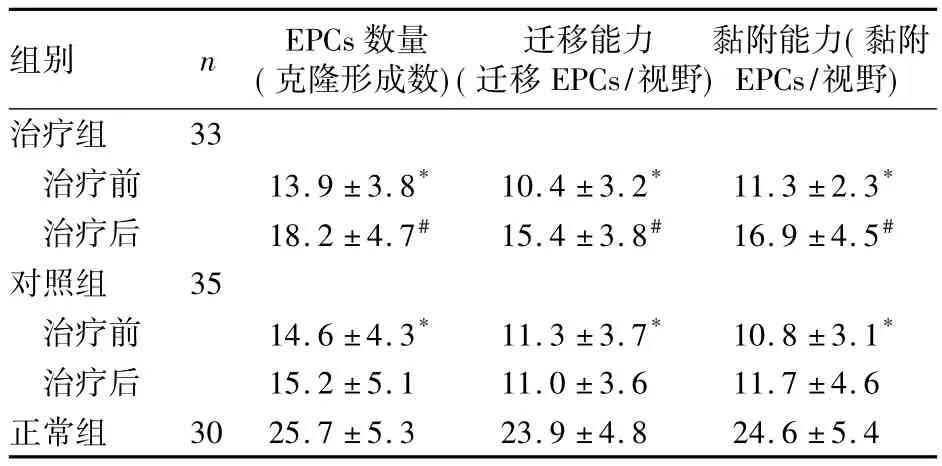
表2 三组循环EPCs数量及迁移、黏附能力比较(±s)
注:与正常组比较,*P<0.01;与同组治疗前及对照组治疗后比较,#P <0.05
组别 n EPCs数量(克隆形成数)迁移能力(迁移EPCs/视野)黏附能力(黏附EPCs/视野)治疗组33治疗前 13.9 ±3.8* 10.4 ±3.2* 11.3 ±2.3*治疗后 18.2 ±4.7# 15.4 ±3.8# 16.9 ±4.5#对照组 35治疗前 14.6 ±4.3* 11.3 ±3.7* 10.8 ±3.1*治疗后 15.2 ±5.1 11.0 ±3.6 11.7 ±4.6正常组30 25.7 ±5.3 23.9 ±4.8 24.6 ±5.4
表3 三组肺功能、PAP及hs-CRP、IL-8比较(±s)
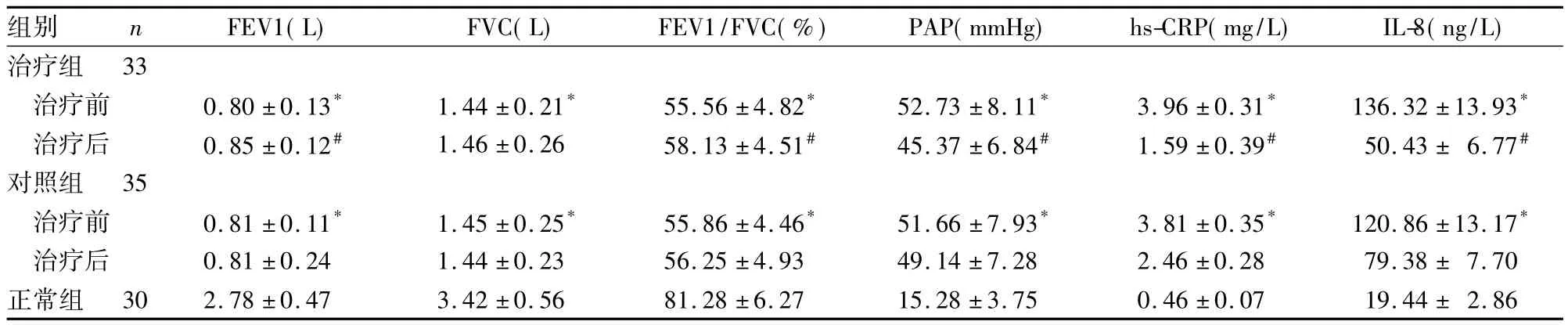
表3 三组肺功能、PAP及hs-CRP、IL-8比较(±s)
注:与正常组比较,*P<0.01;与同组治疗前及对照组治疗后比较,#P<0.05
组别 n FEV1(L) FVC(L) FEV1/FVC(%) PAP(mmHg) hs-CRP(mg/L) IL-8(ng/L)治疗组33治疗前 0.80 ±0.13* 1.44 ±0.21* 55.56 ±4.82* 52.73 ±8.11* 3.96 ±0.31* 136.32 ±13.93*治疗后 0.85 ±0.12# 1.46 ±0.26 58.13 ±4.51# 45.37 ±6.84# 1.59 ±0.39# 50.43 ± 6.77#对照组 35治疗前 0.81 ±0.11* 1.45 ±0.25* 55.86 ±4.46* 51.66 ±7.93* 3.81 ±0.35* 120.86 ±13.17*治疗后 0.81 ±0.24 1.44 ±0.23 56.25 ±4.93 49.14 ±7.28 2.46 ±0.28 79.38 ± 7.70正常组 30 2.78 ±0.47 3.42 ±0.56 81.28 ±6.27 15.28 ±3.75 0.46 ±0.07 19.44 ± 2.86
3 讨论
HPH是COPD发病过程中的中心环节,肺动脉高压的产生及严重程度可明显影响COPD和肺心病患者的病程及预后。近年来研究表明,内皮功能障碍在HPH的发生、发展中扮演重要角色,HPH患者存在肺血管器质性、功能性改变以及肺血管重构。EPCs是一类能增殖并分化为血管内皮细胞,但尚未表达成熟血管内皮细胞表型,也未形成血管的前体细胞。早期EPCs主要促进细胞归巢,分泌生长因子促进新生血管形成;而晚期EPCs则主要分化为成熟内皮细胞,直接对血管形成起作用,更适合移植、促进新生血管形成[5]。鉴于此,EPCs在HPH中的作用也引起了国内外学者的关注。新近研究证实,对于肺血管重构不可逆的肺动脉高压患者,其外周血 EPCs的数量以及活性存在明显下调[6,7]。刘海峰等[8]发现,随 COPD患者 PAP增高,外周血EPCs数量减少、黏附和迁移能力降低,肺小动脉自身修复能力降低。目前针对肺动脉高压的治疗存在下列局限:降低肺循环血压的药物对体循环血压也有降低作用,易导致全身性不良反应[9];血管内皮素、前列腺素等药物价格高,长期应用增加患者负担。对COPD所致肺动脉高压发病机制的深入研究发现,肺动脉高压的发生与多种细胞因子参与的炎症反应有关,缺氧、自身免疫性抗体、病原微生物等多种因素均可导致促炎症因子表达升高,激活炎症细胞和下游的信号传导通路启动增殖过程和炎性病变[10];同时,有研究表明COPD患者在低氧血症和肺功能降低前就已出现肺血管的改变,以血管周围炎性细胞浸润为主要特征[11]。上述研究结果提示,可以针对COPD患者的全身性非特异性炎症进行治疗,从而降低PAP。
他汀类药物是3-羟基-3-甲基戊二酰辅酶 A(HMG-CoA)还原酶抑制剂,通过竞争性抑制HMGCoA还原酶活性减少内源性胆固醇合成,提高受体介导的血浆低密度脂蛋白清除率,有效调节血脂,广泛用于各类人群的降脂治疗;且冠心病患者长期服用无明显不良反应,具有高效和安全的特点。近年来,越来越多的证据显示他汀类药物具有扩张血管、抑制平滑肌细胞增殖、改善内皮功能、促进血管新生、抑制炎症反应等独立于其调脂以外的血管保护作用[12,13]。Satoh 等[14]用他汀类药物对低氧 5 周的肺动脉高压大鼠进行干预,结果发现他汀类药物可通过抑制SDF-la/CXCR4和ICAM-1/CD18途径减少骨髓来源EPCs的动员及归巢,从而降低 PAP。Schomig等[15]在急性心肌梗死患者中观察到,外周血循环EPCs数量与是否使用他汀类药物治疗呈正相关。CRP是炎症和感染等症状的一个临床标记物,可与受损的细胞结合,通过激发补体加重组织损伤处的炎症反应。IL-8是由巨噬细胞及嗜中性粒细胞合成的重要细胞趋化因子,可吸引中性粒细胞,促进中性粒细胞脱颗粒,诱导血管内皮细胞IL-8基因表达,导致IL-8进一步分泌,形成血管的炎性循环。新近研究表明,辛伐他汀可通过抑制野百合碱(MCT)诱导肺动脉高压模型大鼠肺组织中炎性细胞因子的表达及下调炎性细胞因子IL-6、IL-8的分泌,发挥对肺动脉高压的治疗作用[16]。本研究显示,治疗组和对照组治疗前EPCs的数量及迁移、黏附能力均显著低于正常组,PAP及血浆hs-CRP、IL-8水平均显著高于正常组。提示EPCs数量减低、功能障碍及炎症反应同时参与了慢性肺心病所致HPH的病理生理过程。本研究还显示,治疗后治疗组EPCs数量及迁移、黏附能力明显升高,FEV1、FEV1/FVC等肺功能指标明显改善,PAP及血浆hs-CRP、IL-8水平明显下降,与治疗前及对照组治疗后比较均有显著差异;治疗组不良反应轻微,停药后均能恢复。提示阿托伐他汀可能通过增加EPCs数量及改善其功能促进肺血管损伤内皮的修复、抑制血管炎性反应,进而达到治疗肺动脉高压、改善肺功能等作用,且安全性高。
[1]Cool CD,Stewart JS,Werahera P,et al.Three-dimensional reconstruction of pulmonary arteries inplexiform pulmonary hypertension using cell-specific markers:evidence for a dynamic and heterogeneous process of pulmonary endothelial cell growth[J].Am J Pathol,1999,155(2):411-419.
[2]Walter DH,Rittig K,Bahlmann FH,et al.Statin therapy accelerate reendothelialization[J].Circulation,2002,105(25):3017-3024.
[3]Hill JM,Zalos G,Halcox JP,et al.Circulating endothelial progenitor cells,vascular function,and cardiovascular risk[J].N Engl J Med,2003,348(7):593-600.
[4]Lee JH,Lee DS,Kim EK,et al.Simvastatin inhibits cigarette smoking-induced emphysema and pulmonary hypertension in rat lungs[J].Am J Respir Crit Care Med,2005,172(6):987-993.
[5]Mukai N,Akahori T,Komaki M,et al.A comparison of the tube forming potentials of early and late endothelial progenitor cells[J].Exp Cell Res,2008,314(3):430-440.
[6]Diller GP,van Eijl S,Okonko DO,et al.Circulating endothelial progenitor cells in patients with eisenmenger syndrome and idiopathic pulmonary arterial hypertens[J].Circulation,2008,117(23):3020-3030.
[7]Junhui Z,Xingxiang W,Guosheng F,et al.Reduced number and activity of circulating endothelial progenitor cells in patients with idiopathic pulmonary arterial hypertension[J].Respir Med,2008,102(7):1073-1079.
[8]刘海峰,张英,祁学文,等.COPD并发肺动脉高压病人外周血内皮祖细胞数量和功能的变化[J].青岛大学医学院学报,2007,43(6):514-516.
[9]Rubin LJ.Therapy of pulmonary hypertension:the evolution from vasodilators to antiproliferative agents[J].Am J Respir Crit Care Med,2002,166(10):1308-1309.
[10]何建国,卢献灵.肺动脉高压发病机制的进展带来临床治疗的革命[J].中国循环杂志,2008,23(6):471-474.
[11]Joppa P,Petrasova D,Stancak B,et al.Systemic in flammation in patients with COPD and pulmonary hypertension[J].Chest,2006,130(2):326-333.
[12]Halcox JP,Deanfield JE.Beyond the laboratory:clinical implications for statin pleiotropy[J].Circulation,2004,109(21 Suppl 1):1142-1148.
[13]Liao JK.Clinical implications for statin pleiotropy[J].Curt Opin Lipidol,2007,16(6):624-629.
[14]Satoh K,Fukumoto Y,Nakano M,et al.Statin ameliorates hypoxia-induced pulmonary hypertension associated with down-regulated stromal cell-derived factor-1[J].Cardiovasc Res,2009,81(1):226-234.
[15]Schomig K,Busch G,Steppich B,et al.Interleukin-8 is associated wilh circulatingprogenitor cells in acute myocardial infarction[J].Eur Hear J,2006,27(9):1032-1037.
[16]陈建英,徐军发,杨宇,等.辛伐他汀对野百合碱诱导的肺动脉高压大鼠IL-6和IL-8表达的影响[J].中南药学,2009,7(7):506-510.
