黄芩苷对CA46细胞裸鼠异种移植瘤的作用及机制*
2012-07-31胡建达魏天南郑志红陈英玉
黄 毅,胡建达,郑 静,李 静,魏天南,郑志红,陈英玉
(福建医科大学1附属协和医院,福建省血液病研究所,2省立临床医学院,福建 福州 350001)
黄芩苷在体外可抑制多种肿瘤细胞的增殖[1-4],体内研究同样显示黄芩苷具有明显的抗肿瘤活性。Ikemoto等[5]对C3H/HeN鼠行皮下移植鼠膀胱肿瘤-2(mouse bladder tumor-2,MBT-2)细胞致瘤,每天以10 mg的黄芩提取物灌胃处理1次,共10 d,于第20 d和第25 d测得的瘤体积明显小于对照组;而体外实验表明黄芩苷是黄芩提取物中发挥抗MBT-2膀胱癌细胞增殖的最主要活性成分。此外,黄芩苷对A549肺癌、艾氏腹水瘤、黑色素瘤的小鼠肿瘤模型也具有明显的抑制作用[6-8]。我们前期体外实验结果表明黄芩苷能明显抑制人Burkitt淋巴瘤CA46细胞的增殖并诱导凋亡[9],在此基础上,本研究拟建立CA46细胞裸鼠异种移植瘤模型,进一步探讨黄芩苷体内抗Burkitt淋巴瘤的作用及其可能机制,目前国内外尚未见相关报道。
材料和方法
1 细胞培养体系和药物
高致瘤CA46细胞引自中国医学科学院天津血液病研究所,由福建省血液病研究所传代保存,用含10%胎牛血清(Gibco)的RPMI-1640培养液(Gibco),置37℃、5%CO2饱和湿度的培养箱中培养,2~3 d换液传代1次;实验用细胞为状态良好的对数生长期细胞。黄芩苷购自南京青泽医药科技开发有限公司,5%NaHCO3溶解备用;依托泊甙(etoposide,VP-16)为上海华联制药有限公司产品,环磷酰胺(cyclophosphamide,CTX)为江苏恒瑞医药股份有限公司产品,均以双蒸水溶解备用。
2 动物
6~8周龄的BABL/c裸鼠,体重16~18 g,雌雄各半,购自中国医学科学院上海实验动物繁育中心,为无特殊致病菌(specific pathogen-free,SPF)动物,合格证号为SCXK(沪)2007-0005。所有裸鼠在福建医科大学实验动物中心(许可证号为SYXK闽2008-0001)SPF层流柜中饲养。
3 CA46细胞裸鼠异种移植瘤模型的建立及实验分组
饲养第3 d开始对每只裸鼠行腹腔注射10 g/L环磷酰胺0.2 mL,1次/d,连续2 d;第5 d收集对数生长期的高致瘤CA46细胞,在每只裸鼠右后背侧皮下接种0.2 mL细胞悬液(8×106个细胞/只),7 d后观察成瘤率达100%,选择肿瘤直径0.5~0.6 cm的裸鼠进行实验。将荷瘤裸鼠随机分为5%NaHCO3阴性对照组、阳性对照组(4 mg/kg VP-16)以及黄芩苷高(60 mg/kg)、中(30 mg/kg)、低(15 mg/kg)3个浓度用药组,每组12只裸鼠,雌雄各半,均采用腹腔注射方式给药,每次0.2 mL,每天1次,连续12 d。
4 给药12 d后检测的指标
4.1 体重、血常规及肝、肾功能的检测 末次给药后24 h,每组均随机取出6只裸鼠,雌雄各半,留下的6只裸鼠用以观察荷瘤生存时间。对取出的裸鼠行体重称量后,每只腹腔注射0.5%肝素0.5 mL,使之肝素化,5~6 min后摘除眼球取血,一部分肝素抗凝全血用以检测血常规中白细胞 (leukocyte,Leu)、血红蛋白 (haemoglobin,Hb)和血小板 (platalet,Plt)的浓度;另一部分离心分离出血浆用以检测肝功能中丙氨酸氨基转移酶(alanine aminotransferase,ALT)、γ-谷氨酰转移酶 (γ-glutamyltransferase,γ-GT)和肾功能中血尿素氮 (blood urea nitrogen,BUN)、肌酐 (creatinine,Cr)的浓度。
4.2 抑瘤率的检测 取血后,颈椎脱臼处死裸鼠,立即完整剥离瘤块,称量离体瘤块重量,计算各组平均瘤块重量及抑瘤率。抑瘤率(%)=[1-(给药组平均瘤重/阴性对照组平均瘤重)]×100%。
4.3 透射电镜观察瘤组织细胞的超微结构 切取各组裸鼠的部分新鲜瘤块,1 mm×1 mm×1 mm大小数块,迅速放入4℃预冷的2.5%戊二醛和1%多聚甲醛混合固定液中固定,1%锇酸固定后,环氧树脂618包埋,超薄切片,用醋酸钠和枸橼酸铜染色,日立HU-12A型透射电镜下观察瘤组织细胞的超微结构。
4.4 病理组织学检查 分别切取各组裸鼠的部分新鲜瘤块置10%甲醛中固定后,常规制作石蜡切片,HE染色,光镜下观察。
4.5 Western blotting检测瘤块组织蛋白激酶B(protein kinase,Akt)、磷酸化 Akt(phospho-Akt,p-Akt)、核因子 -κB(nuclear factor-kappa B,NF-κB)p65、哺乳动物雷帕霉素靶点 (mammalian target of rapamycin,mTOR)、磷酸化 mTOR(phosphomTOR,p-mTOR)蛋白的表达 将切取的各组裸鼠新鲜瘤块组织充分研磨,过滤后提取蛋白,以β-actin蛋白为内参照,采用Western blotting检测各组相应蛋白表达的变化;所用β-actin鼠抗购自NeoMarkers,Akt、p - Akt(Ser32)、mTOR 和 p - mTOR(Ser2448)兔抗购自 Cell Signaling Technology,NF-κB p65兔抗购自 eBioscience,操作步骤详见文献[9]。
5 荷瘤裸鼠生存时间观察
从首次给药时间算起继续对各组留下观察生存时间的荷瘤裸鼠行腹腔注射药物,每次0.2 mL,2 d 1次,直至裸鼠全部死亡,期间对每只裸鼠的生存时间均予以记录,计算各组荷瘤裸鼠不同阶段的生存率和生存延长率。生存延长率(%)=(给药组平均生存时间-阴性对照组平均生存时间)/阴性对照组平均生存时间×100%。
6 统计学处理
结 果
1 黄芩苷对荷瘤裸鼠血常规、肝肾功能和体重的影响
腹腔注射12 d后,阳性对照组(4 mg/kg VP-16)荷瘤裸鼠的白细胞数为(8.4±2.1)×109/L,明显低于阴性对照组的(11.6±2.0)×109/L(P<0.05);而30 mg/kg和60 mg/kg黄芩苷给药组血常规、肝肾功能和体重的检测结果与阴性对照组比较无显著差异(P>0.05),见表1。
2 黄芩苷对CA46细胞裸鼠异种移植瘤生长的抑制作用
腹腔注射黄芩苷12 d后处死各组部分裸鼠取瘤块称重的结果显示,30 mg/kg黄芩苷组、60 mg/kg黄芩苷组瘤块重量均明显低于阴性对照组(P<0.05,P<0.01),抑瘤率分别为28.4%和51.9%,呈现剂量依赖性,提示黄芩苷对CA46细胞裸鼠异种移植瘤的生长具有明显的抑制作用,见图1、表2。
表1 给药12 d后裸鼠的血常规、肝肾功能和体重检测结果Table 1.The results of blood,liver and renal function assay,and body weight in nude mice with CA46 cell xenografts after drug injection for 12 d(.n=6)
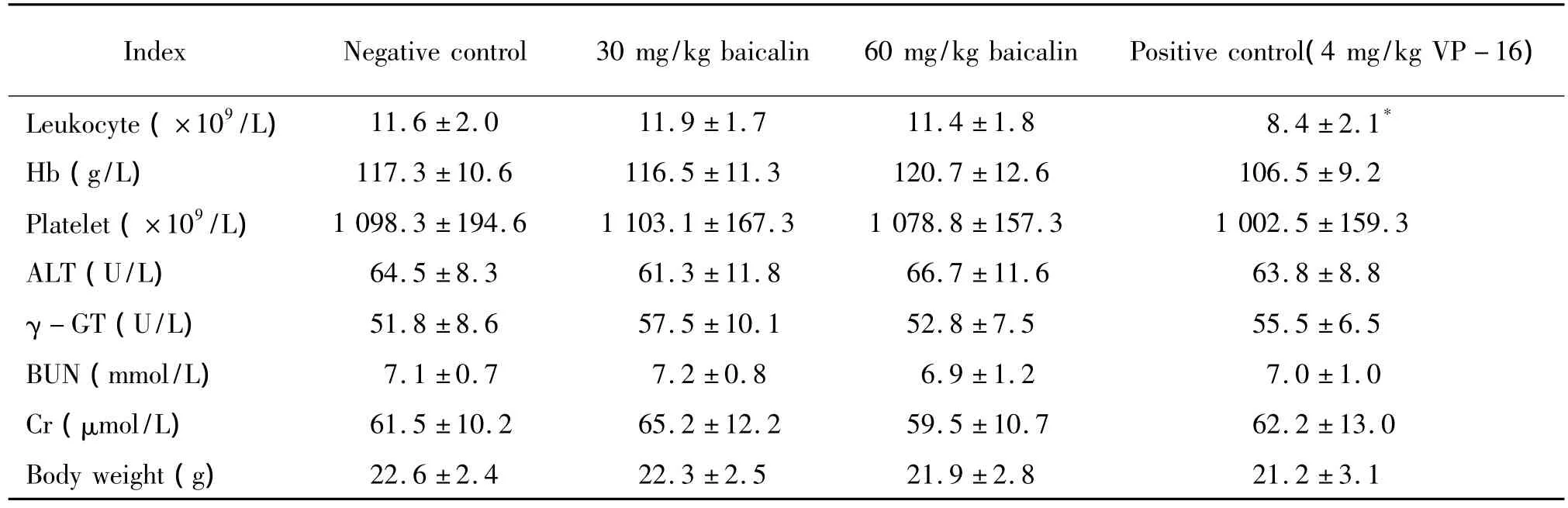
表1 给药12 d后裸鼠的血常规、肝肾功能和体重检测结果Table 1.The results of blood,liver and renal function assay,and body weight in nude mice with CA46 cell xenografts after drug injection for 12 d(.n=6)
*P <0.05 vs negative control group.
Index Negative control 30 mg/kg baicalin 60 mg/kg baicalin Positive control(4 mg/kg VP-16)Leukocyte(×109/L) 11.6 ±2.0 11.9 ±1.7 11.4 ±1.8 8.4 ±2.1*Hb(g/L) 117.3 ±10.6 116.5 ±11.3 120.7 ±12.6 106.5 ±9.2 Platelet(×109/L) 1098.3 ±194.6 1103.1 ±167.3 1078.8 ±157.3 1002.5 ±159.3 ALT(U/L) 64.5 ±8.3 61.3 ±11.8 66.7 ±11.6 63.8 ±8.8 γ - GT(U/L) 51.8 ±8.6 57.5 ±10.1 52.8 ±7.5 55.5 ±6.5 BUN(mmol/L) 7.1 ±0.7 7.2 ±0.8 6.9 ±1.2 7.0 ±1.0 Cr(μmol/L) 61.5 ±10.2 65.2 ±12.2 59.5 ±10.7 62.2 ±13.0 Body weight(g)22.6 ±2.4 22.3 ±2.5 21.9 ±2.8 21.2 ±3.1

Figure 1.The CA46 cell xenografts in all groups after drug injection for 12 d.图1 给药12 d后各组裸鼠的瘤块大小
表2 给药12 d后各组瘤块重量及抑瘤率比较Table 2.The weight and inhibitory rate of CA46 cell xenografts in all groups after drug injection for 12 d(.n=6)

表2 给药12 d后各组瘤块重量及抑瘤率比较Table 2.The weight and inhibitory rate of CA46 cell xenografts in all groups after drug injection for 12 d(.n=6)
*P <0.05,**P <0.01 vs negative control group.
Group Weight(g) Inhibitory rate(%)53.6 Negative control 1.83 ±0.19 -15 mg/kg baicalin 1.74 ±0.17 4.930 mg/kg baicalin 1.31 ±0.37* 28.460 mg/kg baicalin 0.88 ±0.42** 51.9 Positive control(4 mg/kg VP -16) 0.85 ±0.44**
3 透射电镜观察瘤块组织细胞的超微结构
30 mg/kg黄芩苷组、60 mg/kg黄芩苷组和阳性对照组(4 mg/kg VP-16)的瘤块组织经透射电镜观察,瘤细胞凋亡现象多见,形态特点如下:核染色质固缩,聚集于核膜下,呈界限分明的颗粒状或半月形小体,胞浆固缩;相比之下,阴性对照组瘤细胞排列密集,形态正常,细胞核染色质呈均质状,见图2。
4 瘤块病理组织学改变
光镜下观察,可见30 mg/kg黄芩苷组、60 mg/kg黄芩苷组和阳性对照组(4 mg/kg VP-16)瘤块组织中的瘤细胞明显减少,细胞体积变小,核深染,有的细胞固缩,有的仅存胞核,可见不规则坏死、出血;相比之下,阴性对照组瘤细胞排列密集,瘤细胞形态正常,呈圆形或椭圆形、大小均一,见图3。
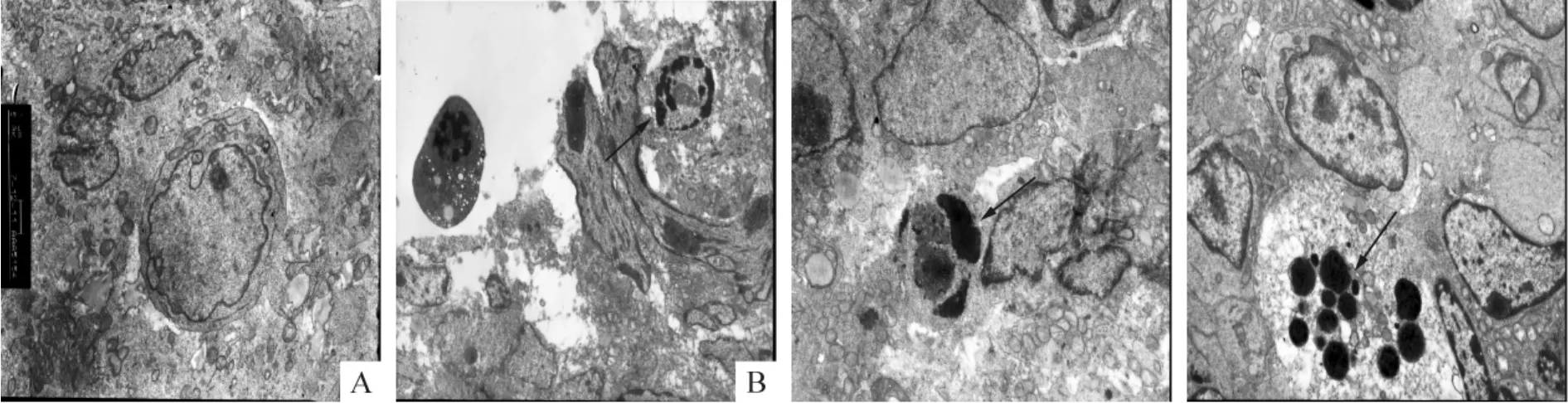
Figure 2.The cell ultrastructure of CA46 cell xenografts in nude mice after drug injection for 12 d(×6300).A:negative control group;B:30 mg/kg baicalin group;C:60 mg/kg baicalin group;D:positive control(4 mg/kg VP-16)group.→:apoptosis.图2 给药12 d后瘤块细胞超微结构

Figure 3.The pathological changes of CA46 cell xenografts in nude mice after drug injection for 12 d(×200).A:negative control group;B:30 mg/kg baicalin group;C:60 mg/kg baicalin group;D:positive control(4 mg/kg VP-16)group.→:necrosis and hemorrhage.图3 给药12 d后瘤块病理变化
5 Western blotting 检测瘤块组织 Akt、p -Akt、NF-κB、mTOR和p-mTOR蛋白的表达
给药12 d后,30 mg/kg黄芩苷组和60 mg/kg黄芩苷组瘤块组织 p-Akt、NF-κB、mTOR和 pmTOR蛋白的表达水平均明显低于阴性对照组(P<0.05,P<0.01),呈剂量依赖性;而 Akt的表达无明显改变,见图 4、5。
6 荷瘤裸鼠生存时间观察
阴性对照组荷瘤裸鼠的生存时间仅(49.7±14.6)d,至71 d即全部死亡;而黄芩苷用药组随着药物剂量的增加,裸鼠的生存时间得到延长:30 mg/kg组的生存时间(62.2±17.0)d,生存延长率25.2%;60 mg/kg组的生存时间(70.8±19.1)d,生存延长率42.4%,与阴性对照组比较差异显著(P<0.05),见图6。
讨 论

Figure 4.The expression of Akt,p - Akt,NF - κB,mTOR and p-mTOR proteins,in CA46 cell xenografts in nude mice after drug injection for 12 d.Lane 1:negative control group;Lane 2:30 mg/kg baicalin group;Lane 3:60 mg/kg baicalin group;Lane 4:positive control(4 mg/kg VP -16)group.图4 给药12 d后瘤块组织 Akt、p-Akt、NF-κB、mTOR和p-mTOR蛋白表达的变化

Figure 5.The comparison of Akt,p -Akt,NF - κB,mTOR and p-mTOR protein expression of CA46 cell xenografts in nude mice after drug injection for 12 d.β-actin protein was used as an internal control..n=6.*P<0.05,**P <0.01 vs negative control group.图5 给药12 d后瘤块组织 Akt、p-Akt、NF-κB、mTOR和p-mTOR蛋白相对灰度值的比较

Figure 6.The Kaplan-Meier survival curves of nude mice with CA46 cell xenografts in all groups.n=6.图6 各组荷瘤裸鼠Kaplan-Meier生存曲线
自1969年Rygarrd首次在裸鼠身上成功移植人类肿瘤后,裸鼠异种移植瘤模型就成为人们进行肿瘤实验性治疗广泛采用的研究手段,人体内肿瘤与人肿瘤细胞裸鼠异种移植瘤对药物反应的一致性已获得证实[10]。本实验结果显示,对建立的CA46细胞裸鼠异种移植瘤行腹腔注射方式给药12 d后,30 mg/kg黄芩苷组和60 mg/kg黄芩苷组的抑瘤率达到28.4%和51.9%,提示黄芩苷具有明显的体内抗Burkitt淋巴瘤活性,且作用呈现剂量依赖性,在一定范围内浓度越高,抑瘤作用越明显。生存时间是评价抗肿瘤药物疗效的最可靠指标之一,本研究结果发现黄芩苷作用还可延长荷瘤裸鼠的生存时间,30 mg/kg黄芩苷和60 mg/kg黄芩苷将裸鼠的生存时间分别延长了25.2%和42.4%,且60 mg/kg黄芩苷组的生存时间与阴性对照组相比较差异显著(P<0.05)。肿瘤的形成和发展是十分复杂的过程,涉及多种细胞因子和信号通路的改变,单纯依靠黄芩苷在治疗的后期难以控制肿瘤的生长,将黄芩苷与其它化疗药物联用,能否减少肿瘤的耐药性,进一步提高荷瘤裸鼠的生存时间有待探讨。
细胞死亡方式有2种:一是凋亡,它是散在于肿瘤组织中的单个细胞或小细胞团的死亡,死亡细胞的染色质凝集,嗜碱性染色增强,然后细胞核崩解,但细胞的质膜不破裂、不引发急性炎症反应;二是坏死,它是肿瘤内范围不等的局部细胞死亡,死亡细胞的质膜崩解、组织自溶,并引发急性炎症反应[11]。本研究采用透射电镜法和病理组织学法观察黄芩苷作用后裸鼠瘤块组织的变化,结果发现30 mg/kg组和60 mg/kg组肿瘤细胞凋亡和坏死现象多见,而阴性对照组偶见凋亡和坏死细胞,提示黄芩苷一方面可诱导肿瘤细胞凋亡,另一方面又可引起肿瘤细胞坏死,通过上述2种方式促进肿瘤细胞死亡而发挥体内抗Burkitt淋巴瘤的作用。
PI3K/Akt是体内重要的信号通路之一,在介导细胞的增殖、存活和凋亡中发挥重要的调节作用。近来的研究表明,该通路的持续活化可导致细胞凋亡通路受阻,或细胞周期进程加快,使正常细胞向肿瘤细胞转化,与血液系统恶性肿瘤的发生发展及治疗密切相关[12]。Akt是PI3K/Akt信号通路的主要调节分子,通过磷酸化而激活,而转录因子NF-κB和控制翻译蛋白mTOR是其下游的两个重要靶分子,也是抗血液系统恶性肿瘤治疗上的重要作用靶点[12-13]。本研究结果显示黄芩苷明显抑制了瘤块组织Akt的磷酸化,并导致NF-κB和mTOR表达水平的下降及mTOR磷酸化的受阻,提示黄芩苷体内抗Burkitt淋巴瘤作用的机制可能与下调PI3K/Akt/NF-κB和PI3K/Akt/mTOR信号通路有关。
药物浓度超过一定范围会带来毒副作用,通常表现在对胃肠道、造血系统及肝肾功能的影响上。本研究在给药12 d期间观察成瘤裸鼠一般状况,高、中、低3种浓度黄芩苷给药组均未见裸鼠有消瘦、厌食、活跃程度下降等明显异常;给药12 d后的血常规和肝肾功能检测结果显示,30 mg/kg和60 mg/kg黄芩苷给药组和阴性对照组比较均无显著差异(P>0.05),提示在本给药剂量下,黄芩苷对CA46细胞具有选择性杀伤作用,而对裸鼠正常血细胞和肝、肾器官无明显毒副作用。相比之下,阳性对照组荷瘤裸鼠的白细胞数明显低于阴性对照组(P<0.05),推测与VP-16具一定的骨髓抑制性有关。
细胞增殖和凋亡是一个由多因素、多分子参与的复杂过程。黄芩苷在体内抑制CA46细胞裸鼠异种移植瘤生长并诱导肿瘤细胞凋亡的过程,是否有其它信号通路,以及Akt下游其它靶分子的参与,有待进一步研究。
[1]Miocinovic R,McCabe NP,Keck RW,et al.In vivo and in vitro effect of baicalein on human prostate cancer cells[J].Int J Oncol,2005,26(1):241 -246.
[2]Wang N,Tang LJ,Zhu GQ,et al.Apoptosis induced by baicalin involving up-regulation of P53 and bax in MCF-7 cells[J].J Asian Nat Prod Res,2008,10(11 -12):1129-1135.
[3]Lu HF,Hsueh SC,Ho YT,et al.ROS mediates baicalin-induced apoptosis in human promyelocytic leukemia HL-60 cells through the expression of the Gadd153 and mitochondrial- dependent pathway[J].Anticancer Res,2007,27(1A):117-125.
[4]Kumagai T,Müller CI,Desmond JC,et al.Scutellaria baicalensis,a herbal medicine:anti-proliferative and apoptotic activity against acute lymphocytic leukemia,lymphoma and myeloma cell lines[J].Leuk Res,2007,31(4):523-530.
[5]Ikemoto S,Sugimura K,Yoshida N,et al.Antitumor effects of Scutellariae radix and its components baicalein,baicalin and wogonin on bladder cancer cell lines[J].Urology,2000,55(6):951 -955.
[6]Du G,Han G,Zhang S,et al.Baicalin suppresses lung carcinoma and lung metastasis by SOD mimic and HIF-1α inhibition[J].Eur J Pharmacol,2010,630(1 - 3):121-130.
[7]袁榴娣,徐 红,杜肇宗.黄芩苷对艾氏腹水瘤细胞影响的初步探讨[J].南京铁道医学院学报,1997,16(4):231-233.
[8]Kato M,Liu W,Yi H,et al.The herbal medicine Shosaiko-to inhibits growth and metastasis of malignant melanoma primarily developed in ret- transgenic mice[J].J Invest Dermatol,1998,111(4):640 -644.
[9]黄 毅,胡建达,郑 静,等.黄芩苷抑制CA46细胞增殖和诱导凋亡的作用机制探讨[J].中国病理生理杂志,2009,25(5):888-892.
[10]Giovanella BC,Stehlin JS,Shepard RC,et al.Correlation between response to chemotherapy of human tumors in patients and in nude mice[J].Cancer,1983,52(7):1146 -1152.
[11]方 敏,薛绍白.程序化细胞死亡与肿瘤[J].基础医学与临床,1994,14(3):5 -9.
[12]Kawauchi K,Ogasawara T,Yasuyama M,et al.The PI3K/Akt pathway as a target in the treatment of hematologic malignancies[J].Anticancer Agents Med Chem,2009,9(5):550-559.
[13]Chapuis N,Tamburini J,Green AS,et al.Perspectives on inhibiting mTOR as a future treatment strategy for hematological malignancies[J].Leukemia,2010,24(10):1686-1699.
