人细小病毒B19-VP1u保守区外C端氨基酸对sPLA2活性的影响
2012-07-28黄玉,赵丹,李毅,2
黄 玉,赵 丹,李 毅,2
(1.华中师范大学生命科学学院,湖北 武汉 430079;2.武汉生物工程学院生物工程系,湖北 武汉 430415)
人细小病毒B19(Human parvovirus B19,简称B19)属于细小病毒科红细胞病毒属,是澳大利亚病毒学家Yvonne Cossart在1975年从献血者的血清中发现的[1]。B19主要侵袭人体骨骼造血系统,感染原红细胞,通过阻止红细胞的生成[2]而引起如传染性红斑、红细胞再生障碍性贫血危象、关节病、孕妇流产、胎儿水肿和死胎等病症。
和其它细小病毒一样,B19也是无囊膜的DNA病毒,病毒粒子呈二十面体,直径22~24 nm。病毒的基因组全长5596 bp,编码2个结构蛋白VP1、VP2和1个非结构蛋白NS1[3],在不同病毒株之间,NS1相对保守,VP1和VP2则有较大可变性[4]。
B19的2个结构蛋白VP1(83 kDa)和VP2(58 kDa)的C端完全相同,只是VP1的N端比VP2多出227个氨基酸,该区域称为VP1独特区(VP1 unique,VP1u)[5],VP1u对病毒的感染具有重要作用。
磷脂酶PLA2超家族主要包含分泌性PLA2(sPLA2)、细胞质PLA2、不依赖Ca2+的PLA2、与脂蛋白相联系的PLA2,分子量约13~15 kDa。在体内,PLA2水解相应底物产生的脂肪酸和溶血磷脂是重要的脂质介导物和第二信使[6],推测PLA2与炎症反应、动脉粥样硬化的形成有密切关系,因此,研究PLA2对治疗相关疾病有重要意义。
研究发现,很多细小病毒的VP1u具有分泌性磷脂酶PLA2(sPLA2)的活性,如腺相关病毒(AAV)[7]、猪细小病毒(PPV)[8],人细小病毒B19也不例外,B19-VP1u的130~195位氨基酸为sPLA2活性的保守区[9],突变其中的一个位点会降低酶活性和病毒感染性[10]。
然而,保守区外的氨基酸可能对VP1u形成正确的三维结构起作用,也可能拉近底物与酶活性中心的距离,因而对酶活性也可能产生影响。作者在此构建不同长度VP1u的C端截短突变(图1),表达纯化MBP融合蛋白,检测并分析全长MBP-VP1u融合蛋白及截短蛋白的sPLA2活性,研究B19-VP1u保守区外C端氨基酸对其sPLA2活性的影响。

图1 B19-VP1u保守区外C端氨基酸截短方案
1 实验
1.1 材料和试剂
质粒模板PUC18a-VP1u以及VP1u全长MBP融合蛋白MBP-VP1u,自行保存。限制性内切酶BamHI、HindⅢ(Promega);PfuDNA聚合酶、T4DNA连接酶(Takara);DNA Marker、蛋白Marker(东盛);Bradford蛋白浓度测定试剂盒(碧云天);pMAL Protein Fusion and Purification System(BioLabs);sPLA2 Assay Kit(Cayman)、DH5α感受态细胞(鼎国昌盛)。
1.2 方法
1.2.1 VP1u的C端截短突变基因片段扩增
以质粒PUC18a-VP1u为模板,PCR扩增出各截短突变目的片段:VP1u/TC8、VP1u/TC16、 VP1u/TC24。各截短突变的引物序列见表1。

表1 B19-VP1u截短突变基因片段扩增的引物序列
PCR反应程序为:94 ℃ 3 min;94 ℃ 30 s,56 ℃ 30 s,72 ℃ 1 min,32个循环;72 ℃ 10 min。将经过限制性内切酶BamHI和HindⅢ双酶切处理纯化好的目的基因和pMAL-c2x载体经体外T4DNA连接酶过夜连接后,转化感受态细胞DH5α并挑取单菌落,碱裂解法提质粒并双酶切验证。将双酶切正确克隆测序。
1.2.2 MBP融合蛋白表达及纯化
参照pMAL Protein Fusion and Purification System说明书,首先小规模诱导目的融合蛋白表达,将重组质粒pMAL-VP1u/TC8、pMAL-VP1u/TC16、pMAL-VP1u/TC24转化感受态细胞DH5α,挑取单菌落过夜摇菌,在IPTG浓度为0.4 mmol·L-1、0.6 mmol·L-1、0.8 mmol·L-1诱导条件下,分别培养2 h、4 h、6 h后,12%SDS-PAGE分离、考马斯亮蓝染色检测;而后在300 mL培养基里进行大规模表达,超声破碎后离心(6000 g×30 min),分别收集上清和沉淀SDS-PAGE检测目的蛋白的表达形式。取上清用Amylose柱进行亲和层析,对目的蛋白进行纯化,最后真空干燥浓缩,得到浓度较高的储存液即蛋白样,分管保存于-80 ℃。
1.2.3 sPLA2活性检测
将纯化的MBP-VP1u/TC8、MBP-VP1u/TC16、MBP-VP1u/TC24融合蛋白通过Bradford法测定浓度,确保其浓度达到0.5 mg·mL-1以上后,用sPLA2活性测定试剂盒测定其sPLA2的活性,参照sPLA2 Assay Kit说明,选择Bee Venom作为阳性对照、ddH2O为阴性对照,用96孔板对样品进行测定,设3个复孔,样品处理后在不同时间段测定414 nm下各样品吸光值,计算并统计分析各蛋白样品sPLA2活性。
2 结果与讨论
2.1 VP1u的C端截短突变重组载体的构建及检测
2.1.1 VP1u的C端截短突变基因片段的PCR扩增
用高保真PfuDNA聚合酶以PUC18a-VP1u质粒为模板,以相应F、R为上、下游引物分别扩增出大小为660 bp(VP1u/TC8)、636 bp(VP1u/TC16)、612 bp(VP1u/TC24)的PCR产物(图2),大小与预期结果一致,即为正确的目的片段。

M1.1 kb Marker M2.Marker 1 1~3.VP1u/TC8、VP1u/TC16、VP1u/TC24
2.1.2 VP1u的C端截短突变重组载体双酶切鉴定
将重组载体经双酶切验证,结果发现,阳性重组载体可分别得到660 bp(VP1u/TC8)、636 bp(VP1u/TC16)、612 bp(VP1u/TC24)的DNA条带,与预期结果一致(图3)。将酶切鉴定正确克隆送南京金斯瑞生物公司测序,结果显示所插入片段的DNA序列与GenBank中发表的基因序列完全一致。进一步说明了目的基因已成功插入到pMAL-c2x中。
M1,M3.1 kb Marker M2.Marker 1 1~5.pMAL-VP1u/TC8双酶切产物 6~8.pMAL-VP1u/TC16双酶切产物 9~11.pMAL-VP1u/TC24双酶切产物
2.2 VP1u的C端截短突变蛋白的诱导表达纯化及sPLA2活性测定
VP1u的C端截短突变蛋白的小规模诱导表达结果显示,在0.8 mmol·L-1IPTG诱导6 h的条件下,蛋白表达量最大,此后实验均在该条件下诱导蛋白表达。经诱导后在66 kDa附近出现目的条带 (图4), 初步说明VP1u的C端截短突变融合蛋白诱导表达成功。

M.蛋白Marker 1.IPTG诱导的菌种pMAL-c2x 2,4,6.未加IPTG诱导的pMAL-VP1u/TC8、pMAL-VP1u/TC16、pMAL-VP1u/TC24 3,5,7.IPTG诱导的pMAL-VP1u/TC8、pMAL-VP1u/TC16、pMAL-VP1u/TC24
SDS-PAGE检测结果表明,大规模诱导表达的目的蛋白均为可溶性,纯化出的目的蛋白显示为单一条带(图5),说明蛋白纯化成功。

M.蛋白Marker 1.IPTG诱导的菌种pMAL-c2x 2.IPTG诱导的pMAL-VP1u/TC8重组菌 3~7.纯化后的MBP-VP1u/TC8融合蛋白 8.IPTG诱导的pMAL-VP1u/TC16重组菌 9~13.纯化后的MBP-VP1u/TC16融合蛋白 14.IPTG诱导的pMAL-VP1u/TC24重组菌 15~20.纯化后的MBP-VP1u/TC24融合蛋白
VP1u全长及C端截短突变融合蛋白sPLA2活性见表2、图6。

图6 VP1u全长及C端截短突变融合蛋白的sPLA2活性
表2VP1u全长及C端截短突变融合蛋白sPLA2的活性
Tab.2sPLA2ActivityofVP1uandC-terminaltruncatedmutants
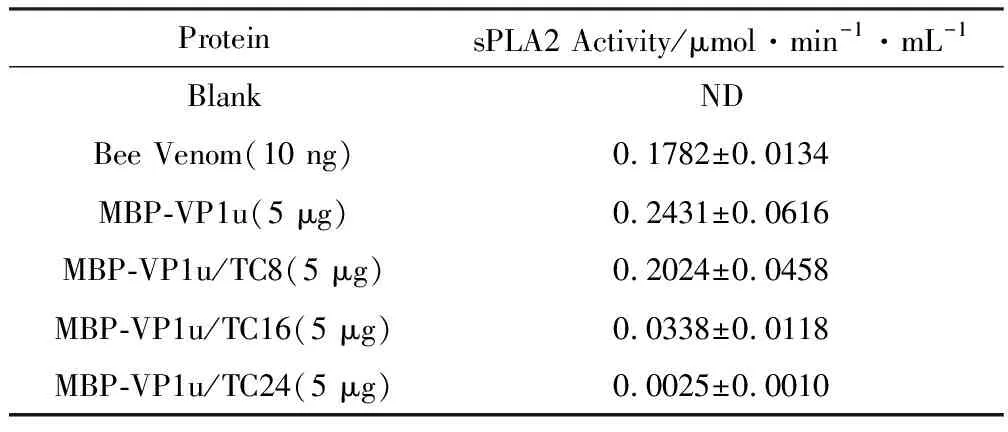
ProteinsPLA2 Activity/μmol·min-1·mL-1BlankNDBee Venom(10 ng)0.1782±0.0134MBP-VP1u(5 μg)0.2431±0.0616MBP-VP1u/TC8(5 μg)0.2024±0.0458MBP-VP1u/TC16(5 μg)0.0338±0.0118MBP-VP1u/TC24(5 μg)0.0025±0.0010
由表2可知,完整VP1u的蛋白酶活性比阳性对照(Bee Venom)还要高,说明B19-VP1u具有相当高的sPLA2活性。C端截短7个氨基酸后的蛋白,其sPLA2活性仅(0.2024±0.0458)μmol·min-1·mL-1,比VP1u(0.2431±0.0616)μmol·min-1·mL-1降低了约2%;截短15个氨基酸时,其活性明显降低,比VP1u降低了约81%;截短23个氨基酸时,其活性进一步降低,比VP1u降低了约99%,几乎完全丧失了活性。由此推测,VP1u的C端第8~24个氨基酸之间的区域对酶活性有显著的影响,这可能与VP1u蛋白的完整结构、正确折叠和形成有功能的构象有密切联系。
2.3 讨论
由于B19可以通过呼吸道、母婴、骨髓和器官移植、输血等多种途径传播[11],在人群中血清检测的阳性率非常高[12]。B19-VP1u因其结构功能的特异性,受到越来越多的关注,学者们开始探寻VP1u的sPLA2活性及其与炎症反应的关系,以期从中找到B19感染与宿主病理反应之间的桥梁。Lu等[13]突变VP1u的第175位氨基酸后,发现VP1u的sPLA2活性明显降低,病毒感染性也随之降低。Canaan等[9]通过突变关键区域的氨基酸也获得了类似的结果。但B19-VP1u的sPLA2的具体功能仍不明确。
通过查阅相关文献,对实验进行了初步设计,从B19-VP1u的C端每隔7个或8个氨基酸截短一次,得到VP1u/TC8、VP1u/TC16、 VP1u/TC24 3段截短的基因片段,表达纯化获得3种截短突变的MBP融合蛋白,最后测定VP1u全长及截短突变MBP融合蛋白的sPLA2活性。结果显示第8~24个氨基酸序列对酶活有显著影响,推测这段序列对维持VP1u的正确构象有很大作用,缺失后影响了酶活性中心的形成,导致底物不能与其充分接近,从而使sPLA2活性大大降低,但具体机制目前还不清楚。
B19-VP1u保守区外两端均有一段氨基酸序列,实验证明C端序列会对sPLA2活性产生影响,推测N端序列也会对酶活性有所影响,但这还有待进一步验证。另一方面,依据sPLA2能催化底物产生脂肪酸这一特性,用VP1u全长及截短突变的融合蛋白处理敏感细胞系,比较细胞在蛋白处理前后脂肪酸浓度的变化,可以进一步阐明正常生理条件下sPLA2的功能。与此同时,可以制备获得VP1u完整结构的蛋白晶体,更直观地从蛋白的三维构象上揭示sPLA2的天然结构,推测其潜在功能,阐明其在B19感染宿主细胞过程中的作用机理。
3 结论
为探寻人细小病毒B19-VP1u保守区外氨基酸序列对VP1u的sPLA2活性的影响,依次截短VP1u保守区外C端的氨基酸序列,表达纯化截短突变的蛋白后分别检测其sPLA2活性。结果显示,截短7个氨基酸时,酶活性没有明显变化;但截短15个氨基酸时,酶活性显著降低;截短23个氨基酸时,几乎没有酶活性。表明保守区外C端的第8~24个氨基酸之间的序列对酶活性有显著影响,推测其在维持酶的正确三维结构中起重要作用。
参考文献:
[1] Cossart Y E,Field A M,Cant B,et al.Parvovirus-like particles in human sera[J].Lancet,1975,305(7898):72-73.
[2] Ozawa K,Kurtzman G,Young N.Replication of the B19 parvovirus in human bone marrow cell cultures[J].Science,1986,233(4766):883-886.
[3] Ozawa K,Ayub J,Hao Y S,et al.Novel transcription map for the B19 (human) pathogenic parvovirus[J].J Virol,1987,61(8):2395-2406.
[4] Erdman D D,Durigon E L,Wang Q Y,et al.Genetic diversity of human parvovirus B19:Sequence analysis of the VP1/VP2 gene from multiple isolates[J].J Gen Virol,1996,77(11):2767-2774.
[5] Stacie A,Mikio M,Masako K,et al.Peptides derived from the unique region of B19 parvovirus minor capsid protein elicit neutralizing antibodies in rabbits[J].Virology,1995,206(1):626-632.
[6] Rivera R,Chun J.Biological effects of lysophospholipids[J].Rev Physiol Biochem Pharmacol,2008,160:25-46.
[7] Girod A,Wobus C E,Zádori Z,et al.The VP1 capsid protein of adeno-associated virus type 2 is carrying a phospholipase A2 domain required for virus infectivity[J].J Gen Virol,2002,83(5):973-978.
[8] Zádori Z,Szelei J,Tijssen P.SAT:A late NS protein of porcine parvovirus[J].J Virol,2005,79(20):13129-13138.
[9] Canaan S,Zádori Z,Ghomashchi F,et al.Interfacial enzymology of parvovirus phospholipases A2[J].J Biol Chem,2004,279(15):14502-14508.
[10] Filippone C,Zhi N,Wong S,et al.VP1u phospholipase activity is critical for infectivity of full-length parvovirus B19 genomic clones[J].Virology,2008,374(2):444-452.
[11] Anand A,Gray E S,Brown T,et al.Human parvovirus infection in pregnancy and hydrops fetalis[J].N Engl J Med,1987,316(4):183-186.
[12] Anderson L J,Tsou C,Parker R A,et al.Detection of antibodies and antigens of human parvovirus B19 by enzyme-linked immunosorbent assay[J].J Clin Microbiol,1986,24(4):522-526.
[13] Lu J,Zhi N,Wong S,et al.Activation of synoviocytes by the secreted phospholipase A2 motif in the VP1-unique region of parvovirus B19 minor capsid protein[J].J Infect Dis,2006,193(4):582-590.
