产二甲苯单加氧酶菌株的筛选、鉴定及转化2,5-二甲基吡嗪条件的优化
2012-07-28刘丽娟薛亚平郑裕国
刘丽娟,薛亚平,郑裕国
(浙江工业大学生物与环境工程学院,浙江 杭州 310014)
5-甲基吡嗪-2-羧酸是一种重要的医药中间体,可用于合成第二代口服降血糖药物格列吡嗪(Glypizide)、新型抗高血压药物阿西莫司(Acipimox)、抗结核药物5-甲基吡嗪-2-羧酸甲酯等。目前,5-甲基吡嗪-2-羧酸工业生产方法有化学合成法和生物合成法,其中化学合成法存在过程复杂、选择性差、产率低、产物难分离、污染严重等缺点[1~8],而生物合成法因具有高效、高选择性、条件温和、环境友好等特点,近年来得到快速发展。研究表明,单加氧酶可以对吡嗪等杂环类化合物进行高效、高区域性的加氧反应。研究者陆续筛选出Ralstonia/Burkholderiasp.DSM6920[9]、RhodococcuserythropolisDP-45[10]、Pseudomonasputida[11,12]等具有单加氧酶活性的菌株,其中恶臭假单胞菌(Pseudomonasputida)能够选择性地将2,5-二甲基吡嗪对称甲基中的一个甲基氧化为羧基[11],且具有很强区域选择性,在5-甲基吡嗪-2-羧酸的生产中应用潜力巨大。瑞士的Lonza公司利用含二甲苯单加氧酶的菌株在批次补料反应器中实现了5-甲基吡嗪-2-羧酸的微生物法生产[13]。目前,国内还未见这方面的研究和报道。
作者从土壤中筛选出一株产二甲苯单加氧酶菌株,可以有效地将2,5-二甲基吡嗪氧化为5-甲基吡嗪-2-羧酸,对其进行生理生化鉴定及16S rDNA分析,并对转化条件进行了优化。
1 实验
1.1 材料、试剂与仪器
从化工厂的排污口附近、菜园、果园、植物丛等处采集100余份土样用以菌种筛选。
Biolog(GEN Ⅲ)微生物自动鉴定专用试剂及培养基等,Biolog公司;基因组DNA快速提取试剂盒,MP Bio公司;DNA纯化试剂盒、胶回收试剂盒、质粒抽提试剂盒,Axygen公司。其它试剂均购自Sigma公司。
VFD-M型摇床,乐山长征制药有限公司;LC-10AS型高效液相色谱仪,日本岛津公司;XL30型环境扫描电镜,荷兰Philips公司;PTC200型扩增仪,美国Bio-Rad公司。
1.2 培养基及培养方法
菌种保藏培养基(g·L-1):酵母膏5,蛋白胨10,NaCl 5,琼脂 20,pH值7.0。
种子液培养基(g·L-1):酵母膏 5,蛋白胨 10,NaCl 5,pH值7.0。
无机盐培养基:先配好A、B、C 3种母液,然后按A∶B∶C∶蒸馏水=10∶2.5∶0.1∶87.4(体积比)混合均匀后高压蒸汽灭菌。A(g·L-1):(NH4)2SO420,Na2HPO4·2H2O 25,KH2PO410,NaCl 30;B(g·L-1):MgCl2·6H2O 16,CaCl2·2H2O 0.58,FeCl3·6H2O 0.032;C(g·L-1):ZnSO4·7H2O 0.1,MnCl2·4H2O 0.09,H3BO30.3,CoCl2·6H2O 0.2,CuCl2·2H2O 0.01,NiCl2·6H2O 0.02,Na2MoO4·2H2O 0.03,EDTA·Na2·2H2O 5.0,FeSO4·7H2O 2.0,pH值7.0。
富集培养与发酵培养方法:在500 mL摇瓶中加入100 mL无机盐培养基,将对二甲苯加入摇瓶中间的小管中,以蒸发出来的对二甲苯蒸汽为碳源(图1),置于150 r·min-1、30 ℃的摇床上进行培养。

图1 摇瓶发酵培养示意图
1.3 菌株筛选及鉴定
1.3.1 菌株筛选
取约1 g土样进行富集培养,置于150 r·min-1、30 ℃的摇床上富集2次,每次2 d。然后将稀释菌液涂布于平板的菌种保藏培养基上,待1~2 d长出单菌落后,挑取不同形态单菌落接种到菌种保藏培养基上于4 ℃冰箱保存。将初筛得到的菌株接种至摇瓶进行发酵培养(摇瓶中间的小管子加入1 mL的对二甲苯,对二甲苯作为唯一碳源保证菌体生长,同时可诱导二甲苯单加氧酶产生),培养12 h后加入100 μL 2,5-二甲基吡嗪。培养2 d后,取样离心,过膜处理后用高效液相色谱检测。选择有催化活性的菌株,取转化活性最高的菌株ZJB-LLJ进行鉴定及摇瓶转化条件优化实验。
1.3.2 生理生化鉴定
利用Biolog自动微生物鉴定系统对菌株ZJB-LLJ进行94种表型测试,包括71种碳源利用情况检测以及23种化学敏感性检测:将菌株接种于BUG平板培养基,33 ℃恒温培养2 d,用无菌棉签将平板上的菌体洗下,与接种液(IF-A)混合,制成菌悬液,用浊度计调整至95%T。用8孔电动加液器将菌悬液分别加入微孔鉴定板的各孔中,每孔100 μL。将微孔鉴定板放在33 ℃培养箱中,分别在培养12 h和24 h后将其置于Biolog读数仪上读取结果。
1.3.3 遗传学鉴定
以提取到的细胞总DNA为模板,利用设计一对引物(p16S-8:5′-AGA GTTT GAT CCT GGC TCA G-3′及p16S-1541:5′-AAG GAG GTG ATC CAG CCG CA-3′)扩增菌株ZJB-LLJ的16S rDNA序列,将PCR产物进行0.9%的琼脂糖凝胶电泳。
1.4 转化条件优化
1.4.1 转化进程实验
从斜面上挑取一环菌体接种到种子培养基中培养(500 mL摇瓶装液量为100 mL、30 ℃、150 r·min-1,以下没有特别说明均为此条件)。0~12 h,每2 h取样一次;12~36 h,每4 h取样一次。采用比浊法测菌悬液650 nm处的吸光度以确定其生物量。
以5%的接种量将12 h的种子液接入已灭菌的发酵培养基中(摇瓶小管中加入1 mL对二甲苯)培养,培养12 h后加入底物2,5-二甲基吡嗪200 μL。整个培养过程每4 h取样一次直到60 h。
1.4.2 转化条件的优化
以5%的接种量接种12 h的种子液到发酵培养基中(摇瓶小管中加入1 mL对二甲苯),置于30 ℃摇床中培养12 h后,加入底物2,5-二甲基吡嗪200 μL(100 μL对应底物浓度为1 g·L-1)继续培养48 h,每12 h取样一次。用1 mol·L-1NaOH溶液调节pH值7~8保持恒定。
固定其它条件不变,考察碳源(二甲苯、对二甲苯、间二甲苯、邻二甲苯)、底物加入时间(0 h、3 h、6 h、9 h、12 h、15 h、18 h、21 h、24 h)、温度(20 ℃、30 ℃、40 ℃)、发酵培养基pH值(6、7、8、9、10)、初始底物浓度(1 g·L-1、2 g·L-1、3 g·L-1、4 g·L-1、5 g·L-1、6 g·L-1、7 g·L-1、8 g·L-1、9 g·L-1、10 g·L-1)对产5-甲基吡嗪-2-羧酸的影响。其中考察pH值影响时取样时间调整为培养6 h、12 h、18 h、24 h、36 h、48 h、60 h;考察初始底物浓度时:1~5 g·L-1每12 h取样一次直到120 h;6~10 g·L-1每24 h取样一次直到312 h。
最后考察分批流加的影响:按上述方法培养12 h加入100 μL 2,5-二甲基吡嗪之后,每12 h流加100 μL 2,5-二甲基吡嗪直到144 h,之后每24 h流加100 μL 2,5-二甲基吡嗪直到480 h。每次加底物前取样一次并调节pH值在7~8之间。培养至528 h再取样一次。
1.5 分析与检测
先测样品OD650值及pH值,然后12 000 r·min-1离心6 min,取上清过膜处理后用高效液相色谱检测。色谱条件为:ODS C18反相色谱柱(250 mm×4.6 mm,5 μm,大连依利特);流动相为乙腈-水(3∶7,体积比),流速1.0 mL·min-1,紫外检测波长275 nm,进样量10 μL,柱温40 ℃。转化液经过减压蒸馏,然后冷藏降温,用浓盐酸酸析得部分产物,酸析完的母液用戊酮萃取,萃取液减压蒸馏得部分产物,进行质谱分析。
2 结果与讨论
2.1 菌株的筛选
实验初筛得到85株菌,复筛得到3株可以将2,5-二甲基吡嗪选择性氧化为5-甲基吡嗪-2-羧酸的菌株,从中选出一株氧化活性最强的菌株ZJB-LLJ,菌落形态较小(图2a),无褶皱,圆形,边缘光滑,有光泽,乳黄色,半透明。扫描电镜观察细胞呈椭球形,长约0.8 μm,直径约0.4 μm(图2b)。

图2 菌株ZJB-LLJ单菌落形态(a)和扫描电镜下的形态(b)
2.2 菌株ZJB-LLJ的生理生化鉴定结果(表1、表2)

表1 菌株ZJB-LLJ对Biolog GEN Ⅲ板上71种碳源的利用能力

表2 菌株ZJB-LLJ对Biolog GEN Ⅲ板上23种化学物质的化学敏感性
由表1可知,菌株ZJB-LLJ可较强利用27种碳源,对蔗糖等44种碳源不能利用或利用能力较弱。由表2可知,菌株ZJB-LLJ在pH值低于5、NaCl浓度高于4%下不能生长,另外对梭链孢酸等15种化学物质敏感。Biolog系统鉴定菌株ZJB-LLJ为Pseudomonasputida。
2.3 菌株ZJB-LLJ的遗传学鉴定
2.3.1 16S rDNA序列扩增
经PCR扩增成功获得了长约为1.5 kb的片段,将经PCR扩增的片段克隆到pMD18-T(TaKaRa)、抽提质粒后的含有本实验获得的16S rDNA片段的重组质粒,经上海生工生物工程有限公司测序得到16S rDNA全序列,长度为1529 bp,该序列在GenBank上的登录号为JQ824856。
2.3.2 菌种属种的确定
测得的基因序列通过Blast 程序与GenBank 中的核酸数据库进行对比分析(http://www.ncbi.nlm.nih.gov/blast),测得的16S rDNA 全序列用CLUSTAL W ver.1.81A 软件包进行排序[14],利用MEGA version 2.1[15]软件包中的Kimura2-Parameter Distance模型计算进化距离,再用Neighour-Joining法构建系统发育树,1000次随机抽样,计算自引导值(Bootstrap),以评估系统发育树的置信度。结果见图3。

图3 基于16S rDNA的菌株ZJB-LLJ系统进化树
由图3可知,微生物ZJB-LLJ与Pseudomonasputida的遗传距离最小,同源性达99%,由此可以确定该菌株为Pseudomonasputida,中文名称为恶臭假单胞菌,该结果与Biolog的鉴定结果相吻合。该菌种已保藏于中国典型培养物保藏中心,保藏编号为CCTCC M 2011395。
2.4 转化条件的优化
2.4.1 底物与产物的高效液相色谱分析和质谱分析
2,5-二甲基吡嗪与5-甲基吡嗪-2-羧酸的标准品和发酵转化液的液相色谱见图4。

图4 2,5-二甲基吡嗪与5-甲基吡嗪-2-羧酸的液相色谱图
由图4可知,标准品和发酵转化液的保留时间一致。
发酵转化液经质谱分析,ESI-MS,m/z:139(M+1),与5-甲基吡嗪-2-羧酸分子量一致。
2.4.2 转化进程
测得菌株ZJB-LLJ转化2,5-二甲基吡嗪为5-甲基吡嗪-2-羧酸的过程曲线见图5。
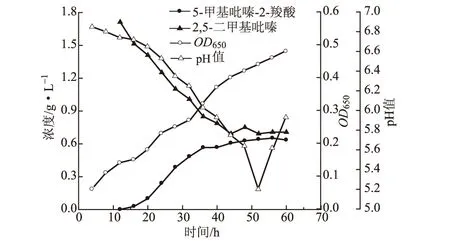
图5 菌株ZJB-LLJ转化2,5-二甲基吡嗪为5-甲基吡嗪-2-羧酸的过程曲线
由图5可知,菌株从5 h开始进入对数生长期,12 h后进入稳定期,因此后续的转化培养选择12 h的种子液。转化过程中,菌体量不断增加,培养60 h时OD650最大,为0.48。培养12 h后加入底物2,5-二甲基吡嗪,底物浓度由1.71 g·L-1逐渐减小,培养44 h时出现最小值0.69 g·L-1;同时产物5-甲基吡嗪-2-羧酸浓度逐渐增大,44 h后达到0.65 g·L-1,接近最大值,由此,可选择48 h取样。pH值由6.8逐渐减小,52 h时达到最小值5.2,之后又有所回升,这可能是因为菌种生长进入衰亡期释放出碱性物质。
2.4.3 转化条件的优化
2.4.3.1 碳源(图6)

图6 不同碳源对产5-甲基吡嗪-2-羧酸的影响
由图6可知,二甲苯、对二甲苯、间二甲苯为碳源及诱导剂的产物产生趋势基本一样,培养60 h时产物浓度达到最高,分别为0.52 g·L-1、0.50 g·L-1和0.49 g·L-1,但加对二甲苯前12 h产物积累的速度明显要快。而加邻二甲苯的整个过程没有产物积累。另外,对二甲苯的价格及毒性较低,综合考虑,选择对二甲苯为碳源,并诱导单加氧酶的产生。
2.4.3.2 底物加入时间(图7)

图7 底物加入时间对产5-甲基吡嗪-2-羧酸的影响
由图7可知,0 h即转接完种子液后立即加入底物的产物浓度为0.24 g·L-1;12 h之前,随着底物加入时间的延长,产物浓度逐渐增大;12 h时加入底物,产物浓度最大,为0.63 g·L-1;此后随着底物加入时间的继续延长,产物浓度开始减小。因此,选择底物加入时间为12 h。
2.4.3.3 培养温度(图8)

图8 培养温度对产5-甲基吡嗪-2-羧酸的影响
由图8可知,反应12 h时30 ℃与40 ℃的产物浓度都大于0.21 g·L-1,20 ℃的产物浓度较低,为0.08 g·L-1;30 ℃的产物积累速度明显高于20 ℃与40 ℃,在60 h时产物浓度达到最大值1.89 g·L-1,远远高于20 ℃和40 ℃的最大产物浓度。因此,选择培养温度为30 ℃。
2.4.3.4 pH值(图9)
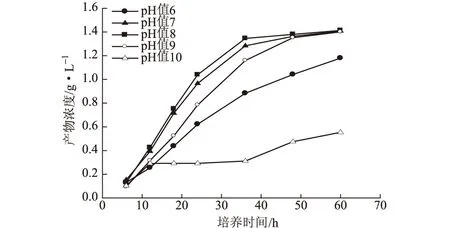
图9 pH值对产5-甲基吡嗪-2-羧酸的影响
由图9可知,pH值为8时整个转化过程的产物积累量都为最大,pH值为7、 8、 9的最终产物浓度均达到1.41 g·L-1左右,pH值为6、10的最终产物浓度较低,分别为1.18 g·L-1、0.55 g·L-1。这说明中性偏碱性的转化环境最适合产物的积累。
2.4.3.5 初始底物浓度(图10)
由图10可知,初始底物浓度越大,反应速度越慢。可能存在一定的底物抑制。初始底物浓度为1 g·L-1、2 g·L-1、3 g·L-1、4 g·L-1、5 g·L-1、6 g·L-1、7 g·L-1时,反应分别在36 h、48 h、120 h、120 h、120 h、240 h、240 h时基本完全,最终产物浓度分别为1.02 g·L-1、1.56 g·L-1、2.02 g·L-1、2.41 g·L-1、2.52 g·L-1、6.35 g·L-1、6.53 g·L-1;初始底物浓度为8 g·L-1、9 g·L-1、10 g·L-1时,在最后312 h取样的产物浓度分别达到7.42 g·L-1、7.05 g·L-1、6.00 g·L-1,但并未达到最大值,考虑转化时间太长没有继续取样。从图10还可知,初始底物浓度过大时,开始阶段的底物抑制较强烈,随着反应的进行,产物生成速率显著加快,且菌株度过抑制期后,随着初始底物浓度的增大,产物积累速率也明显提高。这表明,菌株对环境有一定的适应能力,当菌株适应了高浓度底物的环境后,就可以快速对底物进行氧化,且氧化速率随着底物初始浓度的增大而加快。

图10 初始底物浓度对产5-甲基吡嗪-2-羧酸的影响
2.4.3.6 分批流加
考虑到初始底物浓度过大会有相当长的抑制期,而初始底物浓度过小时,产物积累量又较少,采用分批流加的方式来生产5-甲基吡嗪-2-羧酸,结果见图11。

图11 分批流加生产5-甲基吡嗪-2-羧酸
由图11可知,采用流加方式,相比一开始就加高浓度的底物,积累5-甲基吡嗪-2-羧酸的速率可以一直保持在3.80 mg·h-1以上,反应528 h时取样,产物浓度达20.41 g·L-1,产率达到75.6%。
3 结论
从土壤中筛选得到一株可以选择性氧化2,5-二甲基吡嗪生成5-甲基吡嗪-2-羧酸的产单加氧酶菌株ZJB-LLJ,经过生理生化鉴定及16S rDNA序列分析确定为恶臭假单胞菌。并对其转化2,5-二甲基吡嗪产5-甲基吡嗪-2-羧酸的条件进行了优化,结果表明在500 mL摇瓶中装液100 mL、温度为30 ℃、pH值为7~8、以对二甲苯为唯一碳源、诱导培养12 h后添加底物的条件下,产物积累量最大;采用分批流加的方式积累产物较快,转化528 h后5-甲基吡嗪-2-羧酸浓度达20.41 g·L-1,产率达到75.6%。菌株ZJB-LLJ可以有效地将2,5-二甲基吡嗪氧化成5-甲基吡嗪-2-羧酸,具有区域选择性高、反应条件温和、转化率较高等优点,如经过进一步发酵罐优化后,有望达到工业生产的要求。
参考文献:
[1] Vontor T,Palat K,Oswald J,et al.Antituberculotics.Ⅻ.Functional derivatives of 5-methyl-2-pyrazinecarboxylic acid[J].Cesk Farm,1985,34(2):74-78.
[2] Klein B,Berkowitz J.Pyrazines.Ⅰ.Pyrazine-N-oxides.Preparation and spectral characteristics[J].Journal of the American Chemical Society,1959,81(19):5160-5166.
[3] Klein B,Berkowitz J.Pyrazines.Ⅱ.The rearrangement of pyraz-ine-N-oxides[J].Journal of Organic Chemistry,1961,26(1):126-131.
[4] Pitre D,Boveri S,Grabitz E B.Notizuber 5-methyl-und 6-methyl pyrazin-carbonsaure(2)[J].Chemische Berichte,1966,99(1):364-367.
[5] Newkome G R,Kiefer G E,Xia Y J,et al.α-Methyl functionalization of electron-poor heterocycles:Free radical chlorination[J].Synthesis,1984,(8):676-679.
[6] Lovel I,Goldberg Y,Shymanska M.An improved synthesis of 2-methyl-pyrazine-5-carboxylic acid[J].Organic Preparations and Procedures International,1991,23(2):188.
[7] 肖月华,沈兆军,王海昕,等.阿西莫司中间体合成[J].齐鲁药事,2005,24(10):617.
[8] 冯亚青,徐骥,张宝.用KMnO4一步氧化制备5-甲基吡嗪-2-羧酸的方法[P].CN 1 365 974,2002-08-28.
[9] Tinschert A,Tschech A,Heinzmann K,et al.Novel regioselective hydroxylations of pyridine carboxylic acids at position C2 and pyrazine carboxylic acid at position C3[J].Appl Microbiol Biotechnol,2000,53(2):185-195.
[10] Rappert S,Li R J,Kokova M,et al.Degradation of 2,5-dimethylpyrazine byRhodococcuserythropolisstrain DP-45 isolated from a waste gas treatment plant of a fishmeal processing company[J].Biodegradation,2007,18(5):585-596.
[11] Kiener A.Enzymatic oxidation of methyl groups on aromatic heterocycles:A versatile method for the preparation of heteroaromatic carboxylic acids[J].Angew Chem Int Ed Engl,1992,31(1):774-775.
[12] Takahiro M,Hiroshi I,Hitoshi K.Oxidation of both termini ofp- andm-xylene byEscherichiacolitransformed with xylene monooxygenase gene[J].Journal of Molecular Catalysis B:Enzymatic,2003,21(4-6):211-219.
[13] Kiener A.Microbiological oxidation of methyl groups in heterocycles[P].USP 5 104 798,1992-04-14.
[14] Thompson J D,Higgins D G,Gibson T J.Improving the sensitivity of progressive multiple sequence alignment through sequence weighting,position specific gap penalties and weight matrix choice[J].Nucleic Acids Res,1994,22(22):4673-4680.
[15] Kimura M.A simple method for estimating evolutionary rates of base substitutions through comparative studies of nucleotide sequences[J].Journal Mol Evol,1980,16(2):111-120.
