二氮嗪后处理对缺血/再灌注心肌的保护作用及其与PI3K/Akt信号通路的关系
2012-07-28赵其宏梁启胜栾恒飞曾因明
赵其宏,张 颖,梁启胜,栾恒飞,叶 英,曾因明
(1.蚌埠医学院第一附属医院麻醉科,安徽 蚌埠 233004;2.江苏省麻醉学重点实验室,江苏徐州 221002)
二氮嗪是美国60代初期合成的噻嗪类衍生物,早期临床上用于治疗高血压危象。自Garlid等[1]1997年首次报道二氮嗪预处理通过开放心肌细胞线粒体ATP敏感性钾通道产生与缺血预处理类似的心肌保护效应以来,众多研究显示,二氮嗪预处理[2]和后处理[3]均是通过开放线粒体 ATP敏感性钾通道而发挥心肌保护效应的。但最近研究表明[4],二氮嗪预处理减轻心肌缺血/再灌注(ischemia/reperfusion,I/R)损伤的作用还与磷脂酰肌醇-3-激酶/蛋白激酶 B(phosphatidylinositol 3-kinase/protein kinase B,PI3K/Akt)信号通路有关。PI3K/Akt信号通路是细胞内重要的生存通路,该通路于心肌I/R期间的急性激活参与多种药物后处理的心肌保护作用[5-6]。但在二氮嗪后处理中,PI3K/Akt信号通路的作用尚未见报道。本文旨在研究PI3K/Akt信号通路在二氮嗪后处理心肌保护中的作用,为二氮嗪用于心肌保护提供新的理论依据。
1 材料与方法
1.1 药品与试剂 二氮嗪、wortmannin(Sigma);氯化三苯基四氮唑(tripheny tetrazolium chloride,TTC)(Amresco);兔抗磷酸化Akt(Ser473)多克隆抗体(Cell Signaling);兔抗Akt多克隆抗体(Bioworld);小鼠抗β-actin单克隆抗体、碱性磷酸酶标记山羊抗兔lgG、碱性磷酸酶标记马抗小鼠lgG(中杉金桥生物公司);TUNEL试剂盒(Roche)。
1.2 仪器 DH-150型小动物呼吸机(浙江大学医学仪器厂,杭州),BL-420s生物机能实验系统(泰盟科技有限公司,成都),TE-312型微量注射泵(Terumo公司,日本),Bx50F4型光学显微镜(Olympus公司,日本);COOLPIX S1型照相机(Nikon公司,日本)。
1.3 动物与分组 60只清洁级成年♂SD大鼠(由徐州医学院实验动物中心提供),体质量250~300 g,随机分为5组(n=12):假手术组(S组)、I/R组、二氮嗪后处理组(D组)、wortmannin组(W组)和二氮嗪后处理+wortmannin组(D+W组)。
1.4 方法 参照文献[7-8],稍作改进建立动物模型:腹腔注射10%水合氯醛(400 mg·kg-1)麻醉,肝素钠(500 U·kg-1)抗凝,记录Ⅱ导联心电图,股静脉穿刺后连接输液泵,气管插管,机械通气(呼吸频率:75次/min;潮气量:6~8 ml;吸 ∶呼=1∶2),胸骨左缘3~4肋间进胸暴露心脏,在左心耳根部与肺动脉圆锥间下方约2 mm处进针、穿线(横跨左冠状动脉前降支),在线环内放一小段硅胶管,稳定20 min后结扎缝线30 min,剪断线结进行再灌注120 min。S组只穿缝线,不结扎,25 min后经股静脉输入0.1%DMSO;其余各组均进行30 min缺血和120 min再灌注。缺血25 min后,I/R组、D组、W组和D+W组分别经股静脉输注0.1%DMSO、二氮嗪28 mg·kg-1·h-1、PI3K 抑制剂 wortmannin 60 μg·kg-1·h-1和二氮嗪 28 mg·kg-1·h-1,其中 D+W组于输注二氮嗪前5 min静脉输注wortmannin 60 μg·kg-1·h-1,所有药物均持续输注 15 min;二氮嗪和wortmannin均用0.1%DMSO稀释。
1.5 指标检测
1.5.1 心功能指标 气管插管机械通气后,每组取8只大鼠,用动脉夹阻断右颈总动脉血流并在其上剪一V字型破口,将充满肝素水且一端连接BL-420s生物机能实验系统的PE-50导管逆行插管至左心室,连续监测心率(HR)、左室发展压(LVDP)和左室舒张末压(LVEDP)。
1.5.2 心肌梗死面积比率 每组取6只大鼠,再灌注末取下心脏并置于-20℃冰箱中10 min,取出后沿垂直心脏纵轴方向从心尖到结扎线下方将其切成2~3 mm厚的薄片,共5片,然后置于1%TTC磷酸盐缓冲液(pH=7.4)中,37℃孵育15 min,4%中性甲醛固定过夜,梗死区心肌为灰白色;心肌梗死面积比率/%=所有切片梗死面积之和/(左心室面积+右心室面积)×100%。
1.5.3 心肌凋亡率 每组取3只大鼠,再灌注末迅速剪取左心室前壁心肌组织浸入4%中性甲醛中固定24 h,自动脱水机脱水,石蜡包埋、切片,按TUNEL试剂盒说明进行染色,凋亡的细胞核被染成棕褐色,未凋亡的细胞核为深蓝色。高倍镜(×400)下每张切片随机选取10个互不重叠视野计算凋亡率:凋亡率/%=(视野内凋亡细胞个数/视野内所有细胞个数)×100%。
1.5.4 p-Akt与总 Akt表达情况 每组取3只大鼠,实验结束后迅速剪取左心室前壁心肌组织,立即放入-70℃冰箱中保存,标本取齐后在冰上剪碎、匀浆、裂解,4℃ 12 000×g离心10 min,取上清,蛋白浓度配平、变性后放入-20℃冰箱中备用。取等量蛋白样品进行SDS-PAGE电泳,分离后将蛋白电转移至硝酸纤维素膜上。5%脱脂奶粉中室温封闭2 h。加入1∶1 000的小鼠抗β-actin单克隆抗体或兔抗p-Akt(Ser473)多克隆抗体或兔抗Akt多克隆抗体中,4℃孵育过夜。取出后漂洗,加入碱性磷酸酶标记的二抗(1∶1 000),振荡孵育2 h。漂洗后,BCIP/NBT碱性磷酸酯酶显色试剂盒显色。条带扫描后分析灰度值。
1.6 统计学处理 用 SPSS 13.0软件进行统计学处理,数据以±s表示。心功能指标分析采用双因素重复测量方差分析;其余数据采用单因素方差分析,两两比较采用LSD法。
2 结果
2.1 心功能指标 各组缺血前心功能指标差异无统计学意义(P>0.05)。再灌注120 min后,与S组相比,其余4组HR和LVDP降低而LVEDP增加(P<0.01);与I/R组比,D组与D+W组LVDP增加(P<0.01),LVEDP降低(P<0.05或0.01);与 D组比,D+W组LVDP降低(P<0.05)。见Tab 1。
2.2 心肌梗死面积 除S组外,其余4组再灌注末均有明显的心肌梗死发生。与I/R组相比,D组和D+W组心肌梗死面积明显减小(P<0.01或0.05);与D组比,D+W组心肌梗死面积增加(P<0.05)。见Fig 1。
2.3 心肌细胞凋亡率 与S组相比,其余4组凋亡率增加(P<0.01);与I/R组相比,D组与D+W组凋亡率降低(P<0.01);与D组比,D+W组凋亡率增加(P<0.05)。见Fig 2。
2.4 p-Akt的表达情况 D组p-Akt表达水平明显高于其余4组(P<0.01);I/R组、S组和D+W组间差异无统计学意义(P>0.05)。见Fig 3。
3 讨论
本实验采用的在体左冠状动脉前降支结扎术是国内外常用的模型,具有很好的稳定性和重复性。本研究结果表明,再灌注120 min后,除S组外,其余4组均发生明显的心肌梗死,提示心脏I/R模型制备成功。心肌I/R损伤与其经受缺血时间的长短有关,本研究采用的缺血30 min、再灌注120 min能够很好地诱导心肌I/R损伤[7]和心肌凋亡[8]。
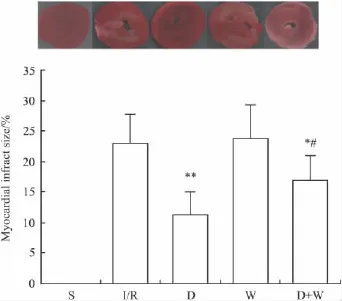
Fig 1 Myocardial infarct size at 120 min reperfusion after 30 min ischemia in different groups(±s,n=6)
Tab 1Comparation of hemodynamic parameter among five groups(±s,n=8)

Tab 1Comparation of hemodynamic parameter among five groups(±s,n=8)
*P<0.05,**P<0.01 vs baseline;+P<0.05,++P<0.01 vs S;#P<0.05,##P<0.01 vs I/R;△P<0.05 vs D
Variable Group Baseline 30 min ischemia 120 mi n reperfusion HR/beats·min-1 S 372±44 370±41 342±38**I/R 366±42 301±29**++ 256±31**++D 379±48 316±44**+ 300±51**+#W 360±38 302±39**++ 248±25**++D+W 351±36 319±44**+ 280±49**++LVDP/kPa S 16.3 ±2.3 16.0 ±2.2 15.6 ±1.6*I/R 17.1 ±1.9 11.2 ±0.7**++ 4.8 ±0.8**++D 15.8 ±1.9 10.6 ±0.9**++ 8.6 ±0.9**++##W 16.5 ±2.3 11.3 ±1.0**++ 4.5 ±0.3**++D+W 16.0 ±1.6 10.8 ±0.8**++ 6.7 ±0.6**++##△LVEDP/kPa S 0.20 ±0.19 0.20 ±0.20 0.23 ±0.28 I/R 0.06 ±0.22 1.30 ±0.54**++ 2.12 ±0.50**++D 0.13 ±0.29 1.07 ±0.46**++ 1.20 ±0.37**##W 0.24 ±0.19 1.43 ±0.62**++ 2.18 ±0.65**++D+W 0.23 ±0.30 1.08 ±0.54**++ 1.65 ±0.37**++#
HR和LVDP均是反映左心室收缩功能的指标,但LVDP更敏感;LVEDP则反映左心室的舒张功能。本实验显示二氮嗪后处理能够明显改善心肌收缩和舒张功能,而PI3K抑制剂wortmannin则部分逆转左心室收缩功能的改善。本研究还提示,wortmannin部分消除二氮嗪后处理减小大鼠在体I/R心肌的梗死面积,与 Matejíková 等[4]对二氮嗪预处理离体灌注大鼠心脏的研究结果相似。此外,二氮嗪后处理还明显减少I/R诱导的心肌凋亡,wortmannin部分消除这一作用。进一步Western blot分析p-Akt显示,二氮嗪后处理引起p-Akt表达的增加;而wortmannin消除这一效应。p-Akt表达水平的变化与心肌保护效应变化的趋势一致;但wortmannin完全抑制PI3K/Akt信号通路后,二氮嗪后处理的心肌保护效应只是部分被消除,说明尚有其他机制参与,本实验未作进一步研究。
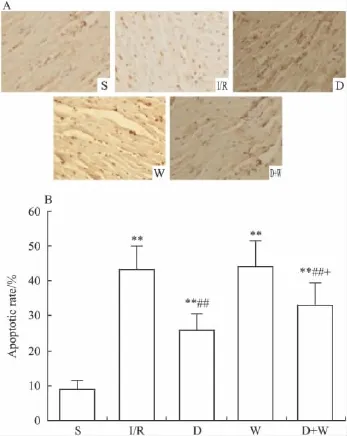
Fig 2 A:Apoptotic cells in rat hearts detected by TUNEL staining at 120 min reperfusion after 30 min ischemia in different groups(×400,bar=50μm);B:Apoptotic rate of myocardial cells at 120 min reperfusion after 30 min ischemia in different groups(±s,n=3)
本研究选择的二氮嗪剂量为7 mg·kg-1,这一剂量已被证实对大鼠心肌具有良好的保护作用[2]。本实验选用的PI3K抑制剂为wortmannin,它与ATP催化位点共价结合而不引起电生理效应[9];因此,不影响心肌收缩和舒张功能。此外,本实验所用的wortmannin剂量能够很好地阻断缺血预处理[10]和缺血后处理[11]引起的Akt磷酸化。
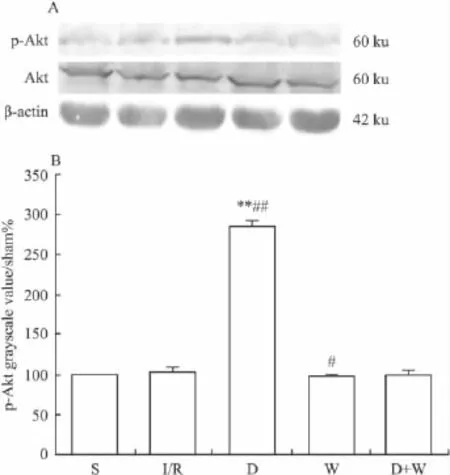
Fig 3 A:Western blot Akt and p-Akt in myocardial tissue at 120 min reperfusion after 30 min ischemia;B:Graphic presentation of p-Akt in myocardial tissue at 120 min reperfusion after 30 min ischemia(±s,n=3)
综上所述,本研究结果提示二氮嗪后处理部分通过激活PI3K/Akt信号通路减轻大鼠在体心肌I/R损伤,但PI3K/Akt信号通路是通过何种机制被激活以及该通路活化后如何发挥心肌保护作用,还有待于进一步研究。
[1] Garlid K,Paucek P,Yaro-Yarovoy V,et al.Cardioprotective effect of diazoxide and its interaction with mitochondrial ATP-sensitive K+channels:possible mechanism of cardioprotection[J].Circ Res,1997,81(6):1072 -82.
[2] Ahmad N,Wang Y,Haider K H,et al.Cardiac protection by mitoKATP channels is dependent on Akt translocation from cytosol to mitochondria during late preconditioning[J].Am J Physiol Heart Circ Physiol,2006,290(6):H 2402 -8.
[3] 段忠心,刘兴奎,喻 田.二氮嗪后处理对大鼠离体心脏缺血再灌注损伤的影响[J].中华麻醉学杂志,2010,30(10):1163-7.
[3] Duan Z X,Liu X K,Yu T.Effects of diazoxide postconditioning on myocardial ischemia-reperfusion injury in isolated rat hearts[J].Chin J Anesthesiol,2010,30(10):1163 -7.
[4] Matejíková J,Ravingerová T,Pancza D,et al.Mitochondrial KATP opening confers protection against lethal myocardial injury and ischaemia-induced arrhythmias in the rat heart via PI3K-Aktdependent and-independent mechanisms[J].Can J Physiol Pharmacol,2009,87(12):1055 -62.
[5] 于 水,杨海扣,米 琰,等.PI3K/Akt信号通路在外源性硫化氢后处理大鼠离体心肌中的作用[J].中国药理学通报,2010,26(6):421-6.
[5] Yu S,Yang H K,Mi Y,et al.Function of PI3K/Akt signaling pathway in exogenous hydrogen sulfide postconditioning on isolated rat hearts[J].Chin Pharmacol Bull,2010,26(6):421 -6.
[6] 张 珺,刘金东.七氟烷预处理对成年及幼年大鼠心肌缺血/再灌注损伤保护作用的对比研究[J].中国药理学通报,2011,27(8):1116-20.
[6] Zhang J,Liu J D.A contrast study on sevoflurane preconditioning against myocardial ischemia/reperfusion injury in adult and young rat hearts[J].Chin Pharmacol Bull,2011,27(8):1116 -20.
[7] 张羽冠,宋宏宇,李 蓥,等.蒺藜皂甙预适应对大鼠心肌缺血/再灌注损伤的保护作用[J].中国药理学通报,2010,26(6):714-8.
[7] Zhang Y G,Song H Y,Li Y,et al.[J].Protective effects of GSTT preconditioning on myocardial ischemia-reperfusion injury in rats[J].Chin Pharmacol Bull,2010,26(6):714 -8.
[8] 姚玲玲,黄晓伟,朱依纯.离体和在体大鼠心肌细胞凋亡模型的建立[J].中国药理学通报,2011,27(6):879 -81.
[8] Yao L L,Huang X W,Zhu Y C.Establishment of the in vitro and in vivo cardiomyocyte apoptosis model[J].Chin Pharmacol Bull,2011,27(6):879 -81.
[9] Sun H,Oudit G Y,Ramirez R J,et al.The phosphoinositide 3-kinase inhibitor LY294002 enhances cardiac myocyte contractility via a direct inhibition of Ik,slow currents[J].Cardiovasc Res,2004,62(3):509-20.
[10] Mocanu M M,Bell R M,Yellon D M.PI3 kinase and not p42/p44 appears to be implicated in the protection conferred by ischemic preconditioning[J].J Mol Cell Cardiol,2002,34(6):661 -8.
[11] Manintveld O C,Te Lintel Hekkert M,van den Bos E J,et al.Cardiac effects of postconditioning depend critically on the duration of index ischemia[J].Am J Physiol Heart Circ Physiol,2007,292(3):H 1551-60.
