内源性中叶素可减轻血管紧张素Ⅱ诱导的乳鼠心肌细胞肥大
2012-07-28杨靖辉马存根齐永芬唐朝枢
杨靖辉,马存根,齐永芬,唐朝枢
(1.山西大同大学脑科学研究所,山西大同 037009;2.北京大学医学部生理系,北京 100083)
多种疾病状态下,心脏局部中叶素(IMD)的生成、表达会发生明显改变。文献报道,自发性高血压大鼠及肾性高血压大鼠心脏IMD基因表达增加[1-2],而离体缺血/再灌注损伤大鼠心脏组织IMD生成则明显减少[3]。上述结果提示IMD作为一种重要的旁/自分泌因子参与了疾病状态下心脏功能的调节。心肌肥厚是多种心血管疾病的一种后期病理改变,以心肌细胞肥大和间质成分改变为主的心脏重塑是心肌肥厚的主要表现形式。在体实验显示,肥厚的大鼠心脏 IMD 表达增加[4-5],但在心肌细胞IMD生成表达是否也具有类似的变化,文献尚未见报道。
本试验以血管紧张素Ⅱ(AngⅡ)作用于培养的乳鼠心肌细胞构建肥大模型,观察心肌细胞肥大过程中IMD及其受体系统生成表达的变化,并探讨内源性IMD在心肌肥大过程中的作用。
1 材料与方法
1.1 材料 新生Wistar大鼠(1~3 d)由北京大学医学部实验动物中心提供。大鼠AngⅡ、IMD1-53、CGRP8-37、ADM22-52、兔抗大鼠IMD抗血清及放射免疫测定试剂盒由Phoenix Pharmaceutical Inc(USA)提供。[3H]-Leu、PVDF膜、ECL试剂盒购自Amersham Life Science(England),总RNA提取试剂盒购自Gibco-BRL(Grand Island,NY),反转录试剂盒购自 Gibco-BRL,Life Technologies,Inc(Gaithersburg,MD),Real time PCR反应引物购自北京奥科公司。余为市售分析纯产品。
1.2 方法
1.2.1 乳鼠心肌细胞的培养 取新生Wistar鼠心脏,去除心房及血管后剪碎心室,以1 mmol·L-1胰酶37℃消化成细胞悬液,过滤,2 000×g离心10 min,用含10%胎牛血清的DMEM培养液重悬浮,差速贴壁90 min后取上清,将细胞悬液接种于培养瓶中,在37℃、5%CO2条件下密闭培养。48 h后换无血清DMEM,培养24 h后将乳鼠心肌细胞随机分为:① 对照组;② AngⅡ(10-7mol·L-1)孵育组;③AngⅡ +IMD(10-7mol·L-1)组;④ AngⅡ +IMD抗血清(1∶100)组;⑤ AngⅡ+IMD受体阻断剂组(ADM22-52 或 CGRP8-37,均为 10-6mol·L-1)组。所有试验细胞经鉴定95%以上为心肌细胞,95%以上为活细胞。
1.2.2 [3H]-Leu摄入测定 无血清培养24 h后的乳鼠心肌细胞加入不同干预药物,孵育12 h后,分别加入[3H]-Leu(37 kBq·L-1)继续孵育24 h,冷PBS液终止反应,并洗两遍,细胞以10%三氯醋酸4℃孵育20 min,再经95%乙醇冲洗。收集细胞,以0.5 mol·L-1NaOH融解2 h后加入闪烁液,于β液闪仪上测量[3H]放射活性,以cpm/105细胞表示[3H]-Leu的摄入率。
1.2.3 Real time PCR 方法[6]测定乳鼠心肌细胞BNP、IMD、CRLR、RAMP 1、RAMP 2、RAMP 3 mRNA水平 无血清培养24 h后的乳鼠心肌细胞加入不同干预药物,孵育12 h后,用TRIzol一步法提取细胞总RNA,逆转录成cDNA。Real time PCR反应总体积为 20 μl,其中包括定量 PCR 预混合液 10 μl、前向引物和反向引物(20 mmol·L-1)各 1.8 μl、Probe 0.5 μl、产物 cDNA 0.5 μl、其余用无 RNase 水补足。反应条件:95℃ 5 min;95℃ 30 s;57℃ 30 s;72℃ 30 s,40个循环。测定各模板Ct值,通过Ct值以GAPDH为内参,进行相对定量。相关引物和荧光探针列于Tab 1。
1.2.4 放射免疫法测定IMD含量 收集对照组及AngⅡ孵育12 h后的上清液加入0.5 ml的0.1 mol·L-1醋酸,煮沸10 min,10 000 ×g 离心 15 min,取上清液参照IMD放免试剂盒说明书测定IMD含量,并以 μg·L-1表示。
1.2.5 Western blot分析法 无血清培养24 h后的乳鼠心肌细胞分为对照组和AngⅡ孵育组,培养12 h后收集蛋白,取样本总蛋白30 μg进行聚丙烯酰胺凝胶电泳,分离胶浓度为12%,之后将蛋白转移到PVDF膜上,在含5%脱脂奶粉的TBS-T缓冲液中,封闭1 h。漂洗后PVDF膜与兔抗大鼠IMD抗体(1∶200)4℃孵育过夜,经漂洗再与羊抗兔IgG二抗(1∶500)室温孵育1 h,ECL显色,结果以β-actin标准化。

Tab 1 Primers and fluorescent probes
2 结果
2.1 AngⅡ对乳鼠心肌细胞IMD及其受体系统基因表达的影响 Real-time PCR结果显示AngⅡ(10-7mol·L-1)孵育 12 h后乳鼠心肌细胞 IMD mRNA表达较对照组降低46%,RAMP 1,RAMP 3 mRNA表达较对照组分别增强49%和135%(均P<0.01),CRLR及RAMP 2 mRNA表达较对照组无差异(Fig 1)。
2.2 AngⅡ抑制乳鼠心肌细胞IMD产生和分泌Western blot结果显示,与对照组相比AngⅡ孵育可降低心肌细胞IMD蛋白表达。同时,放射免疫分析结果显示,AngⅡ孵育组较对照组心肌细胞培养上清液中IMD含量明显降低(6.66±0.65 vs 10.62±0.92 μg·L-1)(均 P <0.01,Fig 2)。
2.3 IMD及其抗血清对AngⅡ诱导的乳鼠心肌细胞肥大的影响 本实验以细胞内蛋白合成增加及BNP mRNA表达增强作为心肌细胞肥大指标。以[3H]-Leu参入方法检测乳鼠心肌细胞蛋白合成的变化,以Real-time PCR方法检测乳鼠心肌细胞BNP mRNA 表达。结果显示,AngⅡ(10-7mol·L-1)孵育使乳鼠心肌细胞[3H]-Leu摄入较对照组增加104%(2529±123 vs 1240±53 cpm/105cells,P <0.01,Fig 3A)。同时,BNP mRNA表达较对照组增加197%(P<0.01,Fig 3B)。外源性给以IMD活性片段 IMD1-53(10-7mol·L-1)可明显抑制 AngⅡ所诱导的[3H]-Leu摄入及BNP mRNA表达增加(P<0.01)(Fig 3A,B)。
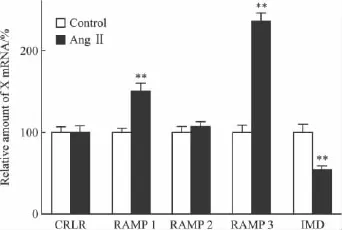
Fig 1 Effects of AngⅡon IMD and its receptor system components mRNA expressions in neonatal cardiomyocytes(±s,n=3)
单独给以正常兔血清或兔抗大鼠IMD抗血清(1∶100)对静止的心肌细胞[3H]-Leu参入及BNP mRNA表达均无明显影响,但以IMD抗血清预孵育可使乳鼠心肌细胞[3H]-Leu参入量较AngⅡ单独作用组增加69%(P<0.01,Fig 3A),BNP mRNA表达较 AngⅡ单独作用组增加61%(P<0.01,Fig 3B)。而正常兔血清预孵育则无上述作用。
2.4 IMD受体阻断剂对AngⅡ诱导的乳鼠心肌细胞肥大的影响 单独给以IMD受体阻断剂ADM22-52或CGRP8-37,二者对静止心肌细胞的[3H]-Leu参入及BNP mRNA表达均无明显影响,如果以受体阻断剂预孵育20 min后再给以AngⅡ刺激,ADM22-52和CGRP8-37可使乳鼠心肌细胞[3H]-Leu参入量较AngⅡ单独作用组分别增加46%和38%(均P<0.01,Fig 4A),BNP mRNA 表达较 AngⅡ单独作用组分别增加44%和45%(均P<0.01,Fig 4B)。
3 讨论
心肌肥大是高血压、瓣膜病、急性心肌梗死及先天性心脏病等临床常见疾病的一种并发症,持续性心肌肥大最终可导致扩张性心肌病、心衰和猝死[7]。同时,心脏具有重要的内分泌功能,能合成和分泌多种循环激素和旁/自分泌物质,参与循环系统的功能、代谢和结构稳态的调节。其中IMD是心脏旁/自分泌的重要物质之一[8-9]。但在离体培养的肥大心肌细胞上IMD及其受体系统生成、表达的变化目前尚未见报道。本工作应用促肥大因子AngⅡ孵育乳鼠心肌细胞构建肥大模型,观察肥大发生过程中,心肌细胞IMD及其受体系统生成、表达的变化。

Fig 2 AngⅡinhibits the production and secretion of IMD in neonatal cardiomyocytes(±s,n=6)
试验结果显示,AngⅡ孵育乳鼠心肌细胞可明显诱导细胞肥大的发生,表现为心肌细胞[3H]-Leu摄入及BNPmRNA表达增加。该结果与文献报道一致[10]。进一步检测肥大心肌细胞IMD及其受体系统生成、表达的变化。结果显示,肥大的心肌细胞IMD产生、分泌及基因表达均明显降低。与此不同的是,有文献报道,在自发性高血压大鼠和一氧化氮缺乏大鼠肥大的左心室组织,IMD基因表达明显增加[4-5]。上述差异可能是由于心脏组织中,除心肌细胞外,成纤维细胞、血管内皮细胞、平滑肌细胞均可生成表达IMD,病理状态下,各种细胞IMD的生成、表达可受到不同形式的调节。因此,在完整心脏与单纯心肌细胞上IMD生成、表达则出现不同。
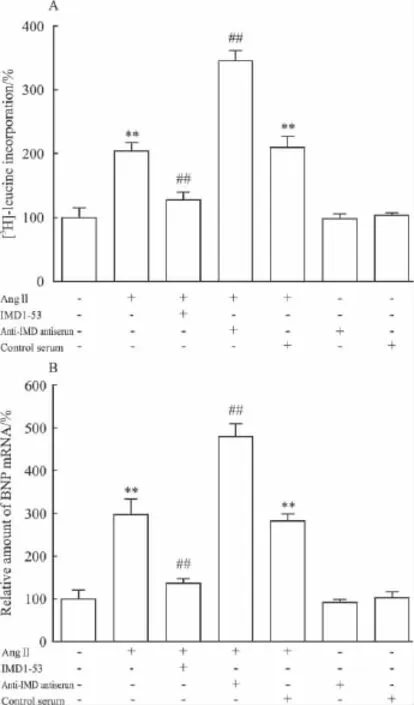
Fig 3 Effects of IMD and prepro-IMD antiserum on AngⅡ-induced myocyte hypertrophic response(±s,n=6)
此外,实验还证实,在肥大的心肌细胞RAMP 1、RAMP 3 mRNA表达明显增强,但CRLR及RAMP 2 mRNA表达无明显变化。CRLR/RAMPs受体系统是CGRP超家族共同的受体系统。已知RAMPs具有3种亚型RAMP 1、RAMP 2和RAMP 3。不同的RAMP与CRLR结合表现为对不同配体具有亲和的,不同的受体表型,从而决定了配体的生物学效应。例如,CRLR与RAMP 1共同作用表现为CGRP受体表型,CRLR与 RAMP 2,3共同作用表现为ADM受体表型。而Roh等[11]的实验证实IMD可作为CRLR/RAMPs复合物的非选择性配体。本实验中RAMP 1、RAMP 3基因表达的上调可促进IMD在心肌肥大发生发展过程中生物学效应的发挥。

Fig 4 Effects of the antagonists of IMD receptor on AngⅡ-induced myocyte hypertrophic response(±s,n=6)
实验还显示,外源性给予IMD的活性片段IMD1-53可明显抑制AngⅡ所诱导的心肌细胞肥大。此外,单独给以IMD抗血清及IMD受体阻断剂ADM22-52和 CGRP8-37,3者对静止心肌细胞的[3H]-Leu参入及BNP mRNA表达均无明显影响,但在给以IMD抗血清阻断内源性IMD的生物学效应,或以ADM22-52或CGRP8-37阻断IMD受体后,再以肥大刺激剂AngⅡ共孵育,则可观察到AngⅡ所诱导的心肌细胞肥大反应明显增强。
上述结果证实IMD具有抗心肌细胞肥大作用,且内源性IMD作为心脏重要的旁/自分泌因子,参与了心肌肥大的发生、发展,并可能在其中发挥重要的调节作用。对内源性IMD及其受体系统生成、表达的干预是否可作为今后防治心肌细胞肥大新的作用途径值得进一步研究。
[1] Zeng Q,Yuan Y,Wang X,et al.Upregulated expression of intermedin and its receptor in the myocardium and aorta in spontaneously hypertensive rats[J].Peptides,2009,30(2):391 -9.
[2] 梁 颖,薛立华,黎济荣,等.Intermedin(1-53)对两肾一夹高血压大鼠的影响及其机制[J].中国药理学通报,2011,27(1):46-9.
[2] Liang Y,Xue L H,Li J R,et al.Effect and mechanism of intermedin1-53 on two-kidney one-clip hypertensive rats[J].Chin Pharmacol Bull,2011,27(1):46 -9.
[3] Yang J H,Jia Y X,Pan C S,et al.Effects of intermedin(1-53)on cardiac function and ischemia/reperfusion injury in isolated rat hearts[J].Biochem Biophys Res Commun,2005,327(3):713 - 9.
[4] Bell D,Zhao Y,McCoy F P,et al.Expression of the counter-regulatory peptide intermedin is augmented in the presence of oxidative stress in hypertrophied cardiomyocytes[J].Cell Physiol Biochem,2008,21(5 -6):409 -20.
[5] Bell D,Zhao Y Y,Devine A B,et al.Influence of atenolol and nifedipine on nitric-oxide deficient cardiomyocyte hypertrophy and expression of the cardio-endocrine peptide intermedin and its receptor components[J].Cell Physiol Biochem,2008,21(1 - 3):203-14.
[6] Hao G H,Niu X L,Gao D F,et al.Agonists at PPAR-g suppress angiotensinⅡ-induced production of plasminogen activator inhibitor-1 and extracellular matrix in rat cardiac fibroblasts[J].Br J Pharmacol,2008,153(7):1409 -19.
[7] Gupta S,Das B,Sen S.Cardiac hypertrophy:mechanisms and therapeutic opportunities[J].Antioxid Redox Signal,2007,9(6):623-52.
[8] Takei Y,Inoue K,Ogoshi M,et al.Identification of novel adrenomedullin in mammals:a potent cardiovascular and renal regulator[J].FEBS Lett,2004,556(1 -3):53 - 8.
[9] Bell D,McDermott B J.Intermedin(adrenomedullin-2):a novel counter-regulatory peptide in the cardiovascular and renal systems[J].Br J Pharmacol,2008,153(Suppl):S247 -62.
[10] Frank D,Kuhn C,Van Eickels M,et al.Calsarcin-1 protects againstangiotensin-Ⅱ induced cardiac hypertrophy[J].Circulation,2007,116(22):2587 -96.
[11] Roh J,Chang C L,Bhalla A,et al.Intermedin is a calcitonin/calcitonin gene-related peptide family peptide acting through the calcitonin receptor-like receptor/receptor activity-modifying protein receptor complexes[J].J Biol Chem,2004,279(8):7264 -74.
