同型半胱氨酸引起平滑肌细胞LDLR启动子区DNA甲基化改变的位点分析
2012-07-28杨安宁杨晓玲马长剑孙炜炜马胜超姜怡邓
杨安宁,王 菊,杨晓玲,马长剑,孙炜炜,马胜超,王 磊,徐 华,姜怡邓
(宁夏医科大学1.基础医学院2.检验学院,宁夏银川 750004)
同型半胱氨酸(homocysteine,Hcy)是动脉粥样硬化(atherosclerosis,AS)的独立危险因素[1]。前期研究发现:Hcy可引起低密度脂蛋白受体(low density lipoprotein receptor,LDLR)等AS相关基因发生甲基化改变[2],但Hcy引起DNA甲基化的效应偏重于CpG二核苷酸序列还是CpG岛,即其甲基化作用位点尚不清楚。因此,本文以LDLR为研究对象,探讨Hcy引起平滑肌细胞LDLR发生甲基化改变的具体特点及机制,为进一步研究Hcy引起AS提供理论依据。
1 材料与方法
1.1 主要实验仪器和试剂 SZ-97自动三重纯水蒸馏器(上海亚荣生化仪器厂);全自动立式压力蒸汽灭菌器(上海申安YXQ-LS50A);高速低温离心机(Beckmancomlter AvantiJ-301,德国);相差显微镜(日本Nikon公司);凝胶成像系统和酶标仪(Biorad公司,美国);超净工作台(苏州安泰空气技术有限公司);CO2培养箱(Heraeus,德国);DNA甲基化修饰试剂盒(Epigentek,美国);DNA提取试剂盒(promega);胰蛋白酶和同型半胱氨酸(Sigma);限制性内切酶HpaII和BssHII(Fermentas);引物由上海生工公司合成。
1.2 人脐静脉VSMCs培养、鉴定及分组 按照Hua等[3]报道的方法,用组织块贴壁培养原代血管平滑肌细胞(vascular smooth musclecells,VMSCs)。选用第3代细胞用不同浓度 Hcy(50、100、200、500 μmol·L-1)刺激72 h,并以不加Hcy组为空白对照组(control),进行后续实验。
1.3 巢式降落式甲基化特异性PCR(nMS-PCR)法检测LDLR甲基化改变 按DNA提取试剂盒说明书操作提取基因组DNA。用亚硫酸盐修饰法对其进行修饰。采用在线软件http://www.urogene.org/methprimer/设计引物,LDLR外引物:上游:5'-TTTGGGTAATTAGATGTGGATTTATG-3',下 游:5'-ACAAAAAAACACTCCCTCTAAAAAA-3',产 物 长 度412 bp。甲基化引物:上游:5'-TTTAGTAGTTGGA ATTGTAGGTATGC-3',下游:5'-ACTTTAAAAAATA AACGAA-3',产物长度151 bp;非甲基化引物:上游:5'-AGTAGTGGAATTGTAGGTATGTGT-3',下 游:5'-CACTTTAAAAAACAAAAATAAACAAA-3',产物长度149 bp。程序:94℃预变性5 min,然后进行降落式PCR,每循环降低 0.5℃,30 个循环(94℃,30 s;62℃,30 s;72℃,1 min),72℃延伸7 min。琼脂糖凝胶电泳并分析光密度。按如下公式计算:甲基化%=甲基化OD值/(甲基化OD值+非甲基化OD值)×100%。
1.4 甲基敏感性限制性内切酶法分析LDLR启动子区DNA甲基接受能力 甲基敏感性限制性内切酶HpaII(识别序列 CCGG)和 BssHII(识别序列CGCGCG)只酶切非甲基化序列,不酶切甲基化的CmCGG和CmGCGCG序列,经HpaII和BssHII消化后,破坏了未甲基化CG位点的结构,LDLR的DNA甲基接受能力下降,随后进行放射性分析DNA甲基接受能力。酶切反应体系:HpaII(2×104U·L-1)0.25 μl;BssHII(1 × 104U·L-1)0.5 μl;纯化的DNA 5 μg,混匀,4℃放置 24 h,然后用 E.Z.N.A 纯化试剂盒纯化。利用细菌SssI甲基转移酶催化DNA的CpG位点发生甲基化,以3H标记的S-腺苷甲硫氨酸(3H-SAM)为甲基供体,测到的放射性强度即为DNA甲基接受能力。
2 结果
2.1 VSMCs培养、鉴定 细胞培养5 d时,用相差显微镜观察见少量细胞从组织块周围爬出,呈梭形排列,放射状生长,培养2周后局部细胞平行排列,部分细胞多层重叠,高低起伏呈“峰、谷”状。α-肌动蛋白免疫细胞化学染色显示98%的细胞染色呈阳性,胞质呈棕黄色,胞核不着色,证实细胞为VSMCs,见 Fig 1,2。

Fig 1 VSMCs pictures under the Phase contrast microscope
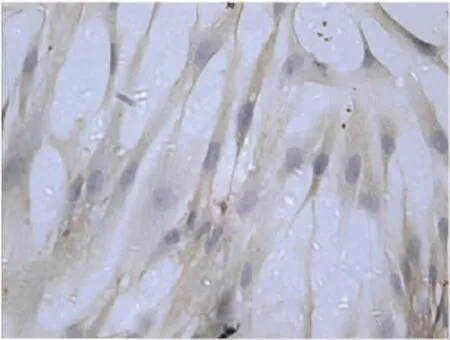
Fig 2 VSMCs α-actin staining of immune cells(× 200)
2.2 Hcy对VSMCs中LDLR启动子区DNA甲基化修饰状态的影响 VSMCs经 50,100,200,500 μmol·L-1Hcy刺激后,LDLR启动子区DNA甲基化程度与对照组比较分别降低了9.82%、27.39%、22.18%和9.89%,以100 μmol·L-1组低甲基化程度最明显(P<0.01),见Fig 3。
2.3 Hcy对VSMCs内LDLR启动子区DNA甲基接受能力的影响 不同浓度Hcy刺激VSMCs 72 h后,增加了LDLR启动子区DNA甲基接受能力,经限制性内切酶HpaII消化后,LDLR启动子区C↓CGG序列被酶切,经限制性内切酶BssHII消化后,LDLR启动子区GC↓GCGC序列被酶切,与对照组比较,甲基接受能力下降,其中HpaII引起的效果更明显,见Fig 4。

Fig 3Hcy affected LDLR promoter DNA methylation of VMSCs(72 h)
3 讨论
近年来,Hcy对基因表达的影响受到广泛关注,而DNA甲基化是基因表达的重要调控方式之一[4]。LDLR作为与AS发生发展紧密相关的受体,其在Hcy诱导的平滑肌细胞增殖过程中的具体机制缺乏深入研究。
正常细胞基因组中70%的CpG二核苷酸序列是甲基化的,主要见于内含子、重复序列、潜在的活性转移成份等,甲基化状态使这些序列保持静默;而某些基因启动子区的CpG岛,特别是管家基因启动子区的CpG岛通常并不发生甲基化,才导致出现去甲基化的位点偏向于一般的CpG二核苷酸序列,而CpG岛所受影响较小[5-6]。本文通过甲基敏感性限制性内切酶法分析DNA甲基接受能力,观察到Hcy对平滑肌细胞LDLR启动子区DNA甲基化改变和位点的影响,Hcy引起LDLR去甲基化时,去甲基化位点可能偏向于原本已发生甲基化的CpG二核苷酸序列。DNA甲基敏感性限制性内切酶可以识别非甲基化的胞嘧啶序列(CG),并有特异性的酶切作用,但对甲基化的CG没有作用。HpaII和BssHII对C↓CGG序列和CpG岛(GC↓GCGC)有特异性作用,经HpalI和BssHII消化后,未甲基化的CG位点结构被破坏,LDLR DNA甲基接受能力下降。同时,本实验结果还显示,VSMCs经不同浓度Hcy刺激后,使LDLR DNA甲基接受能力增加,推测主要是由于Hcy引起了其低甲基化,暴露出了更多的DNA甲基接受位点。Hcy处理后,经限制性内切酶HpalI和BssHII消化,LDLR DNA甲基接受能力下降,且以BssHII酶切引起的下降更明显,提示CpG岛原有的甲基化程度低于一般CG序列,导致更多的GC↓GCGC被酶切,表明Hcy引起LDLR DNA低甲基化更倾向于HpaII切点,即Hcy引起基因组去甲基化主要在C↓CGG序列而不是GC↓GCGC。因此,Hcy可使平滑肌细胞LDLR启动子区DNA发生去甲基化的效应偏重发生于一般的CpG二核苷酸序列,CpG岛所受影响相对较小。
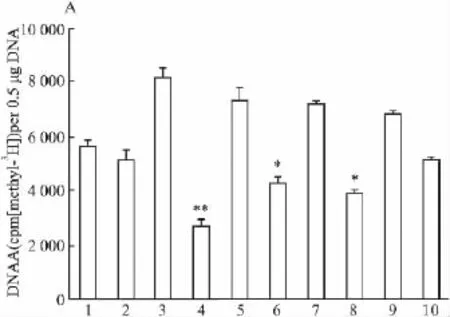
1:Control;2:Control+H;3:Hcy(50);4:Hcy(50)+H;5:Hcy(100);6:Hcy(100)+H;7:Hcy(200);8:Hcy(200)+H;9:Hcy(500);10:Hcy(500)+H*P<0.05,**P<0.01 vs control
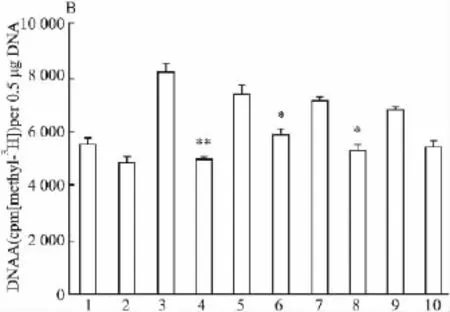
Fig 4 Changes of LDLR DNA methylation capacity by Hpall(A)and BssHII(B)processed
本研究结果同时显示,Hcy引起LDLR去甲基化并不呈剂量依赖关系,引起DNA甲基化程度变化最明显的是100 μmol·L-1Hcy组。这一结果在我们前期研究的Hcy引起VSMCs增殖的实验中,皆显示出100 μmol·L-1Hcy对甲基化的影响最明显;Li等[7]在研究 Hcy引起平滑肌细胞 IGF2和 CTCF DNA甲基化时,其引起DNA甲基化的Hcy最佳浓度为100 μmol·L-1;Jamaluddin 等[8]在研究 Hcy 引起内皮细胞损伤中也观察到cylinA DNA甲基化改变的最佳浓度为100 μmol·L-1,提示这一效应并非实验偶然因素所致,但为何无量-效关系,我们尚无确切的解释,一个推测是高Hcy可通过多种机制致病,Hcy 浓度在 100 μmol·L-1左右时,显示出较明显的对DNA甲基化修饰的干扰,浓度进一步升高后,其促进氧化应激、细胞凋亡、炎症反应等机制可能对细胞造成更严重的伤害,从而掩盖其对DNA甲基化修饰的影响。
本实验通过检测Hcy引起的平滑肌细胞LDLR甲基化及甲基接受能力的变化,分析了LDLR发生甲基化改变的可能机制及特点,为进一步阐明DNA甲基化在AS疾病中的调控机制提供理论依据。
[1] Jiang C,Zhang H,Zhang W,et al.Homocysteine promotes vascular smooth muscle cell migration by induction of the adipokine resistin[J].Am J Physiol Cell Physiol,2009,297(6):C1466-76.
[2] Guay S P,Brisson D,Munger J,et al.ABCA1 gene promoter DNA methylation is associated with HDL particle profile and coronary artery disease in familial hypercholesterolemia[J].Epigenetics,2012,7(5):464-72.
[3] Fu Hua,Luo F M,Li Y,et al.Hypoxia stimulates the expression of macrophage migration inhibitory factor in human vascular smooth muscle cells via HIF-1α dependent pathway[J].BMC Cell Biol,2010,11:66.
[4] 范 岚,王 果,涂江华,周宏灏.表观遗传药理学与药物反应个体差异[J].中国药理学通报,2009,25(8):981-4.
[4] Fan L,Wang G,Tu J H,Zhou H H.Pharmacoepigenetics and interindividual variations in drug response[J].Chin Phamacol Bull,2009,25(8):981-4.
[5] Schmelzer C,Kitano M,Hosoe K,Döring F.Ubiquinol affects the expression of genes involved in PPARα signalling and lipid metabolism without changes in methylation of CpG promoter islands in the liver of mice[J].J Clin Biochem Nutr,2012,50(2):119-26.
[6] Antequera F.Structure,function and evolution of CpG island promoters[J].Cell Mol Life Sci,2003,60(8):1647-58.
[7] Li L,Xie J,Zhang M,Wang S.Homocysteine harasses the imprinting expression of IGF2 and H19 by demethylation of differentially methylated region between IGF2/H19 genes[J].Acta Biochim Biophys Sin,2009,41(6):464-71.
[8] Jamaluddin M D,Chen I,Yang F,et al.Homocysteine inhibits endothelial cell growth via DNA hypomethylation of the cyclin A gene[J].Blood,2007,110(10):3648-55.