双甘膦修饰磁性四氧化三铁纳米微球吸附DNA的研究
2012-07-27李步海
孙 群,李步海
(中南民族大学化学与材料科学学院 国家民委分析化学重点实验室,湖北 武汉430074)
从生物样品中提取核酸是分子生物学和临床医学等生命科学研究领域中的一项基本技术。核酸提取的传统方法有PEG沉淀法、CsCl超速离心法、离子交换树脂法、煮沸裂解法和碱裂解法等[1]。这些方法往往耗时长、使用有毒的试剂且提取的DNA纯度不高。人们期望研发一种简易高效的质粒DNA提取方法。其中,用表面修饰的磁性粒子作为载体,利用磁性材料在外磁场下易于相分离的特点,可望成为一种有潜力的方法。磁性微粒作为一种新型的基质,可以进一步简化和加速核酸的分离与纯化过程,实现核酸纯化处理的微型化、自动化和平行化[2,3]。
各种修饰磁性微粒的应用发展迅速,比如在磁性微粒表面连接NTA-Ni2+分离蛋白质、核酸等,或者在表面连接膦酸[4,5],利用其易修饰性、特殊化学特点和物理惰性,保护内部结构并避免外部环境的干扰[6],而在磁性微球表面连接双甘膦(PMIDA)可以有效减少磁场条件下的结块,从而增加羧基的数量[7],更有利于连接金属离子,达到吸附核酸的目的。该方法简便快速,吸附分离效果好,有实际应用价值。作者在此用双甘膦修饰磁性四氧化三铁纳米微球(MNP)并负载Zn2+后用于提取DNA,并考察了相关因素的影响。
1 实验
1.1 试剂与仪器
小牛胸腺DNA,Sigma-Aldrich试剂公司;双甘膦(PMIDA),阿拉丁试剂公司;FeCl2·4 H2O,广东台山众城化工有限公司;浓氨水;FeCl3·6H2O,国药集团化学试剂有限公司;ZnSO4·7H2O,杭州萧山化学试剂厂。所用试剂均为分析纯。实验用水为去离子水。
UV2300Ⅱ型紫外可见分光光度计,上海天美科学仪器有限公司;SHZ-03型恒温水浴摇床,上海堪鑫仪器设备有限公司;TGL-16G型台式离心机,上海安亭科学仪器厂;Gene Genius & Gene Gnome型Gene Genius成像系统,Synoptics Ltd.;PAC3000型超声仪。
1.2 方法
1.2.1 DNA标准溶液的配制
将小牛胸腺 DNA溶于 10 mL 10% NaCl溶液中得到浓度为 1.461 g·L-1的DNA标准溶液(经紫外光谱测定260 nm处吸收值后,通过经验公式cDNA=50A260计算溶液DNA浓度)。
1.2.2 磁性四氧化三铁纳米微球的制备
称取FeCl2·4 H2O 2.17 g、 FeCl3·6H2O 5.26 g,溶于100 mL去离子水中,在N2氛围下加热至60 ℃,搅拌下缓慢滴加12 mL浓氨水,持续反应1 h,冷却至室温,磁场分离。用去离子水洗3~4次,60 ℃真空干燥4 h,得到磁性四氧化三铁纳米微球(MNP)。
1.2.3 PMIDA-Zn2+修饰磁性微球的制备
(1)PMIDA修饰磁性微球:称取0.232 g(1 mmol)MNP于去离子水中超声分散20 min,再加入3.5 mmol的PMIDA,在室温下反应12 h,并用1.25 mol·L-1的NaOH溶液调节pH值为10。反应结束后磁场分离,用去离子水洗3~4次,洗涤液与上清液合并,用于测定磁性微球已修饰PMIDA的量;固体在60 ℃下真空干燥4 h,即得PMIDA修饰磁性微球。
(2) PMIDA-Zn2+修饰磁性微球:向0.1 g PMIDA修饰磁性微球中加入0.1 mol·L-1的ZnSO4·7H2O 溶液15 mL,常温下振荡。反应结束后磁场分离,用去离子水洗至上清液无Zn2+,60 ℃真空干燥4 h,即得PMIDA-Zn2+修饰磁性微球。
1.2.4 磁性微球已修饰PMIDA的量的测定
参考文献[8],用浓硫酸消解法测定反应后上清液及洗涤液中剩余PMIDA的量。磁性微球已修饰PMIDA的量=修饰前加入PMIDA的量-修饰后上清液及洗涤液中剩余PMIDA的量。
1.2.5 吸附与洗脱实验
1.2.5.1 吸附
分别称取10 mg吸附剂(PMIDA-Zn2+修饰磁性微球)于离心管中,各加入浓度为1.461 g·L-1的DNA标准溶液50 μL和不同pH值的缓冲溶液 1.0 mL,涡旋混匀,室温下温和振摇20 min,磁场分离,吸出上层清液0.85 mL并用去离子水稀释4倍 ,用紫外可见分光光度计测定260 nm处的吸光度。
1.2.5.2 洗脱
取10 mg已吸附DNA的吸附剂,加入不同浓度的氨水,涡旋混匀后静置10 min,磁场分离磁性微球,吸取洗脱液用于核酸的紫外测定。
1.2.6 玉米DNA的提取
玉米基因组的提取方法参考文献[9] 。具体步骤为:取液氮下研磨过的玉米1.5 g,加入到含3.0 mL细胞裂解液( 0.1 mol·L-1Tris-HCl , 0.05 mol·L-1EDTA, 0.5 mol·L-1NaCl,pH值8.0)的10 mL离心管中,再加入10%十二烷基硫酸钠(SDS)500 μL。65 ℃水浴处理30 min,5000 r·min-1离心,得到1.5 mL细胞裂解清液。移取0.4 mL裂解清液于10 mg磁性微球中,涡旋5 s。再加入核酸吸附液( 20% PEG-8000,2 mol·L-1NaCl,pH值5.0) 1.0 mL,涡旋混匀,35 ℃振荡20 min。磁场下分离并弃去上层清液。用80%异丙醇和70%乙醇1.0 mL洗涤磁性微球各2次。吹干乙醇后,加入TE缓冲溶液 (10 mmol·L-1Tris-HCl,1 mmol·L-1EDTA , pH值7.8)200 μL,涡旋混匀,静置10 min,磁场下分离磁性微球,吸取洗脱液150 μL,向吸附剂中加入TE缓冲溶液200 μL重复解吸1次,合并洗脱液,稀释至1 mL,紫外检测提取的DNA。吸附剂中剩余的洗脱液进行凝胶电泳分离实验。
电泳条件:取样品溶液10 μL与1 μL溴酚蓝溶液于TAE缓冲溶液(0.04 mol·L-1Tris-CH3COOH , 0.001 mol·L-1EDTA,pH值8.0)中上样,10%琼脂糖凝胶电泳(150 V,30 min)。
2 结果与讨论
2.1 磁性微球已修饰PMIDA的量
测定结果表明,磁性微球表面PMIDA的结合量为546.5 mg·g-1,证明PMIDA已修饰到磁性纳米微球上。
2.2 DNA吸附的影响因素
2.2.1 pH值

图1 pH值对DNA吸附率的影响

2.2.2 离子强度

图2 离子强度对DNA吸附率的影响
固定吸附时间为20 min、pH值为5.0,其它条件同2.2.1,考察离子强度(NaCl浓度)对DNA吸附的影响,结果如图2所示。 由图2可知,随着离子强度的增大,吸附率逐渐升高;但离子强度超过2.0 mol·L-1后,吸附率基本不变。因此,确定适宜的离子强度为2.0 mol·L-1。
2.2.3 吸附时间
固定NaCl浓度为2.0 mol·L-1,其它条件同2.2.2,考察吸附时间对DNA吸附的影响,结果如图3所示。

图3 吸附时间对DNA吸附率的影响
由图3可知,在吸附初期,由于修饰磁性微球上的吸附位点较多,吸附率上升较快;随着吸附的进行,吸附位点变少至达到平衡;吸附20 min后,吸附率几乎不变。因此,确定适宜的吸附时间为20 min。
2.2.4 吸附温度
固定NaCl浓度为2.0 mol·L-1,其它条件同2.2.2,考察吸附温度对DNA吸附的影响,结果如图4所示。

图4 吸附温度对DNA吸附率的影响
由图4可知,在0~40 ℃范围内,吸附率随着吸附温度的升高而上升。这是因为,吸附温度升高,溶液中分子热运动加剧,吸附率上升。考虑到动物体内DNA存在的环境,确定适宜的吸附温度为35 ℃。
2.2.5 吸附剂用量
在吸附剂用量为10 mg、pH值为5.0、NaCl浓度为2.0 mol·L-1、吸附温度为35 ℃、吸附时间为20 min的条件下,DNA吸附率可达80%,且随着吸附剂用量的增加而上升,当吸附剂用量为30 mg时,吸附率达到100%。这是因为,所用吸附剂越多,对一定浓度DNA的吸附越完全,因此,在实际使用时,应根据溶液中DNA浓度选择适当的吸附剂用量,以保证吸附完全。
2.2.6 DNA浓度
确定吸附剂用量为10 mg、pH值为5.0、NaCl浓度为2.0 mol·L-1、吸附温度为35 ℃、吸附时间为20 min,测定吸附剂对不同初始浓度DNA的吸附容量,绘制DNA的吸附等温线,见图5。

图5 DNA的吸附等温线
由图5可知,吸附剂对DNA的吸附容量随着DNA初始浓度的增大而增大;当DNA初始浓度超过一定值后,DNA吸附容量变化不大。
吸附容量是判断吸附性能的一个重要指标。分别用Langmuir和Freundlich吸附模型对吸附等温线进行拟合,Langmuir和Freundlich吸附等温线模拟图和模拟参数分别见图6、表1。

图6 DNA的Langmuir吸附等温线模拟图(a)和Freundlich吸附等温线模拟图(b)

表1 DNA的Langmuir和Freundlich吸附等温线模拟参数
由图6和表1可知,Langmuir模型和Freundlich模型的相关系数分别为0.9755和0.9212,表明PMIDA-Zn2+修饰磁性微球对DNA的吸附更符合Langmuir吸附模型,其理论最大吸附容量为26.27 mg·g-1,与实验值21 mg·g-1基本吻合。
2.3 DNA的洗脱
以氨水洗脱被吸附的DNA,氨水浓度对DNA洗脱的影响见图7。

图7 氨水浓度对DNA洗脱的影响

2.4 吸附剂提取玉米中DNA
以洗脱液A260/A280的比值表示提取后DNA的纯度,紫外测定该比值为1.6382,说明提取的DNA纯度较高,进一步计算其浓度为333.800 μg·mL-1。
洗脱液对应的10%琼脂糖凝胶电泳图谱如图8所示。图8中出现较明显的DNA谱带,证明DNA已提取并洗脱下来,且纯度较高。
2.5 讨论
实验采用固相吸附的方法,以直接研磨玉米面的方法将玉米细胞壁打破,之后加入一定量的细胞提取液,参考文献[9],向吸附液中加入20%PEG后,在PEG与 NaCl共同作用下将 DNA吸附到磁性微球表面 ,选择性迅速提高,因为DNA的脱水作用是 DNA析出的主要动力[10,11],用 TE缓冲溶液将 DNA洗脱下来结果较理想。
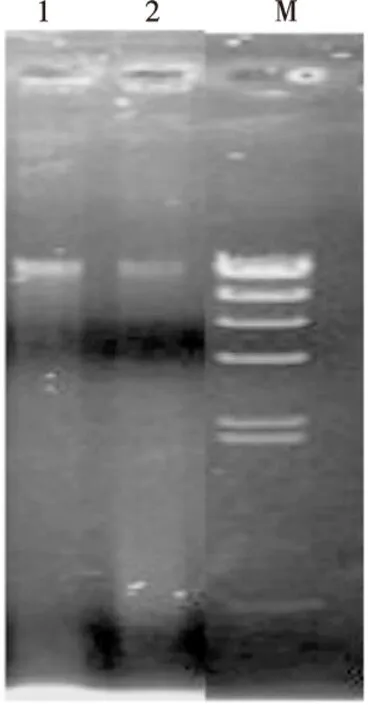
1,2.洗脱液平行2次进样 M.DNA Mark
3 结论
用双甘膦(PMIDA)修饰磁性四氧化三铁纳米微球(MNP)并负载Zn2+后用于提取DNA。当吸附剂用量为10 mg、pH值为5.0、离子强度(NaCl浓度)为2.0 mol·L-1、吸附时间为20 min、吸附温度为35 ℃时,DNA吸附率达80%、吸附容量为21 mg·g-1。在低pH值、高浓度的盐存在下,DNA的磷酸基团与基质螯合的Zn2+静电结合,能大大提高PMIDA-Zn2+修饰磁性微球对DNA的吸附率。在氨水浓度为3.5%时,DNA能从吸附剂表面完全洗脱下来, 从而达到分离纯化的目的。用制备的吸附剂从玉米中提取DNA,提取纯度较高(A260/A280=1.6382)。此方法简便快速,所得DNA纯度较高,效果令人满意。
[1] Sambrook J, Russel D W. Molecular Cloning(3rd edition)[M].Beijing:Science Press, 2002:26-61.
[2] Xie X, Zhang X. Preparation and application of surface-coated superparamagnetic nanobeads in the isolation of DNA[J].J Magn Magn Mater, 2004, 277(1-2):16-23.

[4] Mophpatra S,Pramanik N,Ghosh S K,et al.Synthesis and characterization of ultrafine poly(vinylalcohol phosphate)coated magnetite nanoparticles[J].Nanosci Nanotechnol,2006,6(3):823-828.
[5] Mophpatra S,Pramanik P. Synthesis and stability of functionalized iron oxide nanoparticles using organophosphorus coupling agent[J].Colloids Surf A,2009,339(1-3):35-42.
[6] Roberts D,Zhu W L,FromMen C M.et al.Synthesis of gadolinium oxide magnetoliposomes for magnetic resonance imagine[J].J Appl Phys,2000,87(9):6208-6210.
[7] Sahu Sumanta Kumar,Chakrabarty Arindam,Bhattacharya D-psikha,et al.Single step surface modification of highly stable magnetic nanoparticles for purification of His-tag proteins[J].J Nanopart Res,2011,13(6):2475-2484.
[8] 苗兰冬.双甘膦中总磷测定的消解方法探讨[J].分析与测试,2010,13(5):37-39.
[9] Werner Stober,Arthur Fink,Bohn E.Controlled growth of monodisperse silica spheres in the micron size range[J].J Coll Interf Sci,1968,26(1):62-69.
[10] Harvey S C. DNA structural dynamics:Longitudinal breathing as a possible mechanism for B-Z transition[J].Nucleic Acids Res,1983,11(14):4867-4877.
[11] Melzak K A,Sherwood C S,Turner R F B. Driving forces for DNA adsorption to silica in perchlorate solutions[J].J Coll Interf Sci,1996,181(2):635-644.
