多药耐药基因作用的新发现
2012-07-27段蕴铀黄友章吴海波
宋 鹏,段蕴铀,黄友章,吴海波
海军总医院质量管理科,北京 100048
在临床上使用一种化疗药对肿瘤患者实施化疗后,治疗后的肿瘤细胞可同时对多种不同结构的其他抗癌药也产生耐药性,这种现象称为多药耐药(multi-drug resistance,MDR)。人类肿瘤细胞多药耐药的经典途径是由多药耐药基因(MDR1 Gene)转录出 MDR1 mRNA,再由 MDR1 mRNA 翻译的糖蛋白(P-gp)介导的[1]。这种ATP酶依赖的跨膜蛋白P-gp,有将天然来源的药物泵出细胞的功能,这可使细胞内的药物浓度降低而导致MDR[2]。临床上有时患者在外照射后对其后的化疗不再敏感,即外照射也表现出了MDR表型。本文主要是观察被照射的小细胞肺癌细胞系在外照射前后其总RNA、MDR1 mRNA、药物敏感性以及放射敏感性的变化,从而探讨多药耐药基因是否还有其他未被揭示的新作用。
1 材料与方法
1.1 材料
上海科学院细胞库购得NCI-H446小细胞肺癌细胞系。该细胞系的生物学性状参见文献[3],其培养条件参见文献[4]。细胞生长进入指数期后进行实验。
1.2 方法
1.2.1 照射条件 采用中国核动力研究设计院实验工厂生产的GWGP80型远距离60Co治疗机,照射条件参见文献[4]。
1.2.2 细胞的外照射 当NCI-H446细胞进入指数生长期后,用0.25%胰酶消化,并将吹匀的细胞悬液移入75 ml的细胞培养瓶中进行培养,等细胞贴壁并汇合后进行外照射,照射剂量为2 Gy/次(戈瑞,辐射吸收剂量单位),中间恢复3 d,总的外照射剂量为50 Gy[5]。
1.2.3 外照射前后NCI-H446细胞总RNA的提取 分别取照射前后的NCI-H446细胞约1×107个,用PBS将NCI-H446细胞冲洗2遍,离心后弃上清液,各加1 ml Gibco公司生产的Trizol,吹打使NCI-H446细胞溶解,用氯仿液抽提后,加入异丙醇沉淀,用70%乙醇洗涤,然后凉干,最后加0.1%DEPC水溶解总RNA。提取后的总RNA经紫外分光光度计260 nm定量。
1.2.4 RT-PCR RT-PCR的详细过程参见参考文献[4]。
1.3 不同浓度的丝裂霉素(MMC)对外照射前后两组细胞存活率的影响
1.3.1 配制不同血浆峰浓度(PPC)的MMC 配制不同血浆峰浓度(PPC)的MMC的具体方法参见参考文献[6]。丝裂霉素的血浆峰浓度为 0.5 μg/ml[7]。
1.3.2 制备外照射前后两组细胞相同浓度的单细胞悬液 具体方法参见参考文献[6]。
1.3.3 细胞毒性试验 具体方法参见参考文献[6]。
1.3.4 不同浓度丝裂霉素作用下两组细胞的平均存活率 细胞存活率的计算公式[8]如下:

细胞的平均存活率是每组6个样本的细胞存活率的平均数,数据以均数±标准差()表示。在相同的条件下细胞的存活率高,提示相对耐药;反之,则相对敏感。
1.4 加逆转剂维拉帕米后不同浓度丝裂霉素(MMC)对外照射前后两组细胞存活率的影响
1.4.1 配制不同血浆峰浓度(PPC)的MMC 方法同本文的“1.3.1”,但不用生理盐水稀释,而用细胞培养液1640溶解。
1.4.2 逆转剂维拉帕米的配制 取12.45 ml的1640培养液加50 μl的5 mg/ml的维拉帕米即可制成浓度为20 μg/ml的维拉帕米溶液[9]。
1.4.3 制备外照射前后两组细胞的单细胞悬液 方法同本文的“1.3.2”。
1.4.4 细胞耐药性的逆转实验 具体方法参见参考文献[6]。
1.4.5 计算不同浓度丝裂霉素作用下和加入逆转剂维拉帕米后两组细胞的平均存活率 见“1.3.4”所述。
1.5 外照射前后NCI-H446细胞放射敏感性的变化
1.5.1 外照射前后NCI-H446细胞存活率(S)的变化 实验分Sc组和Rc组,每组各取3.5 cm的细胞培养皿18个。每个培养皿加入细胞300个,再加入1640应用液1.5~2.0 ml,每组细胞的18个培养皿再分成6小组,每组3个皿。分别给予0、2、4、6、8和10 Gy 6个不同剂量的外照射。1周后计算两组细胞的集落形成率(PE)和每小组细胞的存活率(S),并比较两组细胞的PE和在相同剂量外照射条件下的存活率。同时取原本细胞组的存活率最接近50%的外照射剂量作为下一步实验的外照射剂量。PE和S的计算公式如下:

1.5.2 两组细胞生长状况和细胞死亡率的差别[10-11]取Sc和Rc各5组,每组3个培养皿,每个皿中加入指数生长期细胞1×104个,培养2~3 d,使其贴壁并进入指数生长期,按步骤“1.5.1”确定的2 Gy放射剂量作为测试两组细胞放射敏感性的外照射剂量。使用这个外照射剂量同时一次性照射两组共30个培养皿的细胞。照射后分别于第2、4、6、8和10天各取1组共6个皿进行细胞计数,取每组3个皿细胞的平均数作为最后结果。每次将做完细胞计数的剩余单细胞悬液加入离心管,以1500 r/min的转速离心5 min,然后弃上清液,加入0.5%台酚蓝2~3滴将细胞染色,染色后的细胞点滴在血球计数板上,分别计数活细胞(白色)和死亡细胞(蓝色),算出细胞死亡率(P)。细胞死亡率的计算公式如下:

1.6 统计学方法
采用SPSS 17.0软件进行数据分析。计量资料数据以均数±标准差()表示,两样本间均数比较采用独立样本的t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 外照射前后NCI-H446细胞的总RNA浓度
在相同细胞数和相同体积的前提下,照射前后NCIH446细胞总RNA的浓度分别为25.9 mg/L和16.6 mg/L。
2.2 外照射前后NCI-H446细胞MDR1 mRNA的RT-PCR结果
外照射前后NCI-H446细胞MDR1 mRNA的RT-PCR的结果见图1。除最上面的条带Mr(DL2000)外,从上至下可见四条带,它们依次为未照射细胞的β-actin cDNA(简写为β-actin cDNA)、照射细胞的β-actin cDNA (简写为P-βactin cDNA)、未照射细胞的MDR1 cDNA(简写为MDR1 cDNA)和照射细胞的MDR1 cDNA(简写为P-MDR1 cDNA)。这四条带经Gelbase电脑软件进行光密度扫描所得的平均光密度(OD)值分别为 59.49、49.76、64.14 和 66.60。 这样 P-MDR1 cDNA/P-β-actin cDNA 为 1.388, 而 MDR1 cDNA/β-actin cDNA为1.078。
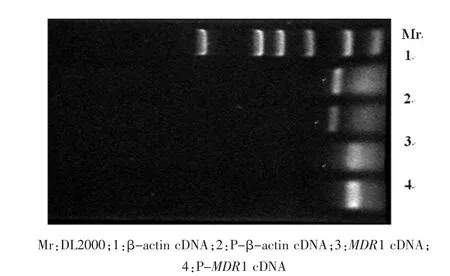
图1 小细胞肺癌细胞系外照射前后其多药耐药基因表达的变化
2.3 外照射前后两组细胞在不同浓度丝裂霉素作用下其存活率的变化
结果见表1和图2。
表1 两组细胞在不同浓度丝裂霉素作用下其平均存活率的变化()
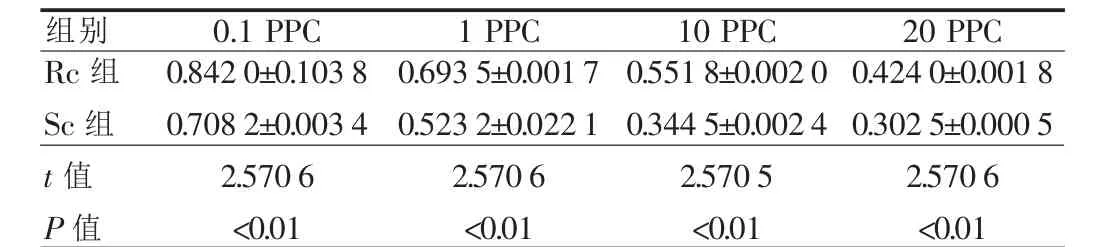
表1 两组细胞在不同浓度丝裂霉素作用下其平均存活率的变化()
R c组S c组t值 P值组别 0.1 P P C 0.8420±0.10380.7082±0.00342.5706<0.011 P P C 0.6935±0.00170.5232±0.02212.5706<0.0110 P P C 0.5518±0.00200.3445±0.00242.5705<0.0120 P P C 0.4240±0.00180.3025±0.00052.5706<0.01
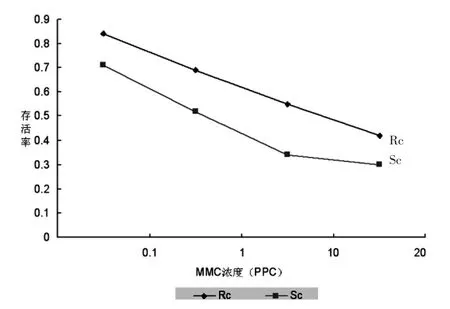
图2 两组细胞在不同浓度丝裂霉素的干扰下其平均存活率的变化
2.4 外照射前后两组细胞在加入逆转剂维拉帕米后,其不同浓度丝裂霉素作用下存活率的变化
结果见表2。
表2 细胞在加入逆转剂后,其不同浓度丝裂霉素作用下平均存活率的变化(,%)

表2 细胞在加入逆转剂后,其不同浓度丝裂霉素作用下平均存活率的变化(,%)
注:与 Rc 组比较,aP>0.05,bP<0.01
R c组S c组组别 0.1 P P C 0.9340±0.08950.9730±0.0380 a 1 P P C 0.8090±0.03580.9430±0.0420 b 10 P P C 0.1100±0.05390.1250±0.0230 a 20 P P C 0.0640±0.00690.0550±0.0120 b
2.5 两组细胞在不同剂量外照射下的集落形成数、集落形成率和存活率的结果
结果见表3。
表3 两组细胞在不同剂量外照射条件下平均集落形成数(XS、XR)(300 个细胞/皿)和平均存活率(SS、SR)()
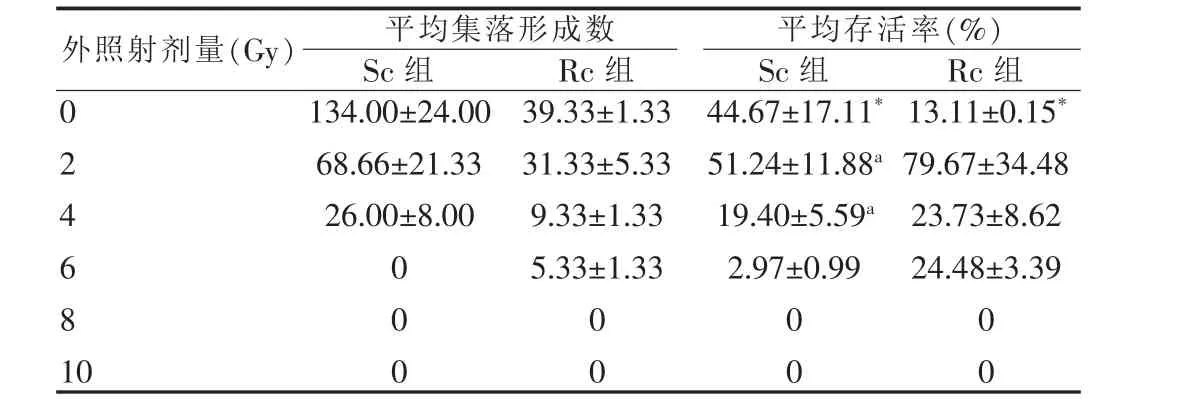
表3 两组细胞在不同剂量外照射条件下平均集落形成数(XS、XR)(300 个细胞/皿)和平均存活率(SS、SR)()
注:*因无干扰因素,实际上是两组细胞未照射前的集落形成率(PES、PER);与 Rc组比较,aP<0.05
外照射剂量(G y)平均集落形成数S c组 R c组平均存活率(%)S c组 R c组0246810134.00±24.0068.66±21.3326.00±8.0000039.33±1.3331.33±5.339.33±1.335.33±1.3344.67±17.11*51.24±11.88 a 19.40±5.59 a 2.97±0.9913.11±0.15*79.67±34.4823.73±8.6224.48±3.39000000
3 讨论
在临床上,化疗和放疗是治疗肿瘤患者常用的两种方法,但存在的主要问题是化疗后耐药。在临床工作中笔者也发现了另一个现象,即放疗后患者有时也会对其后的化疗和再放疗产生耐受,这个现象引起了笔者的关注,继而探讨放疗是否也会对被照射细胞的MDR1 gene有影响,并进而影响其后的药物敏感性和放射敏感性。基于上述原因,笔者设计了本课题,希望通过对体外培养的小细胞肺癌细胞系实施分次外照射,来观察其对被照射细胞的总RNA和MDR1 mRNA的表达变化以及其对被照射细胞的药物敏感性和放射敏感性所产生的影响,为今后的临床工作提供基础医学的根据。
MDR1 mRNA是细胞总RNA的组成部分,笔者很关注对体外培养的细胞在外照射后其总RNA的变化。外照射后对细胞总RNA的生物合成是有影响的,多数学者认为外照射后细胞总RNA的生物合成下降;相反的意见也同样存在。研究者考虑这可能是由于细胞的代谢状况、生长周期和取样时间不同所造成的[12]。本实验表明,细胞受50 Gy的外照射后,其总RNA的浓度由25.9 mg/L下降到了16.6 mg/L,生物合成受到明显抑制。
MDR1 mRNA的表达增强是导致MDR的主要原因,因此,探讨细胞受外照射后是否导致其后的化疗呈MDR表型也应该首先观察外照射后其MDR1 mRNA的表达变化。本研究通过对小细胞肺癌NCI-H466细胞系实施分次外照射建立了完成根治性外照射剂量的小细胞肺癌细胞系模型。从结果中图1可见,除最上面的条带Mr(DL2000)外,从上至下可见四条带,它们依次为未照射细胞的β-actin cDNA(简写为β-actin cDNA)、照射细胞的 β-actin cDNA(简写为 P-β-actin cDNA)、未照射细胞的MDR1 cDNA(简写为 MDR1cDNA)和照射细胞的MDR1 cDNA(简写为P-MDR1cDNA)。这四条带经Gelbase电脑软件进行光密度扫描所得的平均OD值分别为:59.49、49.76、64.14 和 66.60。 这样 P-MDR1 cDNA/P-βactin cDNA 为 1.388,而 MDR1 cDNA/β-actin cDNA 为1.078。这两个比值反映了细胞照射以后和未照射前其MDR1 mRNA的相对含量。比值大则反映其MDR1 mRNA的表达强。这样,从结果中可以看出照射后的比值1.388比照射前的比值1.078明显增大,表明NCI-H446小细胞肺癌细胞经体外总剂量为50 Gy的外照射后其MDR1 mRNA的表达增强。这意味着此种细胞很有可能对其后的化疗耐药。
上面探讨了外照射对NCI-H446小细胞肺癌细胞系MDR1 mRNA的影响,结果表明其表达增强,但该细胞是否对其后的化疗耐药尚需做药敏方面的实验来证实。本文采用了噻唑蓝(MTT)法[6],实测了两组细胞在不同浓度化疗药物的干扰下,其各自不同的存活率,从而判断其不同的药物敏感性。1983年Mosman[13]首先将MTT法用于细胞毒试验的检验,目前该法广泛用于体外抗癌药物敏感试验。活细胞(红细胞除外)中线粒体脱氢酶对可溶性MTT分解、转化,产生一种蓝紫色结晶物——甲臜。甲臜溶解于二甲基亚砜(DMSO)中变成紫红色溶液,在600 nm左右波长中测定其颜色的强度,它的颜色和活细胞成正比,因此根据其颜色的强弱可反映活细胞的多少,从而推算出肿瘤细胞在抗癌药物中的存活率。肿瘤细胞的存活率越低,说明此种化疗药物对肿瘤细胞杀伤力越强,即敏感性越高,反之则敏感性越低[14]。
从本结果中表1和图2可见,外照射后的体外细胞,在不同浓度的丝裂霉素作用下,照射后细胞的存活率均明显高于未照射细胞。此实验结果表明,外照射后NCI-H446细胞的体外化疗药物敏感性已经降低,换句话说即体外耐药性提高。日本富田腾朗和美国Salmon等均研究过体外药物试验和体内临床用药的关系。他们的研究结果是两者的相符合率为90%左右[8]。这个结论表明体外和体内细胞的耐药性关联性很高。从表1和图2的结果还可以看到,随着干扰药物浓度的提高,两组细胞的存活率平稳地下降,这说明本研究设计的干扰药物浓度较为合适。
上面的结果表明外照射后被照射细胞对其后的化疗产生了耐药性。那么这种耐药性是否也可以被增敏剂所逆转呢?为此,笔者做了如下的实验,即给已经产生了耐药的细胞加入了一种常用的化疗增敏剂维拉帕米,来观察其耐药性是否可以被逆转。从表2可以看到,两组细胞在加入逆转剂维拉帕米后,在化疗药丝裂霉素的浓度分别为0.1、10和20 PPC时,存活率比较差异无统计学意义(P>0.05),这表明Rc组细胞的耐药已被逆转;而在丝裂霉素的浓度为1 PPC时,Rc组细胞的存活率反而明显低于未照射的Sc组细胞(P<0.01),这表明Rc组细胞的耐药表现不仅被逆转,且在这种情况下比Sc组细胞更敏感。实验结果说明今后在肺癌化疗时可以考虑同时应用化疗逆转药物。但有的逆转药剂量小时不起太多的作用,而剂量大时其带来的副作用患者又难以忍受,因此,使用受到限制[15]。为了解决这个问题,临床上曾使用两种逆转药物联用的办法,取得了良好的逆转效果[9]。
本实验结果表明外照射不仅可以使被照射细胞的MDR1 mRNA表达增强,而且被照射细胞还对其后的化疗药产生了耐药性,并且这种耐药性可以被常规使用的化疗增敏剂所逆转。对外照射后被照射细胞对其后的放疗反应的问题,笔者对Sc和Rc再给予相同剂量的外照射,来观察这两种细胞对相同条件的外照射的反应。从表3结果可知,首先,Sc与 Rc的集落形成率 (PE)分别为 (44.67±17.11)%和(13.11±0.15)%,差异有高度统计学意义(P<0.01),表明 NCIH446细胞经50 Gy的外照射后,其集落形成能力下降明显;其次,在分别给予2 Gy和4 Gy的外照射后,Rc系的存活率(S)分别为(79.67±34.48)%和(23.73±8.62)%,而 Sc 系的存活率(S)分别为(51.24±11.88)%和(19.40±5.59)%,差异有统计学意义(P<0.05)。 说明在 2~4 Gy范围内,Rc系较 Sc系对外照射的抵御能力增强明显。提示经过外照射后,肿瘤细胞耐外照射的能力增强。临床上也有这个现象,即在放疗过的部位再放疗时,效果明显降低。Fertil等[16]认为测定体外细胞的放射敏感性是判定肿瘤放疗反应的一个非常有用的指标。Williams等[17]也认为测定细胞放射敏感性可预测临床放疗效果;第三,本实验表明,当放疗剂量达8 Gy/次或以上时,两组细胞的存活率(S)均为0。这提示临床上如果单次放射剂量很大时,照射野内的肿瘤细胞有可能被全部杀死,但同时正常细胞可能也难逃厄运。
综上所述,笔者可以得出如下结论:外放射可以使体外培养的肿瘤细胞的MDR1 mRNA表达增强;这种被照射细胞由于其MDR1 mRNA的表达增强,它对其后的化疗药产生了耐药性,并且这种耐药性还可以被化疗增敏剂所逆转;不仅如此,被照射的细胞对其后的放疗也产生了耐受。表明化疗药以外的损伤因素也可以使多药耐药基因表达增强,而这些损伤因素所引起的多药耐药基因的高表达均可以使细胞对后来的其他损伤因素(如放疗等)产生耐受。因此,多药耐药基因应改称耐多种损伤基因似乎更能体现其内涵。
[1]Thorgeirsson SS,Huber BE,Sorrell S,et al.Expression of the multidrugresistant gene in hepatocarcinogenesie and regenerating rat liver[J].Science,1987,236(4805):1120-1122.
[2]章小平,杨红枚,鲁功成,等.膀胱癌MRP亚克隆的建立及其MDR表性型[J].中华肿瘤杂志,2000,22(3):273-275.
[3]Gazdar AF,Carney DN,Arion M,et al.Characterization of variant subclasses of cell lines derived from small cell lung cancer having distinctive biochemical,morphological,and growth properties[J].Cancer Research,1985,45(6):2924-2930.
[4]段蕴铀,宋鹏,聂青,等.外照射对体外培养的小细胞肺癌细胞系总RNA及多药耐药基因的影响[J].北京医学,2002,24(4):254-256.
[5]Sanchez AM,Barrett JT,Schoenlein PV,et al.Fractioned ionizing radiation accelerates loss of amplified MDR1 genes harbored by extrachromosomal DNA in tumor cells[J].Cancer Research,1998,58(17):3845-3854.
[6]宋鹏,段蕴铀,杨建军,等.维拉帕米对外照射导致的小细胞肺癌细胞系耐药性的逆转作用[J].解放军医学杂志,2007,32(4):365-367.
[7]陈历排,周昊,李志阳,等.用微量板ATP生物发光法检测肿瘤细胞对化疗药物的敏感性[J].肿瘤,2000,20(2):103.
[8]唐伟,谯体义,陈在贤,等.自体肿瘤细胞药敏检测指导膀胱癌术后化疗[J].重庆医学,1999,28(2):94-96.
[9]胡江文,沈振亚,杨吉成,等.γ-干扰素与维拉帕米联合逆转人肺癌细胞系的多药耐药[J].苏州大学学报:医学版,2003,23(1):17.
[10]李建人,赵彼得,罗沈如,等.高热合并化疗放疗对人结肠癌细胞的作用[J].中华理疗杂志,1995,18(3):131-133.
[11]梁利波,千新来,马业伟,等.EIA基因对人肺腺癌细胞增殖和细胞周期的影响[J].中华结核和呼吸杂志,2001,24(11):663-665.
[12]夏寿萱.放射生物学[M].北京:军事医学科学出版社,1998:90-91.
[13]Mosman T.Rapid colorimetric assay for cellular growth and survival:application to proliferation and cytotoxicity assays[J].J Immuno Meth,1983,65(1-2):55-63.
[14]Hoff DD,Casper J,Bradier E,et al.Association between human tumor colony-forming assay results and response of an individual patient′s tumor to chemotherapy[J].Am J Med,1981,70(5):1027-1041.
[15]王宝成,李志,郭军,等.TAM 对非小细胞肺癌经NVB-DDP 方案诱导耐药性逆转的临床观察[J].中国肿瘤临床,2003,30(9):656.
[16]Fertil B,Malaise EP.Intrinsic radiosensitivity of human cell lines is correlated with radioresponsiveness of human tumors:analysis of 101 published survival curves [J].Int J Radiat Oncol Binl Phys,1985,14(11):1699-1706.
[17]Williams M,Lyu M,Yang Y,et al.IER5,a novel member of the slow kinetics immediate-early genes[J].Genomics,1999,55(3):327-334.
