S100A4/Mts1在低氧诱导肺动脉平滑肌增殖中的作用机制
2012-07-27李运成贺斌峰王关嵩
李运成 刘 婷 贺斌峰 王关嵩
S100A4,又被称作Mts1,是S100蛋白家族的成员之一。研究发现S100至少包含25种蛋白,除了S100G以外,其他均为Ca2+结合蛋白。他们参与Ca2+信号传导,并通过钙离子信号传导途径作用于靶蛋白改变其活性,在细胞增殖、分化等过程中发挥重要作用。最近研究表明S100A4/Mts1基因不仅参与肿瘤的增殖、转移和侵袭,而且可促进肺动脉平滑肌(pulmonary arterial smooth muscle cells,PASMCs)的增殖、迁移,但其作用机制尚不明确[1-2]。本研究旨在对S100A4在低氧刺激肺动脉平滑肌增殖中的作用机制进行初步探讨。
材料与方法
一、主要试剂
SD大鼠由重庆市动物实验中心提供,胎牛血清(fetal bovine serum,FBS)、低糖DMEM培养基、胰酶均购自美国GIBCO公司;p-JAK2(#9134)兔抗鼠单克隆抗体、p-STAT3(#38167)兔抗鼠单克隆抗体购于美国Scien Cell公司;S100A4(#ab27957)兔抗鼠单克隆抗体购于Abcam公司;辣根酶标记山羊抗兔IgG(H+L)购自北京华肽先锋生物公司(#40116);AG490购自武汉博士德公司;细胞裂解液、ECL化学发光试剂盒均购自PIERCE公司(#78503、#1856135);生物素标记山羊抗兔IgG(H+L)、DAPI购自江苏碧云天科技有限公司(#A0277、#C1005)
二、方法
1.大鼠肺动脉平滑肌细胞(pulmonary arterial smooth muscle cells,PASMCs)细胞分离及培养:PASMCs从雄性SD大鼠肺动脉中分离得到,方法参照文献[3]。分离出的PASMCs在含10%的胎牛血清的低糖DMEM中于37℃、饱和湿度下5%CO2的培养箱中传代培养,取对数生长期的细胞进行实验。
2.大鼠PASMCs细胞的低氧刺激:取4瓶对数期生长、融合度95%以上的细胞,分为低氧组和干预组,吸出原有培养基,加入4 ml 0.1%FBS低糖DMEM培养基中常氧培养24 h,干预组在放入低氧环境前45 min加入30μM AG490(30μl),低氧组加入等量生理盐水,这两组细胞放入在0.3%O2、5%CO2、94.7%N2低氧环境中分别培养0 h、8 h。
3.免疫荧光:用0.01M PBS洗涤各组细胞后,加入4%多聚甲醛覆盖2~3 mim,室温固定15 min,吸出固定液,PBS洗涤3次,每次5 min,冰冻10%甲醇覆盖细胞3~5 mim,孵育10 min,冰冻PBS冲洗5 min,3%BSA(tritionin稀释)封闭60 min,吸出封闭液,加入 S100A4兔抗鼠单克隆抗体(1︰50,购自Abcam)工作液,4℃过夜,PBS洗涤3次,每次5 min,室温避光孵育2抗(生物素标记的二抗为羊抗兔多克隆抗体,购自武汉博士德公司,工作浓度1︰200)1~2 h,PBS洗涤3次,每次5 min,加入 DAPI(1︰1000,购自碧云天),避光封闭1 h,PBS洗涤3次,每次5 min,封片,使用激光共聚焦显微镜进行检测。
四、Western blot检测
1.S100A4蛋白的表达检测:收集低氧组刺激0 h、8 h和低氧干预组细胞,加裂解液提取总蛋白,加5X Loading buffer,煮沸5 min变性。配制15%分离胶、5%浓缩胶后进行SDS-PAGE凝胶电泳,300 mA湿转25 min,将PVDF膜置于5%脱脂奶粉室温封闭1 h,用TBST洗膜10 min,加入5%脱脂奶粉稀释的S100A4一抗(1︰1000)中4℃孵育过夜,次日TBST漂洗3次,每次5 min,放入5℅脱脂奶粉稀释的辣根过氧化物酶标记羊抗兔IgG(1︰1000)抗体中室温孵育1 h,TBST漂洗3次,每次5 min,ECL化学发光法显色。以GAPDH内参蛋白进行校正。
2.p-JAK2蛋白的表达检测:收集干预组和对照组低氧刺激0 h、8 h的细胞,加裂解液提取总蛋白,加5X Loading buffer煮沸5 min变性。配制8%分离胶、5%浓缩胶后进行SDS-PAGE凝胶电泳,300 mA湿转2.5 h。将PVDF膜置于5%脱脂奶粉室温封闭1 h,用TBST洗膜10 min,加入5%BSA稀释的p-JAK2一抗(1︰1000)中4℃孵育过夜,余步骤同前。
3.p-STAT3蛋白的表达检测:收集各组的蛋白,变性后,配制10%分离胶、5%浓缩胶后进行SDSPAGE凝胶电泳,300 mA湿转1.5 h,将PVDF膜置于5%脱脂奶粉室温封闭1 h,用TBST洗膜10 min,加入5%BSA稀释的p-STAT3一抗(1︰1000)中4℃孵育过夜,余步骤同前。
五、统计学处理
使用Image-Pro Plus 10.0对图像进行分析,使用SPSS 13.0 for windows对数据进行分析,各实验至少重复3次,两组均数间比较用配对t检验,P<0.05为差异有统计学意义。
结 果
一、免疫荧光
低氧0 h S100A4/Mtsl在胞浆中少量表达,低氧刺激8 h后胞浆及胞核中明显表达,见图1。
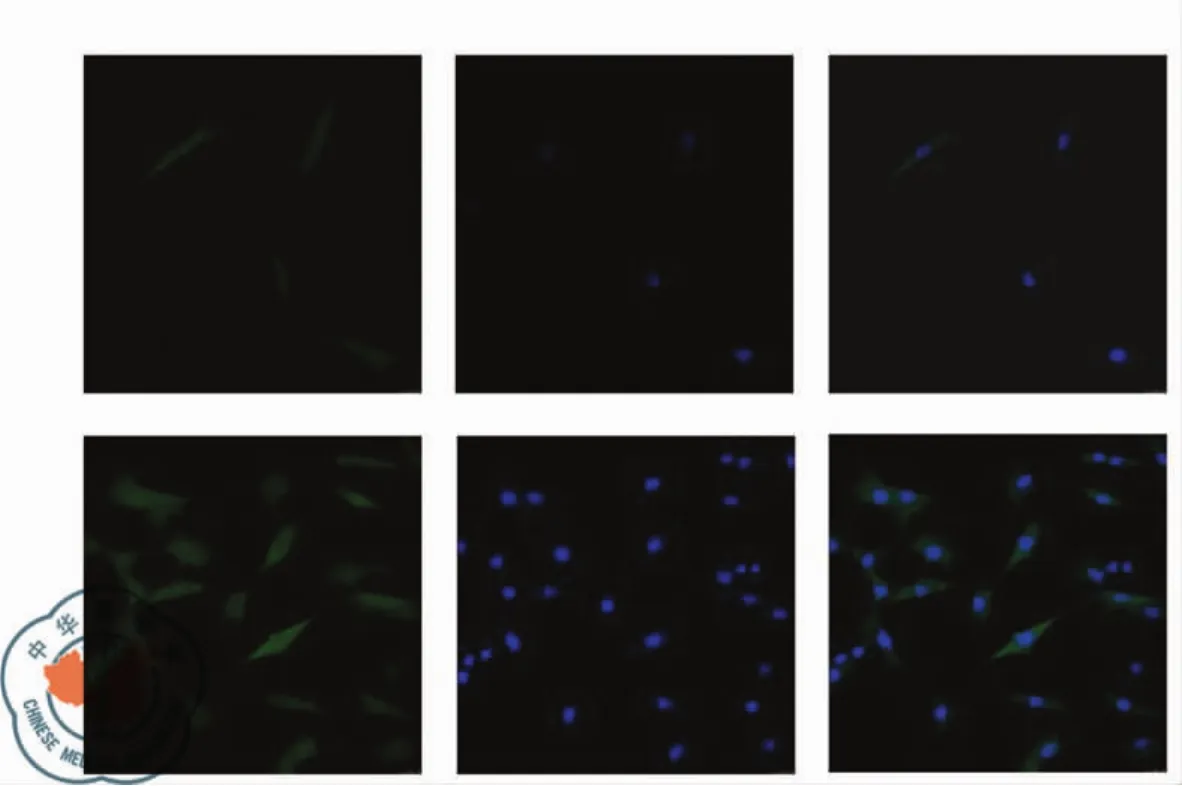
图1 低氧刺激PASMCs 0 h及8 h组S100A4的表达
二、Western blot检测
1.S100A4/Mtsl蛋白在低氧刺激8 h比低氧刺激0 h表达明显升高(P<0.05),AG490干预低氧刺激8 h组S100A4/Mtsl蛋白的表达较低氧刺激8 h组显著下降(P<0.05),见图2。

图2 S100A4/Mtsl蛋白的表达
2.p-JAK2蛋白在低氧刺激8 h比低氧刺激0 h表达明显升高(P<0.05),AG490干预低氧刺激8 h组三种蛋白的表达较低氧刺激8 h组显著下降(P<0.05),见图3。
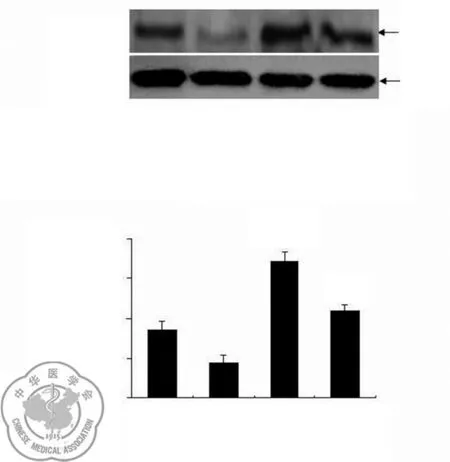
图3 p-JAK2蛋白的表达
3.p-STAT3蛋白在低氧刺激8 h比低氧刺激0 h表达明显升高(P<0.05),AG490干预低氧刺激8 h组三种蛋白的表达较低氧刺激8 h组显著下降(P<0.05),见图4。
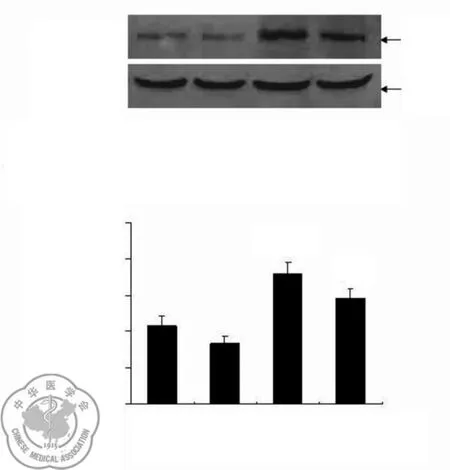
图4 p-JAK2蛋白的表达
讨 论
S100A4是一种EF-手型钙结合蛋白,通过对钙离子的调节及与靶蛋白的相互作用。在体内发挥多种生物学作用,参与细胞周期活动、细胞分化、肿瘤生长以及细胞外基质分泌活动等过程[1]。近年来的研究表明S100A4在肿瘤中呈高表达,并通过影响细胞骨架重排等作用机制来影响肿瘤的转移机制[4-6]。本研究发现在低氧刺激下S100A4在胞浆和胞核中的表达比常氧下明显升高,S100A4蛋白表达显著高于常氧组,其他的研究也支持上述结论[7-8]。这表明低氧可对S100A4基因进行调控。同时在低氧刺激下PAMSC细胞也从合成型转变为分泌型,细胞开始增殖[3]。提示S100A4与PMASC的增殖有着密切的关系,与文献报道一致[2]。
JANUs激酶(januskinase,JAK)家族属于胞浆部分的蛋白酪氨酸激酶,是作为受体和最终效应分子之间的介导分子,主要参与细胞因子受体介导的信号转导[9-10]。信号转导和转录激活子(signal transducers and acti 2 vator of transcrip tions,STATs)是一类能与靶基因调控区DNA结合的胞质蛋白,是JAKs的下游底物。JAK-STAT通路广泛参与细胞的增殖、分化、应激、凋亡、炎症反应和免疫调节等[11]过程,此通路能够将信号迅速由细胞外传递至细胞内,并进入核内启动RNA转录和蛋白翻译。研究表明低氧刺激可激活多种细胞中的JAK-STAT信号通路[12-14]。本研究中RPAMSC在低氧8 h组p-JAK2、p-STAT3蛋白表达明显高于常氧组,有显著性差异,与文献报道一致[12-13]。许多研究表明JAKs或/和STATs在低氧或氧化应激作用下被激活,提示STATs的磷酸化对低氧或氧化应激环境中的细胞起调节作用[15]。AG490是可与受体酪氨酸激酶竞争结合位置,特异性阻滞各种细胞因子引起的JAK2和下游分子STAT3的的磷酸化激活,从而阻断JAK-STAT信号通路。结果中AG490干预组较低氧8 h组p-JAK2、p-STAT3的蛋白表达显著降低,与Wang等[13]的结果一致。
我们的结果显示在AG490的干预下,S100A4蛋白的表达比单纯低氧组有显著的降低。低氧调控S100A4表达的分子机制目前尚不清楚,低氧诱导的关键性分子事件是Hif-1(hypoxia induced factor 1)的激活,Hif-1是由Hif-1α和Hif-1β组成的异源二聚体,与低氧反应元件(hypoxia responsive element,HRE)结合后激活靶基因如VEGF、EPO、Glut1等转录[16]。有研究表明在S100A4基因的第一个启动子中含有HRE,Hif-1-1α可通过与HRE的结合来激活S100A4基因的转录[8,17]。Xu等[18]阐明了在肾母细胞瘤中STAT3能够调节AKt的表达,进而上调生长因子诱导的HIF-1的高表达。他们在体外实验中,以小分子抑制剂作用于STAT3实现了阻断HIF-1的表达。提示AG490可能通过抑制JAK2-STAT3信号通路,间接影响了S100A4的表达。
综上所述,PAMSC在低氧刺激下S100A4蛋白的表达增高,提示S100A4在PAMSC的增殖中起重要的作用,进一步揭示低氧肺动脉高压的形成机制。同时AG490可间接抑制S100A4的表达,提示AG490可用于减缓肺动脉高压的发病进程。
1 Donato R.S100:a multigenic family of calcium-modulated proteins of the EF-hand type with intracellular and extracellular functional roles[J].Int J Biochem Cell Biol,2001,33(7):637-668.
2 Frid MG,Li M,Gnanasekharan M,et al.Sustained hypoxia leads to the emergence of cells with enhanced growth,migratory,and promitogenic potentials within the distal pulmonary artery wall[J].Am J Physiol Lung Cell Mol Physiol,2009,297(6):L1059-L1072.
3 Bai L,Yu Z,Qian G,et al.SOCS3 was induced by hypoxia and suppressed STAT3 phosphorylation in pulmonary arterial smooth muscle cells[J].Respir Physiol Neurobiol,2006,152(1):83-91.
4 Sherbet GV,Lakshmi MS.S100A4(MTS1)calcium binding protein in cancer growth,invasion and metastasis[J].Anticancer Res,1998,18(4A):2415-2421.
5 Lakshmi MS,Parker C,Sherbet GV.Expression of the transmembraneglycoprotein CD44 and metastasis associated 18A2/MTS1 gene in B16 murine melanoma cells[J].Anticancer Res,1997,17(5A):3451-3455.
6 Ambartsumian N,Klingelhofer J,Grigorian M,et al.The metastasis-associated Mts1(S100A4)protein could act as an angiogenic factor[J].Oncogene,2001,20(34):4685-4695.
7 Zhang R,Fu H,Chen D,et al.Subcellular distribution of S100A4 and its transcriptional regulation under hypoxic conditions in gastric cancer cell line BGC823[J].Cancer Sci,2010,101(5):1141-1146.
8 Liao SH,Zhao XY,Han YH,et al.Proteomics-based identification of two novel direct targets of hypoxia-inducible factor-1 and their potential roles in migration/invasion of cancer cells[J].Proteomics,2009,9(15):3901-3912.
9 Fujitani Y,Hibi M,Fukada T,et al.An alternative pathway for STAT activation that is mediated by the direct interaction between JAK and STAT[J].Oncogene,1997,14(5A):751-761.
10 Horvath CM,Darnell JE.The state of the STATs:recent developments in the study of signal transduction to the nucleus[J].Curr Opin Cell Biol,1997,9(2):233-239.
11 O'Shea JJ,Murray PJ.Cytokine signaling modules in inflammatory responses[J].Immunity,2008,28(4):477-487.
12 Ruscher K,Freyer D,Karsch M,et al.Erythropoietin is a paracrine mediator of ischemic tolerance in the brain:evidence from an in vitro model[J].J Neurosci,2002,22(23):10291-10301.
13 Wang GS,Qian GS,Zhou DS,et al.JAK-STAT signaling pathway in pulmonary arterial smooth muscle cells is activated by hypoxia[J].Cell Biol Int,2005,29(7):598-603.
14 Lin AM,Dung SW,Chen CF,et al.Hypoxic preconditioning prevents cortical infarction by transient focal ischemia-reperfusion[J].Ann N Y Acad Sci,2003,993:168-178.
15 Negoro S,Kunisada K,Fujio Y,et al.Activation of signal transducer and activator of transcription 3 protects cardiomyocytes from hypoxia/reoxygenation-induced oxidative stress through the upregulation of manganese superoxide dismutase[J].Circulation,2001,104(9):979-981.
16 Airley RE,Mobasheri A.Hypoxic regulation of glucose transport,anaerobic metabolism and angiogenesis in cancer:novel pathways and targets for anticancer therapeutics[J].Chemotherapy,2007,53(4):233-256.
17 Ke Q,Costa M.Hypoxia-inducible factor-1(HIF-1)[J].Mol Pharmacol,2006,70(5):1469-1480.
18 Xu Q,Briggs J,Park S,et al.Targeting Stat3 blocks both HIF-1 and VEGF expression induced by multiple oncogenic growth signaling pathways[J].Oncogene,2005,24(36):5552-5560.
