保护性有氧肺膨胀与移植肺保护形态学的研究
2012-07-27洪文娟洪志鹏尹小川太熊国盛杨学庆晋德光
洪文娟 黄 韬 洪志鹏 张 璟 尹小川太 祥 熊国盛 赵 炜 杨学庆 晋德光
肺脏保护与保存技术是肺移植领域研究的重点。为了解在移植肺的保存过程中,肺充气膨胀状态和肺保护之间的关系,本实验通过肺过度膨胀动物模型对肺膨胀与移植肺的保护进行了研究。
材料和方法
实验用杂种犬16只,体质量10~15 kg,昆明医科大学实验动物中心提供,雌雄不拘。实验设计根据配对原则,随机分为对照组和实验组,每组8只。动物模型制备时,所有动物均肌注戊巴比妥钠30 mg/kg麻醉,气管内插单腔管,潮气量15 ml/kg,呼吸频率24次/min,吸呼比1︰1.5。股动脉插管测体循环动脉压,股静脉插管测中心静脉压;于左第五肋间后外侧切口开胸,切除中、上肺叶,松解下肺韧带,让肺下叶膨胀。心电监护仪连续记录体循环平均动脉压(mean arterial pressure,MAP)和中心静脉压(central venous pressure,CVP)。于左锁骨中线第三肋间插胸管接闭式引流瓶。实验组提高潮气量,闭式引流加负压吸引,维持负压于20 cmH2O(1 cmH2O=0.098 kPa)左右,建立肺过度膨胀动物模型。对照组保持正常通气膨胀肺,两组持续观察6 h,认真观察各项监测指标。
实验结束后,在左肺下缘相同部位取四小块肺组织,制作光镜肺脏病理学标本:将肺组织标本置于4%多聚甲醛的固定液中,固定24 h后,经脱水、透明、石蜡包埋后制备病理切片,HE染色后,观察肺组织病理学改变。
电镜标本,于光镜取材部位切取1 mm×1 mm×1 mm大小标本置2.5%戊二醛固定,丙酮脱水,环氧树脂618包埋,超薄切片,醋酸铀、柠檬酸铅双重染色,JEM-100CX投射电镜下观察肺组织超微结构变化。
结 果
一、两组MAP和CVP比较:实验组MAP低于对照组,CVP实验组高于对照组,见表1。
表1 MAP与CVP比较()Table 1 Comparison of MAP and CVP()
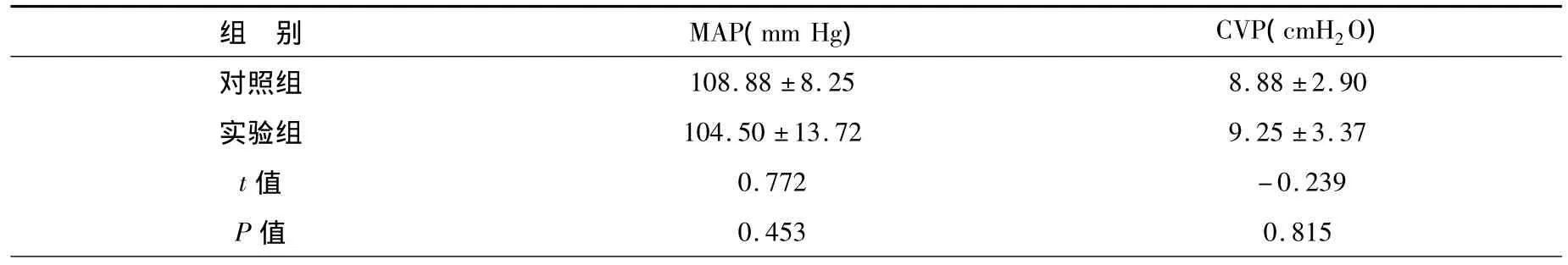
表1 MAP与CVP比较()Table 1 Comparison of MAP and CVP()
注:1 mm Hg=0.133 kPa
组 别 MAP(mm Hg) CVP(cmH2O)0.453 0.815108.88 ±8.25 8.88 ±2.90实验组 104.50 ±13.72 9.25 ±3.37 t值 0.772 -0.239 P值对照组
从表1中可看出,MAP与CVP两组的改变无差异,P>0.05。图1和图2显示实验过程中MAP和CVP的动态变化,但两组均无统计学意义。
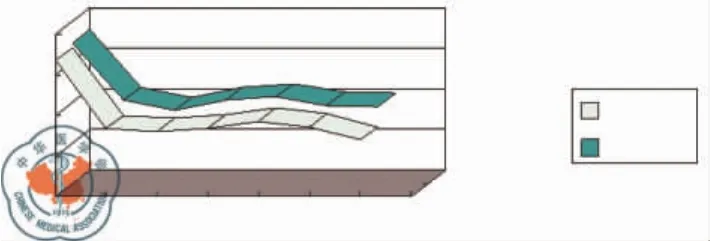
图1 MAP动态变化
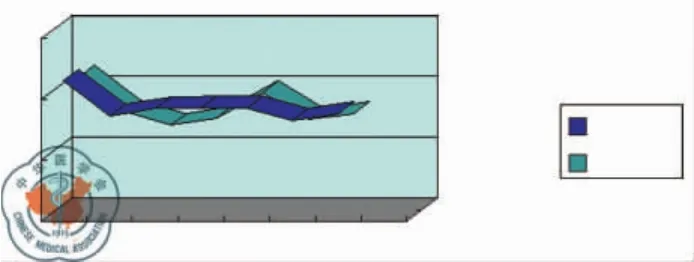
图2 CVP动态变化
二、光镜下病理组织学变化
实验组见部分肺泡扩张,间隔变窄、断裂、扩张的肺泡融合成较大的囊腔;部分间隔水肿、增宽、中性粒细胞浸润;血管增粗、管壁变厚;受膨胀肺泡的挤压,部分区域肺泡膨胀欠佳(图3)。对照组的病理变化显示肺泡结构完整,泡壁无破裂,肺微血管结构基本正常,血管壁略显增厚、水肿不明显(图4)。

图3 光学显微镜下实验组病理形态
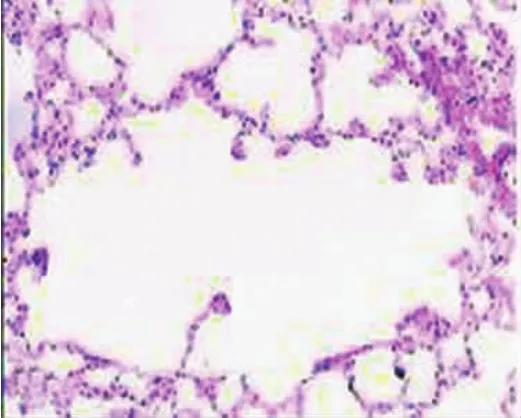
图4 光学显微镜下对照组病理形态
三、电镜下肺超微结构的变化
实验组肺泡的超微结构改变表现为肺泡Ⅰ型上皮结构不清,细胞胞质肿胀、空泡形成、破裂,核染色质凝固、结块;Ⅱ型上皮胞质肿胀、破裂,嗜锇性板层体排空明显;上皮细胞脱落基底膜暴露;毛细血管内皮细胞肿胀空泡变性,内皮细胞连接伸展、增宽;毛细血管基底膜通透性增加,肺泡腔内出现红细胞。对照组肺超微结构的变化相对较轻(图5~6)。
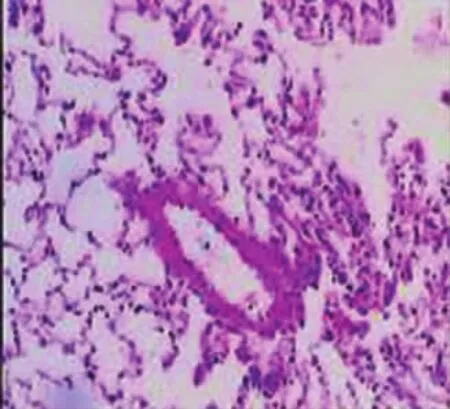
图5 电子显微镜下Ⅱ型肺泡病理形态
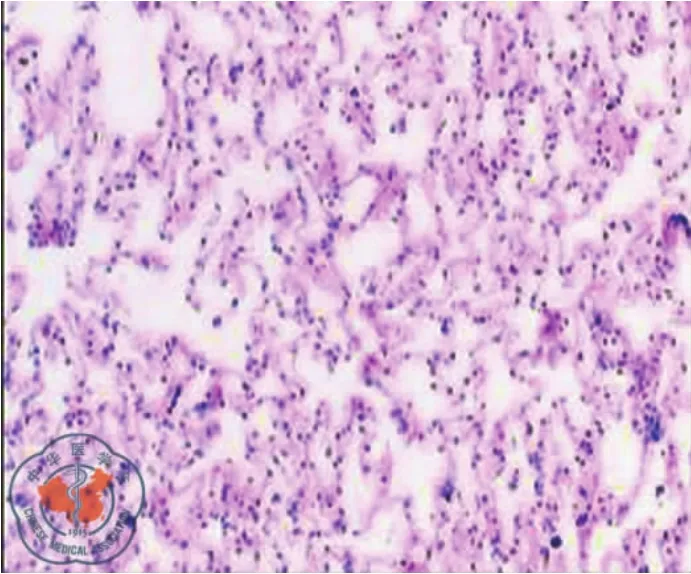
图6 电子显微镜下Ⅰ型肺泡型病理形态
讨 论
在移植肺采集和保存的整个过程中,从供肺的切取、灌洗、贮存、再灌洗到植入受体后恢复血液再灌注和机械通气,无论是单肺移植、双肺移植还是心肺联合移植,或自体肺移植,均不可避免的涉及到对肺充气膨胀以保护好器官的问题[1-7]。
肺保存的目的是降低肺损伤,提高移植器官的可用性。目前临床肺移植的保存技术涉及肺膨胀、保存液、灌洗液、供氧和贮存温度等问题,其中肺膨胀的合理水平仍不明确,肺膨胀对肺保存质量的关系日益受到人们的关注。本研究采取在体功能肺模拟移植肺的研究,以排出离体真实移植肺研究时缺血再灌注损伤(ischemia-reperfusion injury,IRI)的影响与干扰;排除了离体静态肺膨胀对研究的影响与干扰[8-9]。肺移植的供体肺在保存过程中,肺的膨胀状态可能对移植后的肺功能产生重要影响。在我们的研究中,病理变化最引人瞩目的是:①肺泡的“肺气肿”样改变;②肺泡微血管壁和间隔受损;③肺泡Ⅰ型上皮细胞的破坏;④肺泡Ⅱ型上皮细胞板层小体的过度排空。肺的基本功能是吸入氧气,排出二氧化碳,气体交换发生于拥有3亿肺泡的血气界面,巨大的界面极为菲薄,仅0.2~0.3 μm。因此,占肺泡面积95%的Ⅰ型上皮细胞首当其冲,非常容易受到损害,如胞质局部受损,细胞可以恢复,为可逆性损伤;损伤一旦累及胞核,细胞陷于不可逆性损伤。
肺与其他移植器官不同,它具有自己的特殊性。首先,肺气体交换的过程是外呼吸,而其它移植器官是内呼吸,即组织换气。其次,肺在获取和保存期间通过充入肺泡的氧气,以及灌注液提供的能量,可以维持一定时间的有氧代谢。因此,可以通过对移植肺的保护性膨胀提供氧气。从本研究的实验得知,由于过度膨胀性肺损伤,肺泡扩大、破裂、融合,弹性失去,肺组织动态顺应性会降低。受过度膨胀肺泡的挤压,部分区域扩张不全,通气与血流比例失调,使换气功能发生障碍,肺泡毛细血管与肺间质的损伤则加重了低氧血症。说明过度膨胀的肺,气体不能正常实现跨肺泡I型上皮细胞、基膜和毛细血管内皮细胞进行交换,完成外呼吸过程。Haniuda等[10]的研究表明,保存和灌洗时如对供肺过度膨胀,肺移植术后供体肺功能不全的发生率显著升高。基于本研究结果,我们主张保护性肺膨胀应是正常的肺通气状态。
肺的过度膨胀可造成表面活性物质的过度损耗,正如在电镜下所观察到的肺泡Ⅱ型上皮细胞中板层小体的过度空化,而对照组相对较轻,这提示动态肺顺应性和肺泡表面活性物质的分泌功能在正常肺膨胀状态下保持得更好。同样临床观察也能发现,外源性表面活性物质治疗能够改善肺移植之后的肺功能。另外,Ⅱ型肺泡细胞是肺泡上皮干细胞,是肺泡损伤后主要的增生、修复细胞,对维持肺泡的正常结构和功能具有重要作用。
早期的研究已证实了肺萎陷在低温下亦可得到一定程度的安全保护,但是有氧的肺脏更有利于保存[11-14]。本研究认为有氧肺膨胀可能对维持肺组织的需氧代谢,保持肺泡表面活性物质的完整性,在保证肺泡上皮流动性,最大限度避免肺损伤方面更具优越性。
本研究的结果表明,肺移植后要想获得一个好的结果,前期在肺保存期间应避免肺过度膨胀,防止气压伤与容积伤。肺膨胀不足同样会带来不利影响,塌陷的肺使得肺泡液流动清除性降低,肺膨胀不全或肺充气容积低的状态下保存器官可导致较高的肺血管阻力和肺保存液分布不均。因此,供肺的保护应保持更加符合生理的有氧膨胀状态,与正常吸气末状态相一致。对活体肺叶移植术后的动力型肺过度膨胀性损伤的防治,关键在于胸膜腔负压的调控,胸腔负压宜小不宜大,酌情逐渐增加。活体肺移植的临床研究显示术后胸腔负压大于20 cmH2O,可导致移植肺的过度膨胀[15]。
1 Venkateswaran RV,Patchell VB,Wilson IC,et al.Early donor management increases the retrieval rate of lungs for transplantation[J].Ann Thorac Surg,2008,85(1):278-286.
2 Bernat JL,Capron AM,Bleck TP,et al.The circulatory-respiratory determination of death in organ donation[J].Crit Care Med,2010,38(3):963-970.
3 Ganesh JS,Rogers CA,Banner NR,et al.Does the method of lung preservation influence outcome after transplantation?An analysis of 681 consecutive procedures[J].J Thorac Cardiovasc Surg,2007,134(5):1313-1321.
4 Brasile L,Buelow R,Stubenitsky BM,et al.Induction of heme oxygenase-1 in kidneys during ex vivo warm perfusion[J].Transplantation,2003,76(8):1145-1149.
5 Maathuis MH,Leuvenink HG,Ploeg RJ.Perspectives in organ preservation[J].Transplantation,2007,83(10):1289-1298.
6 Cypel M,Rubacha M,Yeung J,et al.Normothermic ex vivo perfusion prevents lung injury compared to extended cold preservation for transplantation[J].Am J Transplant,2009,9(10):2262-2269.
7 Pasque MK.Standardizing thoracic organ procurement for transplantation[J].J Thorac Cardiovasc Surg,2010,139(1):13-17.
8 Herrington CS,Prekker ME,Arrington AK,et al.A randomized,placebo-controlled trial of aprotinin to reduce primary graft dysfunction following lung transplantation[J].Clin Transplant,2011,25(1):90-96.
9 Knudsen L,Boxler L,Mühlfeld C,et al.Lung preservation in experimental ischemia/reperfusion injury and lung transplantation:a comparison of natural and synthetic surfactants[J].J Heart Lung Transplant,2012,31(1):85-93.
10 Meyers BF,Patterson GA.Lung transplantation[A].Pearson FG,Cooper JD,Deslauriers J,et al.Thoracic Surgery[M].2nd edition.Health Science Asia,Elsevier Science,2002:1085-1114.
11 Müller C,Hoffmann H,Bittmann I,et al.Hypothermic storage alone in lung preservation for transplantation:a metabolic,light microscopic,and functional analysis after 18 hours of preservation[J].Transplantation,1997,63(5):625-630.
12 Kutschka I,Sommer SP,Hohlfeld JM,et al.In-situ topical cooling of lung grafts:early graft function and surfactant analysis in a porcine single lung transplant model.Thoracic Transplant Program[J].Eur J Cardiohorac Surg,2003,24(3):411-419.
13 Imber CJ,St Peter SD,Lopez de Cenarruzabeitia I,et al.Advantages of normothermic perfusion over cold storage in liver preservation[J].Transplantation,2002,73(5):701-709.
14 Lucangelo U,Del Sorbo L,Boffini M,et al.Protective ventilation for lung transplantation[J].Curr Opin Anaesthesiol,2012,25(2):170-174.
15 Haddy SM,Bremner RM,Moore-Jefferies EW,et al.Hyperinflation resulting in hemodynamic collapse following living donor lobar transplantation[J].Anesthesiology,2002,97(5):1315-1317.
