射干麻黄配伍对射干异黄酮类成分在大鼠体内药代动力学的影响
2012-07-26杨万军张伟东王晓娟
杨万军, 张伟东, 王 莹, 王 青, 顾 宜, 王 荣, 王晓娟
(第四军医大学口腔医学院药剂科,陕西西安710032)
中药射干为鸢尾科射干属植物射干Belamcanda chinensis(L.)D C.的干燥根茎。射干的药理作用明显,具有清热解毒、利咽消痰、散瘀消肿的功效[1],主要用于治疗流感及上呼吸道感染[2]。临床上常与其他药物配伍使用,如与麻黄配伍治疗支气管哮喘,其疗效已为大量临床应用所证实[3-5]。射干中含有丰富的异黄酮类成分,实验研究证实其具有显著的抗炎、祛痰平喘、抗病毒、抑菌作用[6-9],本课题在药效试验 (文章另发)基础上,通过比较射干提取物与麻黄提取物配伍前后大鼠体内射干异黄酮类成分射干苷元、野鸢尾黄素、次野鸢尾黄素 (结构见图1)的药代动力学,揭示麻黄与射干配伍后射干异黄酮类成分在大鼠体内的变化规律,为射干、麻黄配伍提供现代科学依据。
1 试药与仪器
1.1 药品与试剂 射干苷元 (Tectorigenin)、野鸢尾黄素 (Irigenin)、次野鸢尾黄素 (Irisforentin)分别由本实验室分离获得,纯度>98.0%;山柰酚(Kaempferol,批号1124S,购自北京恒元启天化工院);甲醇、乙腈 (色谱纯,德国Merck公司);甲酸 (色谱纯,美国Agilent);Mili-Q超纯水。β-葡萄糖醛酸酶 (规格1240000U/G,批号 G0251,美国SIGMA公司)。
1.2 仪器 6460型三重四极杆串联质谱仪 (美国Agilent technology公司),配有电喷雾离子源(ESI)及 MassHunter VersionB.04.10工作软件;Agilent 1290 Infinity超高效液相色谱系统,含G4220A二元泵、G1314E VWD检测器、G1316C柱温箱及G4226A自动进样器。

图1 3个黄酮类成分及内标山柰酚的化学结构Fig.1 Chemical structures of three isoflavonids and IS(kaempferol)
2 方法与结果
2.1 色谱条件 Agilent Zorbax SB-C18柱 (2.1 mm×50 mm,1.8 μm),Agilent在线过滤器;以乙腈(ACN)-水 (含0.1%甲酸FA)为流动相梯度洗脱 (洗脱梯度见表1),柱温30℃,进样量5 μL。

表1 流动相洗脱梯度Tab.1 Mobile phase gradients
2.2 质谱条件 采用电喷雾电离源 (ESI);扫描方式为多反应监测模式 (MRM);喷雾气压为310.275 kPa,雾化器温度为350℃;毛细管电压为正离子4 kV,负离子3.5 kV;气流速度10 L/min。扫描时间为13 min。用于定量分析的离子反应及质谱参数见表2。

表2 定量离子及质谱参数Tab.2 Isoflavonids MRM transitions
2.3 溶液的配制
2.3.1 对照品溶液的配制 精密称取鸢尾苷元41.08 mg、野鸢尾黄素44.64 mg、次野鸢尾黄素44.64 mg,用甲醇溶解定容至10 mL量瓶中,配成质量浓度分别为4.108、4.464、4.464 mg/mL的混合对照品溶液,4℃保存。
2.3.2 实验药品的配制 准确称取射干浸膏1 g 2份,其中一份加入1 g麻黄浸膏,分别用0.1%CMC-Na溶液20 mL溶解混匀,配成50 mg/mL的射干浸膏溶液和药对溶液。
2.3.3 β-葡萄糖醛酸酶的配制 称取28.39 mg β-葡萄糖醛酸酶,乙酸铵溶液 (pH4.7)溶解定容至100 mL量瓶中 (合3520 U/mL),保存于-20℃冰箱中。整个操作须于冰面上进行。
2.4 给药方案与样品采集 雄性Sprague-Dawley大鼠12只,体质量 (200±15)g,由第四军医大学实验动物中心提供,动物许可证号SCXK(军2009027),给药前禁食12 h,随机分为两组:射干组灌胃给予射干浸膏溶液2.5 mL/只,药对组给予药对溶液2.5 mL/只 (经测定,合给药剂量射干苷元31.6 mg/kg,野鸢尾黄素8.5 mg/kg,次野鸢尾黄素14.6 mg/kg)。给药后0、5、10、15、30 min和1、2、3、5、8、12、24 h自眼底静脉取血0.3 mL置肝素化的EP管中,室温静置约30 min后3000 r/min离心5 min,转移上层血浆贮存于-20℃。
2.5 样品处理 50 μL血浆中加入50 μL β-葡萄糖醛酸酶涡旋混匀,37.5℃水浴摇床孵育5 h,加1 μL山柰酚内标溶液 (10 ng/mL)涡旋1 min,2 mL乙酸乙酯萃取两次,12000 r/min离心10 min,上清液45℃氮气吹干,100 μL甲醇复溶,过0.22 μm滤膜进样测定。
2.6 数据处理 应用DAS 2.0药代动力学软件求出药代动力学参数,采用SPSS 13.0软件中Wilcoxon秩和检验和t检验对各组的药代动力学参数进行分析。
2.7 测定方法的建立
2.7.1 方法的专属性 空白血浆、空白血浆加分析物标准品及给药后的血浆样品色谱图见图2。结果显示,空白血浆在与对照品对应的保留时间处没有色谱峰,3个成分及内标均达到基线分离,说明血浆内源性物质、代谢产物及其他成分均不干扰3个目标成分的检出。

图2 空白血浆 (A)、加有对照品和内标物的血浆 (B)和大鼠灌胃给药后的血浆(C)色谱图Fig.2 Typical chromatograms of blank plasma(A),spiked plasma with targets and the IS(B),and the plasma from rats after administration(C)
2.7.2 标准曲线及检测灵敏度 取混合对照品用甲醇按1∶10逐级倍量稀释得不同质量浓度的系列对照品,分别取100 μL空白血浆和100 μL山柰酚内标液对应稀释,按样品处理项下的方法进行处理,得终质量浓度分别为射干苷元2.054~410.8 ng/mL,野鸢尾黄素和次野鸢尾黄素2.232~446.4 ng/mL的标曲样品,进样测定后以目标物和内标物的峰面积比Y对目标物质量浓度C作图。结果见表3。3个成分的定量下限 (LLOQ)分别为2.054、2.232、2.232 ng/mL。

表3 标准曲线及线性范围Tab.3 Calibration curves and dynamic range
2.7.3 准确度与精密度 用空白血浆配制高、中、低3个质量浓度的质控样品各5份,测得峰面积后带入随行标准曲线计算相应的药物质量浓度,与理论值相比,计算方法的准确度;同一质量浓度每隔2 h测定1次,测定3次,计算日内精密度;每隔1 d测定1次,测定3次,测定日间精密度。结果见表4。日内和日间精密度RSD值均小于9%,准确度在93.4%~98.1%之间。
2.7.4 提取回收率 用空白血浆配制高、中、低3个浓度的质控样品各5份,按样品处理项下的方法进行处理。测得峰面积后与同浓度对照品溶液直接进样所得峰面积进行比较,计算提取回收率。结果见表5。结果显示高中低质控样品有着一致的回收率。

表4 准确度与精密度实验结果(n=5)Tab.4 Results of accuracy and precision(n=5)
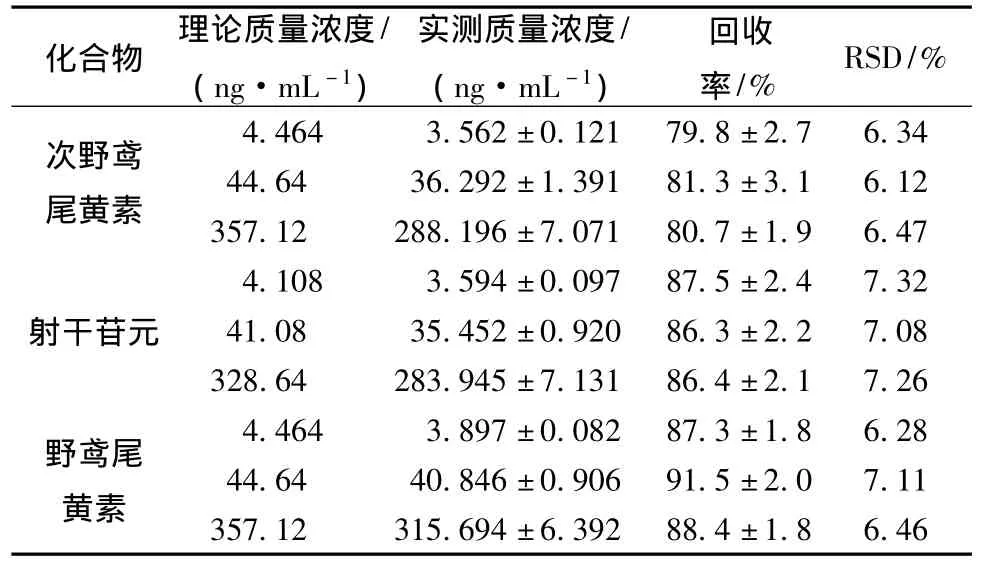
表5 回收率实验结果 (n=5)Tab.5 Results of recoveries(n=5)
2.7.5 样品稳定性实验 配制低、中、高3个质量浓度的空白血浆样品各5份,贮存于-20℃冰箱中,反复冻融3次,每次间隔24 h,按样品处理项下的方法进行处理后进样测定,测得实际值均在理论值的92.3% ~98.3%范围波动,RSD<8.7%。表明样品可以耐受3次冻融。低、中、高质量浓度空白血浆样品室温放置24 h,在-20℃冰箱中放置15日,或经处理后在自动进样器中放置24 h后测定均未见明显下降,表明该3种成分在血浆样品中稳定性良好。
2.7.6 基质效应 用流动相分别配制含山柰酚内标液 (均为10 ng/mL)和射干苷元、野鸢尾黄素、次野鸢尾黄素的高 (328.64、357.12、357.12 ng/mL)、中 (41.08、44.64、44.64 ng/mL)、低(4.108、4.464、4.464 ng/mL)质量浓度混合标准品溶液;另取6份不同来源的大鼠空白血浆样品,按样品处理项下的方法提取,制得与上述标准品相同系列浓度的待测组分和内标物溶液,分别测得血浆基质样品和相应浓度混合标准品溶液中待测组分及内标物的峰面积,并计算其峰面积比,结果其比值均在86.23%~92.71%之间,表明大鼠血浆生物基质不影响样品测定。
2.8 大鼠给药后的药代动力学 应用建立的LC/MS方法,测定大鼠血浆药物质量浓度,各时间点平均药-时曲线见图3。各组药代动力学参数见表6。与射干单独组相比,配伍后射干苷元的t1/2显著延长,表明配伍使得射干苷元的消除变慢;3个成分的AUC(0→t)均显著增加,提示配伍后促进了目标成分吸收进入体循环;野鸢尾黄素、次野鸢尾黄素的Cmax显著增加;射干苷元及次野鸢尾黄素CLz/F明显降低,体内清除过程变缓;次野鸢尾黄素Vz/F显著降低;其余参数未见统计学差异。
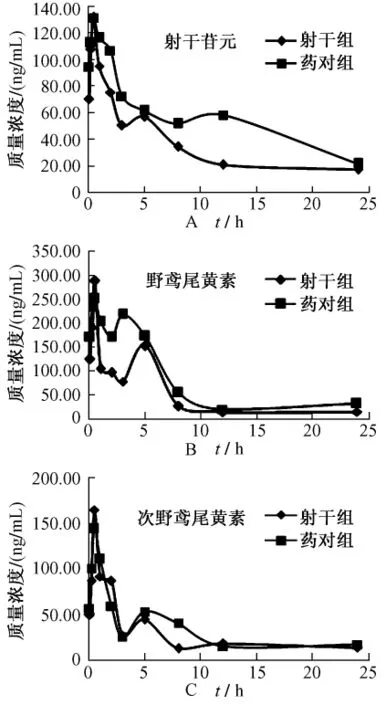
图3 两组大鼠灌胃给药后的平均药时曲线(n=5)Fig.3 Plasma concentration-time profiles of isoflavonids in rat plasma(n=5)
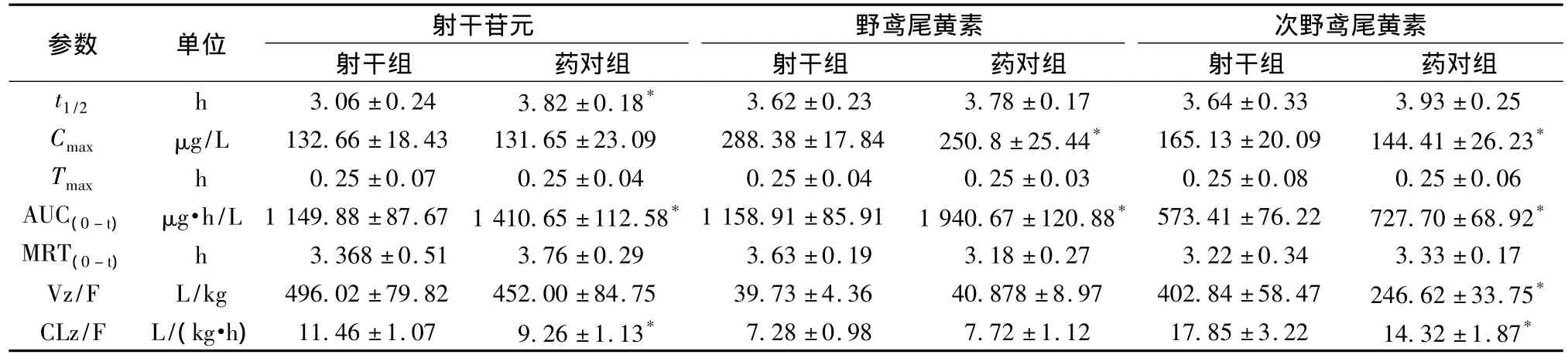
表6 大鼠灌胃给予50 mg/kg射干浸膏及药对浸膏后的药动学参数(n=6)Tab.6 Mean pharmacokinetics parameters of the three isoflavonids after oral administration of extracts(n=6)
3 讨论
葡萄糖醛酸化是单羟基或多羟基黄酮的主要代谢通路,口服给药后,黄酮苷类在肠道菌群的作用下水解为苷元,进入体循环,又在UDPG-葡糖醛酸转移酶的作用下转化为葡萄糖醛酸结合物或苷的形式排出体外[10-12]。因此本实验加入了葡萄糖醛酸酶对样品进行水解,所得到的结果为总苷元。结果显示,3个检测成分在5 min时即可检测到且达峰时间均在0~0.5 h内,提示这3种成分在胃部被很快吸收入血;药时曲线呈现双峰,提示这3种成分在吸收过程中可能存在肠-肝循环、肠-肠循环或胃-肠循环。配伍后射干3种异黄酮苷元成分的t1/2、AUC(0-t)等药代动力学参数发生显著了变化,提示麻黄与射干配伍后在大鼠体内产生了药代动力学的相互影响,其发生作用的环节是否影响药物代谢酶、肠道菌群或者是产生了相互的物理化学作用,尚需进一步深入研究。配伍使得射干异黄酮成分的作用更为持久,一定程度上验证了射干-麻黄这一经典药对配伍的科学性。
前期本课题组考察了射干单用与射干麻黄药对配伍使用治疗小鼠支气管哮喘的药效学差异 (实验结果另行发表),结果配伍优于射干单独使用。配伍导致的药代动力学差异可能是其产生药效学差异的原因之一。
本实验建立了快速灵敏的检测3种射干异黄酮成分的UHPLC-MS/MS方法,可为进一步研究有关射干的药代动力学或定量检测提供参考。
[1]国家药典委员会.中华人民共和国药典:2010版一部[S].北京:中国医药科技出版社,2010:267-268.
[2]郭志辉.射干的化学成分药理和临床研究进展[J].天津药学,2009,21(4):63-66.
[3]Li X M,Brown L V.Efficacy and mechanisms of action of traditional Chinese medicines for treating asthma and allergy[J].J Allergy Clin Immunol,2009,123(2):297-306.
[4]顾云燕.射干麻黄汤及其加减方治疗哮喘研究文献评价[J].中国医院药学杂志,2008,28(9):767-768.
[5]赵 红,王长海,魏亚强.射干麻黄汤对哮喘大鼠气道炎症及外周血Th1/Th2平衡的影响[J].中国中医急症,2010,19(3):466-468.
[6]李国信,秦文艳、齐 越,等.射干提取物抗炎及镇痛药理实验研究[J].实用中医内科杂志,2008,22(1):3-5.
[7]李国信,秦文艳、齐 越,等.射干提取物止咳祛痰药理实验研究[J].实用中医内科杂志,2008,22(2):3-4.
[8]韩 杨,孔 红,李宜平,等.射干的抗病毒实验研究[J].中草药,2005,35(3):306-308.
[9]于 军,苏学今,王 丽.射干、金银花等八种中药抗真菌实验研究[J].军医进修学院学报,2007,28(4):299-302.
[10]何佳珂,于 洋,陈西敬.黄酮类化合物的药物代谢研究进展[J].中国中药杂志,2010,35(21):2789-2795.
[11]闫晶超,刘兆明,王天明,等.泻心汤黄酮类成分在大鼠体内的药代动力学研究[J].药学学报,2007,42(7):722-729.
[12]张伟东,王晓娟,杨万军,等.射干的化学成分研究[J].中国医院药学杂志,2011,31(6):435-436.
