番茄红素对糖尿病模型大鼠肾损伤的治疗及血管紧张素转换酶的作用
2012-07-25江海燕王一龙朱加银赵惠玲
吴 博,江海燕,王一龙,朱加银,赵惠玲
(温州医学院1.实验动物中心,2.眼视光学院,浙江 温州 325035)
糖尿病性肾病(diabetic nephropathy,DN)是糖尿病最常见的慢性并发症之一,也是糖尿病患者致死、致残的主要原因之一。肾素-血管紧张素系统(renin-angiotensin system,RAS)在DN发病中的作用已有大量研究。已往研究认为,血管紧张素转换酶(angiotensin converting enzyme,ACE)是 RAS 的核心酶,在糖尿病的发生、发展过程中扮演关键角色。ACE2是近年来发现的第一个与ACE同源的羧肽酶,其生理作用与ACE相互拮抗。ACE2在糖尿病发生发展的不同阶段对肾具有不同的影响[1-2]。目前尚未见从分子水平检测ACE2 mRNA在肾组织的局部表达来研究药物对DN治疗机制的报道。因此,进一步探索其发病机制,寻找更加有效的防治措施,是当前治疗糖尿病和肾病的重要课题。
番茄红素(lycopene)是一种重要的类胡萝卜素,广泛存在于水果和蔬菜中,其中在番茄中的含量最高。近年来研究表明,番茄红素具有抗氧化、抗突变、降低核酸损伤、减少心血管疾病和预防癌症等多种药理作用。流行病学资料显示,人体内番茄红素含量过低与某些慢性疾病如动脉硬化、糖尿病和癌症等的发生有关[3]。本研究以链脲佐菌素(streptozotocin,STZ)诱导制备2型糖尿病大鼠模型,观察番茄红素对大鼠肾组织ACE和ACE2表达的影响,探讨番茄红素治疗DN的作用机制。
1 材料与方法
1.1 动物
SPF级雄性SD大鼠50只,体质量200~250 g,由上海斯莱克实验动物有限责任公司提供,动物合格证号:SCXK(沪)2007-0005。垫料、饮水、全价颗粒饲料及其他与大鼠接触的物品均经高压灭菌处理。实验和饲养条件严格按照SPF动物的规范要求〔SYXK(浙)2010-0150〕。
1.2 药物、试剂和仪器
STZ,美国Sigma公司;ToxSoms番茄红素软胶囊,南宁富莱欣生物科技有限公司;胰岛素(insulin,Ins)放射免疫试剂盒,北京北方生物技术研究所;血管紧张素Ⅱ(angiotensinⅡ,AngⅡ)放射免疫试剂盒,北京华英生物技术研究所;Trizol试剂盒,美国Invitrogen公司;BcaBESTTMRNA PCR试剂盒Ver.1.1,大连宝生物工程有限公司;PCR引物合成,上海捷瑞生物工程有限公司;兔抗大鼠ACE2多克隆抗体,美国Santa Cruz公司;兔抗大鼠GAPDH多克隆抗体,美国Cell Signaling Technology公司;辣根过氧化物酶标记的羊抗兔IgG抗体,北京中杉金桥生物技术有限公司;BCA蛋白浓度测定试剂盒,碧云天生物技术研究所;ECL化学发光检测试剂盒,美国Thermo公司;其余试剂均为市售分析纯。
血糖仪,德国罗氏诊断公司;7600型全自动生化分析仪,日本日立公司;SN-695B型智能放免γ测量仪,上海核所日环光电仪器有限公司;722型光栅分光光度计,上海精密科学仪器公司;DU530型核酸蛋白测定仪,美国Beckman Coulter公司;PCR仪、凝胶成像仪、垂直板电泳槽和转移电泳槽,美国Bio-Rad公司。
1.3 2型糖尿病模型制备及给药
将50只雄性SD大鼠适应性喂养1周后,按随机分组原则分为正常对照组和模型组。正常对照组(n=10)给予普通饲料喂养4周,不作任何处理;模型组给予高糖高脂饲料(常规饲料加20%蔗糖、10%猪油和2.5%胆固醇)喂养4周后空腹12 h,ip给予大鼠新配制STZ溶液30 mg·kg-1,72 h后尾静脉采血测随机血糖,血糖≥16.7 mmol·L-1者确定为2型糖尿病大鼠模型制备成功。将36只造模成功大鼠按体质量和血糖水平随机分为4组,即模型对照组、番茄红素5,10和20 mg·kg-1组,每组9只。各番茄红素组分别ig给予番茄红素,每天1次,连续8周。正常对照和模型对照组均ig给予等体积色拉油。
1.4 标本收集
给药第8周末,大鼠禁食12 h,用10%水合氯醛3 ml·kg-1麻醉,称体质量后固定。每只大鼠腹主动脉采血约4 ml,1301×g离心10 min,分离血清和血浆,-20℃保存待测。每只大鼠取血后,取左侧肾称取肾质量后置10%甲醛溶液中固定,用于病理形态检测。右侧肾迅速置液氮冻存,然后转入-80℃超低温冰箱保存,以备RNA抽提、Western印迹法测定和AngⅡ含量测定。肾指数计算公式=肾质量(g)/体质量(g)×100。
1.5 血液指标检测
日立7600型全自动生化分析仪测定血清中血肌酐(serum creatinine,Scr)和尿素氮(blood urea nitrogen,BUN)的含量。放免法检测血浆中Ins和AngⅡ的含量。肾组织匀浆总蛋白含量的测定采用BCA法,AngⅡ的含量用AngⅡ与总蛋白的相对量表示。取尾尖血用罗氏血糖仪测定空腹血糖(fasting blood glucose,FBG)含量。所有操作均严格按照试剂盒说明书进行。
1.6 24 h尿蛋白定量检测
每只大鼠分别放入大鼠代谢笼中收集24 h尿液,收集尿液前18 h禁食,正常饮水,记录总尿量后用全自动生化分析仪测定24 h尿蛋白(urinary protein,UP)含量。
1.7 肾组织病理形态检测
肾组织用10%甲醛溶液固定,常规石蜡包埋切片,分别进行HE和PAS染色,光镜下观察肾组织病理形态的改变。
1.8 RT-PCR检测肾组织ACE和ACE2 mRNA表达
采用Trizol法提取肾组织总RNA,测定RNA浓度与纯度后逆转录成cDNA,-20℃保存备用。以适量逆转录所得的cDNA为模板,在Taq DNA聚合酶催化下进行PCR扩增反应。引物设计参照GenBank的cDNA序列,采用Primer Premier 5.0软件,引物序列和扩增产物长度见表1。反应条件为:95℃预变性5 min,95℃ 变性 30 s,56℃ 退火 30 s(ACE2 为60℃),72℃延伸1 min,循环 35次,最后 72℃延伸10 min。PCR产物经1.5%琼脂糖凝胶电泳、凝胶成像并定量扫描,用Gel-Pro Analyzer分析软件进行图像分析,目的基因mRNA的相对表达水平以目的基因条带与β肌动蛋白条带的积分吸光度(integratedabsorbance,IA)比值表示。
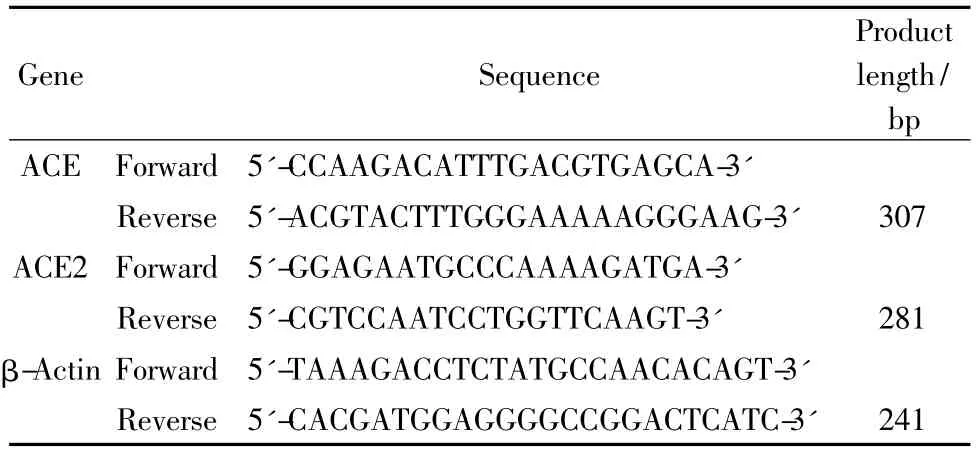
Tab.1 Primer sequences of rat angiotensin converting enzyme(ACE),ACE2 and β-actin
1.9 Western印迹法检测肾组织ACE2蛋白表达
制备10%肾组织匀浆,离心提取蛋白上清液。用BCA法测定蛋白含量后将蛋白浓度调成一致,加上样缓冲液于100℃变性5 min,于10%聚丙烯酰胺凝胶上电泳分离蛋白后转至硝酸纤维膜上。用5%脱脂奶粉室温封闭2 h,一抗4℃孵育过夜,二抗室温孵育1 h后显影成像分析。一抗为1∶500兔抗大鼠ACE2抗体,内参一抗为1∶3000兔抗大鼠GAPDH抗体,二抗为1∶5000羊抗兔IgG抗体。ACE2表达水平用ACE2蛋白条带与 GAPDH条带 IA比值表示。
1.10 统计学分析
2 结果
2.1 番茄红素对糖尿病模型大鼠体质量、肾质量和肾指数的影响
由表2可见,与正常对照组相比,模型对照组及番茄红素组大鼠体质量均明显降低,肾质量无明显变化,番茄红素组肾指数显著升高(P<0.01)。只有番茄红素20 mg·kg-1组大鼠肾指数显著低于模型对照组(P<0.05),但仍未恢复至正常对照组水平(P <0.05)。
2.2 番茄红素对糖尿病性肾病大鼠空腹血糖和胰岛素含量的影响
由表3可见,与正常对照组相比,模型对照组FBG和Ins含量明显升高(P<0.01)。与模型对照组相比,番茄红素治疗组FBG和Ins含量均无显著性差异,表明番茄红素对糖代谢和Ins无明显影响。
2.3 番茄红素对糖尿病模型大鼠血肌酐、尿素氮、血管紧张素Ⅱ和24 h尿蛋白含量的影响
由表3可见,与正常对照组相比,模型对照组Scr,BUN,血浆及肾组织AngⅡ和24 h UP含量均显著升高(P <0.01);番茄红素10 和20 mg·kg-1能明显降低糖尿病大鼠 Scr,BUN,血浆及肾组织AngⅡ和24 h UP水平(P<0.05),但都未恢复至正常对照组水平(P<0.05)。
2.4 番茄红素对糖尿病模型大鼠肾组织形态的影响
由图1和图2可见,正常对照组大鼠肾小球结构清晰,形态规则,肾小球毛细血管基底膜、系膜和基质未见明显异常改变,肾小管结构清晰(图1A,图2A)。模型对照组大鼠肾小管空泡样变,管腔变窄,肾小球体积显著增加,肾小球内基底膜增厚,节段性系膜细胞增生,系膜基质增多,PAS染色阳性物质增多(图1B,图2B)。番茄红素治疗组病变均略有减轻,表现为肾小球体积变小,系膜增生减轻,染色阳性物质相应降低(图1C-D,图2C-D),且番茄红素20 mg·kg-1组作用较明显(图1E,图2E)。

Tab.2 Effect of lycopene on body mass,kidney mass and kidney index of diabetic model rats
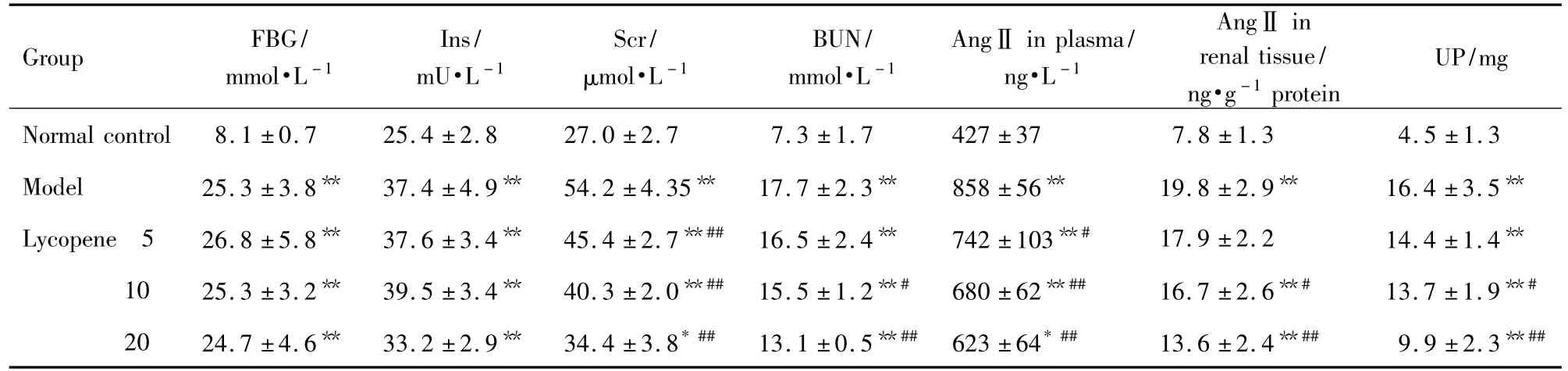
Tab.3 Effect of lycopene on level of fasting blood glucose(FBG),insulin(Ins),serum creatinine(Scr),blood urea nitrogen(BUN),angiotensinⅡ(AngⅡ)and urinary protein(UP)of diabetic model rats
2.5 番茄红素对糖尿病模型大鼠肾组织ACE和ACE2 mRNA表达的影响
由图3可见,与正常对照组比较,模型对照组肾组织ACE和ACE2 mRNA表达水平降低(P<0.01)。与模型对照组相比,番茄红素5,10和20 mg·kg-1治疗组ACE2 mRNA的表达水平均显著升高(P<0.05,P <0.01),其中20 mg·kg-1作用更加明显,接近正常对照组。番茄红素5,10和20 mg·kg-1治疗组ACE mRNA表达水平无明显变化。
2.6 番茄红素对糖尿病模型大鼠肾组织ACE2蛋白表达的影响
由图4可见,与正常对照组相比,模型对照组肾组织ACE2蛋白表达水平显著降低(P<0.01)。与模型对照组相比,番茄红素10和20 mg·kg-1组ACE2蛋白表达水平明显升高(P <0.05,P<0.01),其中番茄红素20 mg·kg-1作用更加明显,接近正常对照组水平。
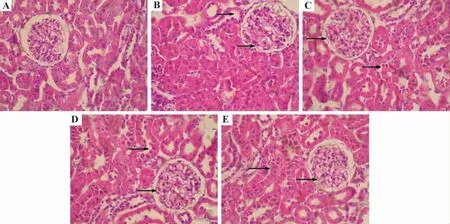
Fig.1 Effect of lycopene on pathological changes in renal tissue of diabetic model rats(HE staining,×400).See Tab.2 for the rat treatments.A:normal group;B:model group(→:glomerular volume increasing and tubule lumen narrowing);C-E:lycopene 5,10,and 20 mg·kg-1groups(→:glomerular volume became smaller and tubule lumen became wider).
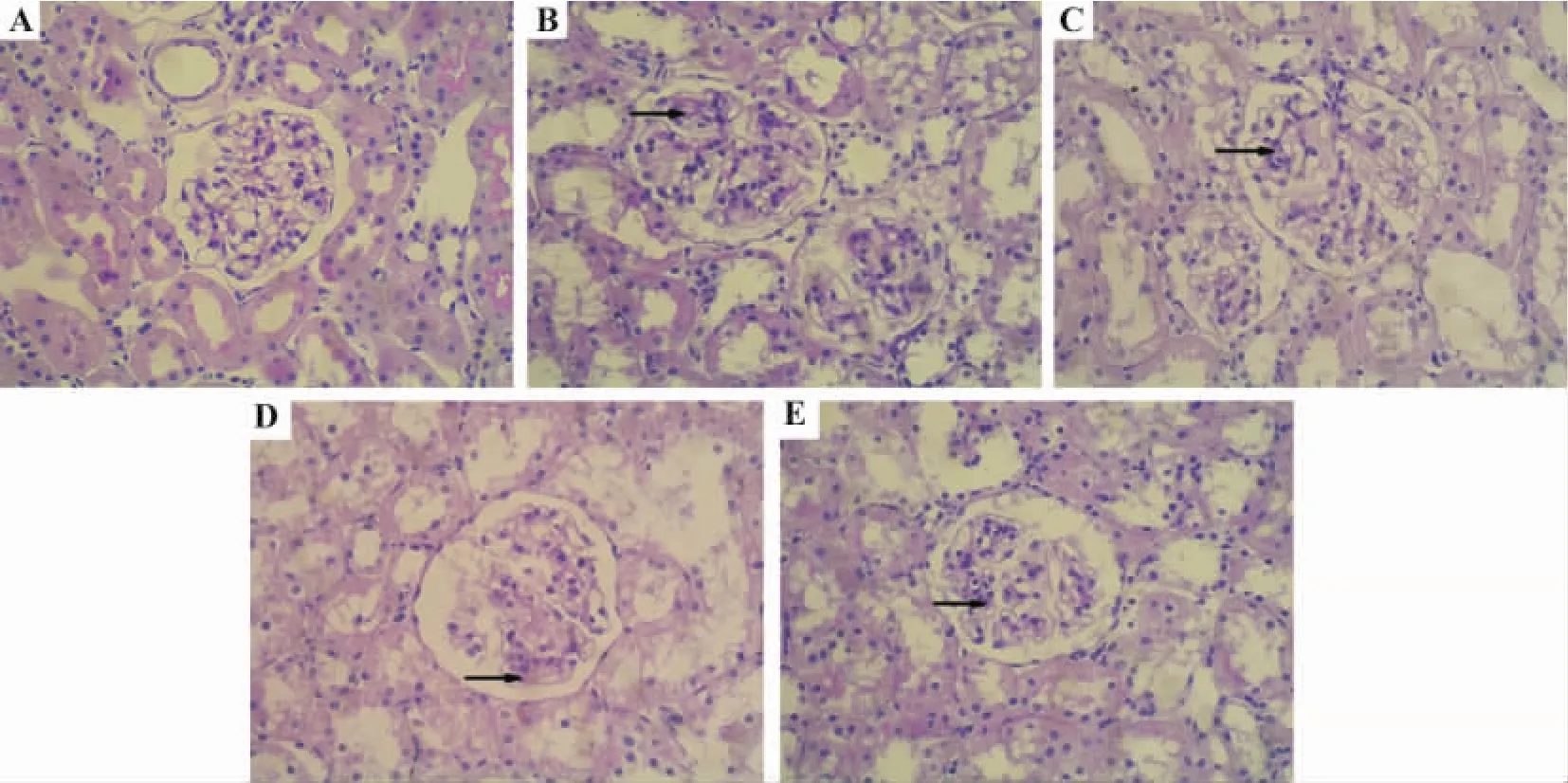
Fig.2 Effect of lycopene on pathological changes in renal tissue of diabetic model rats(PAS staining,×400).See Tab.2 for the rat treatments.A:normal group;B:model group(→:mesangial matrix and PAS positive materials increasing);C-E:lycopene 5,10,and 20 mg·kg-1groups(→:mesangial matrix and PAS positive materials became less).
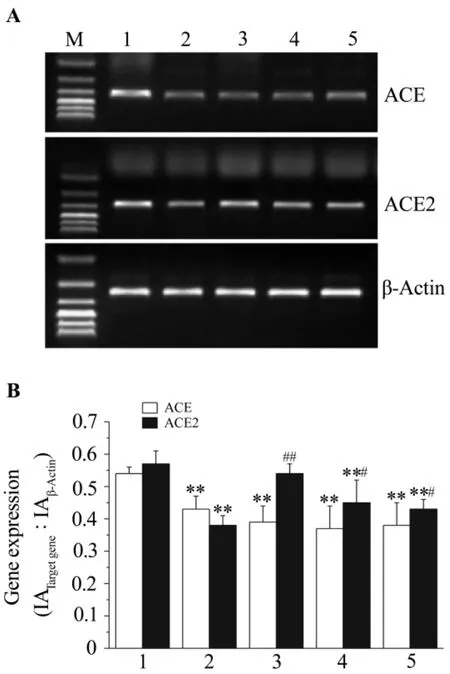
Fig.3 Effect of lycopene on angiotensin converting enzyme(ACE)and ACE2 mRNA expression in renal tissue of diabetic model rats by RT-PCR.See Tab.2 for the rat treatments.B was seniquantitative result of A.IA:integrated absorbance.M:DNA marker.1:normal control group;2:model group;3-5:lycopene 20,10,and 5 mg·kg-1groups,respectively.,n=9-10.**P<0.01,compared with normal control group;#P < 0.05,##P < 0.01,compared with model group.
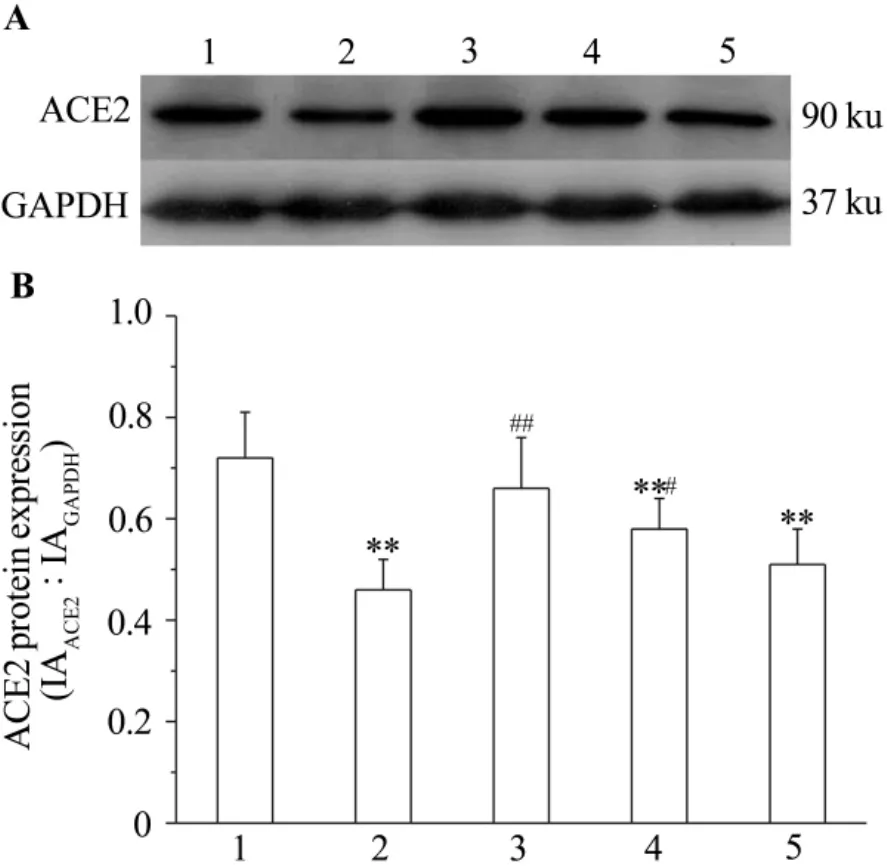
Fig.4 Effect of lycopene on ACE2 protein expression in renal tissue of diabetic model rats by Western blotting.See Tab.2 for the rat treatments.B was the semiquantitative result of A.1:normal control group.2:model group;3-5:lycopene 20,10,and 5 mg·kg-1groups,respectively.,n=9-10.**P<0.01,compared with normal control group;##P <0.01,compared with model group.
3 讨论
RAS主要是由血管紧张素原、肾素、ACE、ACE2、AngⅠ、AngⅡ及其受体以及初级或次级降解产物Ang-(1-7)和Ang-(1-9)等组成的具有多元生物活性的系统,在调节血压、调节水和电解质平衡方面发挥重要作用[4]。目前RAS在DN发病中的作用越来越受到重视,RAS被激活是触发DN的重要致病因素之一[5]。AngⅡ由AngⅠ在ACE的作用下水解而成,作为RAS中发挥主要生理病理作用的组分,是已知最强的缩血管活性物质之一[6]。本研究结果表明,番茄红素治疗后,糖尿病模型大鼠血浆AngⅡ含量明显低于模型对照组,提示番茄红素可降低血浆AngⅡ水平,推测可能与其增强糖尿病大鼠肾脏ACE2表达水平有关。
近年来,ACE2的发现更新了人们对RAS的传统认识[7]。ACE2是新发现的一种羧肽酶,也是第一个被发现的ACE的同源物,主要分布于肾和心脏等器官。ACE2结构与ACE部分相似,但在肾和心血管系统的作用与 ACE相反。在生理情况下,ACE2能减少 AngⅡ的生成,并能催化底物产生Ang-(1-7),而Ang-(1-7)能对抗AngⅡ的作用,具有扩血管、利尿和促尿钠排泄、促进细胞凋亡和抑制细胞增殖等作用[8]。可见,ACE2和ACE作为一对高度同源的蛋白酶,在RAS中起着相互对抗和相互平衡的作用,共同参与调节循环和局部血管舒缩的平衡、维持肾血流量和水盐代谢稳定的过程。目前ACE2在DN进展过程中的作用还在进一步研究之中,倾向于具有保护肾脏的作用。
DN的早期特征主要为高灌注、高滤过和少量蛋白尿,在病理上主要表现为肾小球及肾脏肥大、肾小球基底膜增厚和系膜膨胀等[9]。目前有关蛋白尿产生机制尚不清楚,但是肾小球滤过膜结构和功能改变是蛋白尿产生的重要病理基础,并成为DN持续进展的关键因素[10]。本研究结果表明,糖尿病模型大鼠肾组织出现显著而典型的病理改变,番茄红素治疗后肾组织病理改变减轻,提示番茄红素可以抑制糖尿病模型大鼠肾小球基底膜增厚、系膜细胞增生和系膜基质增多。与模型对照组比较,番茄红素治疗组大鼠Scr,BUN和UP水平明显降低,提示番茄红素能有效地保护肾功能,延缓DN病程的发展。此外,糖尿病模型大鼠肾组织ACE基因表达与正常对照组相比降低,可能与由AngⅠ转换为AngⅡ过程中消耗大量ACE有关,同时AngⅡ生成过多,反馈性地抑制ACE的生成。糖尿病模型大鼠肾组织ACE2表达明显降低,相对于ACE mRNA的降低更为显著,使得AngⅡ转化为Ang-(1-7)的水平降低,缩血管的AngⅡ增加,舒血管的Ang-(1-7)减少[11]。可以推测,肾ACE2的表达降低将导致肾小管局部AngⅡ水平升高[12],并引起肾间质纤维增生等后续效应。因此,ACE2在DN等肾疾病的发展过程中发挥十分重要的作用,ACE2表达的降低有可能是DN形成的另一种发病机制。番茄红素治疗后,糖尿病模型大鼠肾组织ACE2 mRNA和蛋白的表达水平显著升高,提示番茄红素可能通过对ACE2的调节作用,影响了以ACE2为中心的导致DN发病的环节,从而延缓了DN的发生。
总之,番茄红素具有抑制肾肥大、减轻蛋白尿和改善肾功能等作用,其治疗DN的作用机制可能与增加肾组织ACE2的表达有关,具体机制需进一步探索。
[1]Tikellis C,Johnston CI,Forbes JM,Burns WC,Burrell LM,Risvanis J,et al.Characterization of renal angiotensin-converting enzyme 2 in diabetic nephropathy[J].Hypertension,2003,41(3):392-397.
[2]Ye M,Wysocki J,Naaz P,Salabat MR,LaPointe MS,Batlle D.Increased ACE 2 and decreased ACE protein in renal tubules from diabetic mice:a renoprotective combination?[J].Hypertension,2004,43(5):1120-1125.
[3]Pan HZ,Shi G,Chen WH,Wang DC.Effect of lycopene on the function of antioxidative enzyme system in rats[J].J Hyg Res,2003,32(5):441-442.
[4]Carey RM,Siragy HM.Newly recognized components of the renin-angiotensin system:potential roles in cardiovascular and renal regulation[J].Endocr Rev,2003,24(3):261-271.
[5]Chobanian AV,Bakris GL,Black HR,Cushman WC,Green LA,Izzo JL Jr,et al.The seventh report of the Joint National Committee on Prevention, Detection,Evaluation,and Treatment of High Blood Pressure:the JNC 7 report[J].JAMA,2003,289(19):2560-2572.
[6]Xia Q,Luo ZQ,Yao T.Blood circulation[M]//Yao T.Physiology(生理学).6th ed.Beijing:People's Medical Publishing House,2003:123-124.
[7]Donoghue M,Hsieh F,Baronas E,Godbout K,Gosselin M,Stagliano N,et al.A novel angiotensin-converting enzyme-related carboxypeptidase(ACE2)converts angiotensinⅠ to angiotensin 1-9[J].Circ Res,2000,87(5):E1-E9.
[8]Fernandes L,Fortes ZB,Nigro D,Tostes RC,Santos RA,Catelli De Carvalho MH.Potentiation of bradykinin by angiotensin-(1-7)on arterioles of spontaneously hypertensive rats studied in vivo[J].Hypertension,2001,37(2 Part 2):703-709.
[9]Asanuma K,Mundel P.The role of podocytes in glomerular pathobiology[J].Clin Exp Nephrol,2003,7(4):255-259.
[10]Fang F, Wu YG, Dong J,Ren KJ,Qi XM,Liang C,et al.Effects of total glucosides of paeony on oxidative stress in renal tissue of diabetic rats[J].Chin J Pharmacol Toxicol(中国药理学与毒理学杂志),2008,22(3):199-204.
[11]Huang W,Gallois Y,Bouby N,Bruneval P,Heudes D,Belair MF,et al.Genetically increased angiotensinⅠ-converting enzyme level and renal complications in the diabetic mouse[J].Proc Natl Acad Sci USA,2001,98(23):13330-13334.
[12]Bürgelová M,Kramer HJ,Teplan V,Thumová M,Cervenka L.Effects of angiotensin-(1-7)blockade on renal function in rats with enhanced intrarenal AngⅡactivity[J].Kidney Int,2005,67(4):1453-1461.
