反式白藜芦醇联合胡椒碱对慢性应激大鼠的抗抑郁作用及其下丘脑相关机制
2012-07-25赵乐萍林蒙蒙潘建春
赵乐萍,林蒙蒙,邵 拓,潘建春
(1.温州医学院药学院,浙江 温州 325035;2.温州医学院附属乐清医院药剂科,浙江 温州 325600)
白藜芦醇(resveratrol,REV)是一种多酚类化合物,是虎杖的主要化合物,也富含于红葡萄皮及红酒中;为脂溶性物质,易通过血脑屏障,具抗氧化、免疫调节、抗衰老,预防神经退行性疾病等作用,传统中医中用于精神紧张和躁狂-抑郁症等疾病的治疗,因此获得广泛关注[1-4]。胡椒碱(piperine,PIP)是“香料之王”胡椒的主要活性化学物质,具抗氧化和免疫调节等作用,对慢性应激诱导的下丘脑-垂体-肾上腺轴(hypothalamic-pituitary-adrenal axis,HPA 轴)功能失调也有一定的调节作用。同时PIP是一种生物活性增强剂,与多酚类化合物合用时可明显提高多酚类化合物的生物利用度,使低剂量的多酚类化合物表现出较强的药理活性[5]。前期研究显示,REV具抗抑郁作用,其机制涉及5-羟色胺(5-hydroxytryptamine,5-HT)系统[6];有研究指出PIP具有较强的抗抑郁活性,其机制可能与脑单胺氧化酶(monoamine oxidase,MAO)活性有关[7]。此外,胡园等[8]认为,PIP 抗抑郁作用可能与其对HPA轴的影响有关。
慢性应激模型可模拟环境诱因,使动物出现与抑郁症患者相似的行为及生理学改变,是近年应用最广泛的抑郁动物模型之一[9]。开野实验及穿梭箱实验是较经典的抑郁行为学模型,常用于检验和筛选抗抑郁药物。此外,动物穿梭箱实验中的行为缺失与HPA轴功能障碍相关[10]。
当机体长期处于应激状态,HPA轴功能持续亢进,其负反馈调节功能被抑制,机体就会出现抑郁症状。单胺递质神经系统,尤其是5-HT系统,是临床抗抑郁药物的主要作用机制。5-HT等递质减少时,下丘脑促肾上腺皮质释放因子的释放减少,HPA轴功能降低,容易出现抑郁、自杀、各种慢性疼痛、强迫行为和焦虑惊恐发作等;而HPA轴亢进时,可促使皮质醇升高能诱导肝产生色氨酸吡咯化酶,降解血液中的色氨酸。色氨酸是5-HT的前体,其降低可导致5-HT合成不足[11-12],从而引起抑郁症及其相关症状。此外,皮质类固醇可通过影响糖皮质激素受体和盐皮质激素受体的比例来调节5-HT的功能[13]。
本研究首先比较了反式REV单用及与低剂量PIP 2.5 mg·kg-1合用在慢性应激大鼠穿梭箱实验中的药理学作用。然后采用开野实验及穿梭箱实验观察REV合用PIP后的抗抑郁作用,神经化学分析法检测下丘脑中单胺类物质水平及MAO活性,检测血清皮质酮含量,探讨反式REV与PIP合用的抗慢性抑郁作用机制是否涉及HPA轴。
1 材料与方法
1.1 药品和试剂
反式 REV、PIP、氟西汀(fluoxetine,FLU)、二氢溴犬脲胺(kynuramine dihydrobromide)、4-氢喹啉(4-hydroquinoline)、司立吉林(selegiline;MAO-B抑制剂)、氯吉林(clorgiline;MAO-A 抑制剂)、5-HT、去甲肾上腺素 (norepinephrine,NE)、多巴胺(dopamine,DA)、5-羟 吲 哚 乙 酸 (5-hydroxyindoleacetic acid,5-HIAA)和二羟苯乙酸(dihydroxy-phenyl acetic acid,DOPAC)均购自美国Sigma公司。吗氯贝胺(moclobemide,MAO-A特异性抑制剂)和羧甲纤维素钠(carboxymethyl cellulose sodium)由中国药品生物制品检定所。皮质酮试剂盒购自R&D公司。反式REV和PIP溶于0.5%羧甲纤维素钠。吗氯贝胺和氟西汀溶于双蒸水。预实验中,0.5%羧甲纤维素钠和双蒸水对大鼠行为学结果的影响没有明显差异。因此,正式实验选择0.5%羧甲纤维素钠作为空白对照。
1.2 实验仪器
WH-966漩涡混合器,太仓市科教器材厂;动物行为学分析系统,上海吉量软件科技有限公司;BS-11OS型电子分析天平,北京赛多利斯天平有限公司;DY89-Ⅱ型电动玻璃匀浆机,宁波新芝生物科技股份有限公司;JY92-2D超声波细胞粉碎机,宁波新芝生物科技股份有限公司;64R超速冷冻离心机,Beckman Coulter公司;超低温保存箱,海尔公司;970CRT型荧光分光光度计:美国PerkinElmer公司;Bio-Rad 680酶标仪,美国伯乐公司;Agilent 1100高效液相仪,美国Agilent公司;ANTEC电化学检测器,荷兰安泰克公司;Anke 80-2C台式离心机,上海安亭科学仪器厂。
1.3 动物分组和慢性应激模型的制备[14]
雄性SD大鼠,二级,体质量200~250 g,购自温州医学院实验动物中心〔SYXK(浙2010-0150)〕,室温21℃ ~23℃,湿度40% ~60%,自然光照,自由摄食饮水。所有大鼠先于饲养环境中适应5 d。大鼠随机分组,每组8只:即正常对照组,模型组,REV 5,10,20,40,80 mg·kg-1(ig)组,PIP 2.5 mg·kg-1(ip)+反式 REV 2.5,5,10,20,40 mg·kg-1(ig)组,FLU 10 mg·kg-1(ig)组和吗氯贝胺 20 mg·kg-1(ig)组。吗氯贝胺组用于MAO活性的测定,除正常对照组和吗氯贝胺组外,其余各组大鼠均进行造模,即每天给予大鼠1~2种应激,包括禁食24 h,禁水24 h,室温强迫游泳15 min,过夜光照(36 h),倾斜45°,换笼孤养24 h,束缚6 h等。造模期间按照分组给予相应药物,正常对照组和模型组给予0.5%羧甲纤维素钠,连续21 d。第22天进行行为学检测(开野和穿梭实验),检测前禁食12~16 h,饮水自由。行为学结束后处死大鼠,取全血5~10 ml,室温放置20 min后1000×g离心10 min,取血清,-20℃冻存备用;分离大鼠肾上腺,称重并计算肾上腺指数,即肾上腺与大鼠体质量的比值(mg·kg-1);分离大鼠下丘脑,称重并置-80℃冰箱中保存备用。
1.4 大鼠开野实验[15]
正方形开野实验箱为80 cm×80 cm×75 cm,底板用笔画成10 cm×10 cm的方格,其正上方距离底板90 cm高处有一60 W白炽灯泡。测试时将大鼠置于开野箱中央,适应5 min,随后观察10 min内大鼠爬格次数、探究次数(两前肢离地1 cm以上的次数)、理毛次数和粪便粒数。
1.5 穿梭箱实验记录逃避失败次数[16]
将大鼠置于穿梭箱的一端,适应测试环境3 min。然后进行30次回避实验:每次实验前4 s均出现噪声及光照信号,若此期间无回避反应发生,大鼠将受到0.8 mA足部电击;若电击4 s后仍然无逃避反应发生,则电击和光照信号将终止。记录大鼠在整个实验中逃避失败次数,即电击出现4 s期间大鼠未到达另一端箱子的次数。逃避失败次数抑制率(%)=(模型组逃避失败次数-药物组逃避失败次数)/模型组逃避失败次数×100%,并采用Logit法计算ED50。
1.6 高效液相电化学法(HPLC-ECD)测定大鼠下丘脑单胺递质水平[17]
每100 mg脑组织中加入200 μl冰冷 A液(HClO40.4 mol·L-1),冰浴中超声匀浆,4℃ 避光静置60 min,离心20 min(4500 × g,4℃),取上清液,加入半量体积的B液(柠檬酸钾0.2 mol·L-1,K2HPO40.3 mol·L-1和 EDTA 0.2 mol·L-1),涡漩混匀 10 min,4℃避光静置60 min,再次离心(4500 ×g,4℃),取上清液过滤,HPLC-ECD测定其单胺递质水平。取20 μl自动进样,色谱柱为Diamonsilim C18(长150 mm×内径4.6 mm,粒度5 μm),流动相组成:枸橼酸-柠檬酸钠缓冲液125 mmol·L-1(pH=4.3),EDTA 0.1 mmol·L-1,辛烷基磺酸钠 1.2 mmol·L-1,16% 甲醇。流速:1.0 ml·min-1。检测器工作电压分别为:50,100,200,300,400和500 mV。单胺及其代谢产物的含量以ng·g-1湿组织表示。
1.7 荧光分光光度法测定大鼠下丘脑单胺氧化酶活性
根据小鼠的检测方法[18]进行适度改良。分离出的脑组织称重后加入冰冷磷酸缓冲液(pH=7.8,0.05 mol·L-1)2 ml制成匀浆液。然后在 2.5 ml磷酸缓冲液中加入0.4 ml 20%Triton和0.2 ml组织匀浆液,混匀后预孵育(37℃,10 min),加入 1 μmol·L-1的司立吉林(MAO-B抑制剂)或氯吉林(MAO-A抑制剂)抑制相应的 MAO,再加入 30 μl终浓度为22 μmol·L-1的底物,37℃孵育 30 min,反应液中加入0.2 ml高氯酸 5 mol·L-1溶液终止反应,冷却并离心(1500 × g,10 min),取上清液0.5 ml,加入2.5 ml氢氧化钠 1 mol·L-1。通过荧光分光光度计在激发光318 nm,发射光380 nm处测定产物4-氢喹啉的荧光强度。MAO活性以nmol·g-1蛋白表示。采用Bradford法测定蛋白含量。该实验中用MAO-A特异性抑制剂吗氯贝胺做为检测药物对MAO-A抑制功效的阳性对照药。检测当天,吗氯贝胺组大鼠ig给予吗氯贝胺20 mg·kg-1,并在1 h后处死大鼠取下丘脑,检测MAO活性。
1.8 双抗体夹心ELISA法检测血清皮质酮水平
依照试剂盒说明书操作,即先将已知浓度的标准品用样品稀释液倍比稀释,制备标准曲线。然后将标准品与血清样品加入包被有抗大鼠皮质酮单抗的酶标板上,每孔 100 μl,混匀,37℃孵育 2 h,使标准品与血清样品中的皮质酮与抗体充分结合;去液并甩干,加入生物素化的抗大鼠皮质酮抗体,每孔100 μl,混匀,37℃孵育 1 h,形成连接与板上的免疫复合物;去液并甩干,洗板3次,甩干,再加入辣根过氧化物酶标记的抗生链亲和素(streptavidin),每孔100 μl,混匀,37℃孵育 1 h;去液并甩干,洗板 5 次,甩干,然后每孔加入酶底物90 μl,37℃避光显色至标准孔出现明显梯度蓝色(15~30 min),每孔加50 μl硫酸 2 mol·L-1终止,颜色由蓝色变为黄色,在450 nm处测吸光度(A)值,皮质酮浓度与A值成正比,通过绘制标准曲线求出标本中皮质酮浓度。
1.9 统计学分析
2 结果
2.1 反式白藜芦醇及与胡椒碱联用对应激大鼠在开野实验中行为表现的影响
开野实验结果表明,与正常组相比,模型组的爬格数(图1A)和探究活动次数(图1B)显著降低,理毛次数(图1C)及粪便粒数(图1D)增加。给予PIP 2.5 mg·kg-1+反式REV 20 和40 mg·kg-1组爬格数和探究活动次数增加,理毛次数及粪便粒数降低,与FLU 10 mg·kg-1作用效果相当。
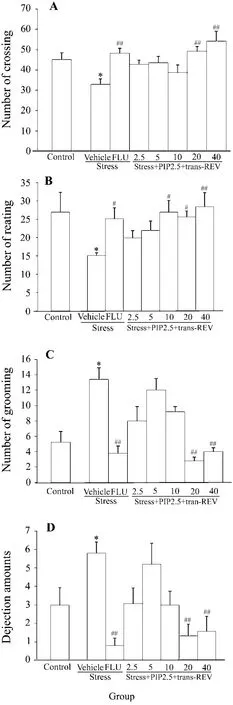
Fig.1 Effect of trans-resveratrol(trans-REV)combined with piperine on stressed rats in the open field test.Rats were exposed to the various stresses for 21 d except the ones in the normal control group,and all of the rats were provided with drugs once a day for 21 d.REV 2.5-40 mg·kg-1(ig)and piperine 2.5 mg·kg-1(ip)were given in combination.Fluoxetine(FLU)10 mg·kg-1was given ip.And on the 22nd day,rats were exposed to the open field test.The number of crossing,rearing,grooming and dejection amounts were recorded.,n=8.*P<0.05,compared with normal control group;#P<0.05,##P <0.01,compared with model group.
2.2 反式白藜芦醇单用及合用胡椒碱后在穿梭箱实验中的ED50值
在穿梭箱实验中,单独ig给予反式REV 5,10,20,40 和 80 mg·kg-1的抑制率分别为 8.1%,18.0%,25.7%,33.2% 和 38.7%,ED50为192.0 mg·kg-1,而 反 式 REV 2.5,5,10,20 和40 mg·kg-1与 PIP 2.5 mg·kg-1联合给药后的抑制率分别为11.7%,21.8%,28.8%,36.6% 和48.6%,ED50降低到49.1 mg·kg-1(见表 1)。
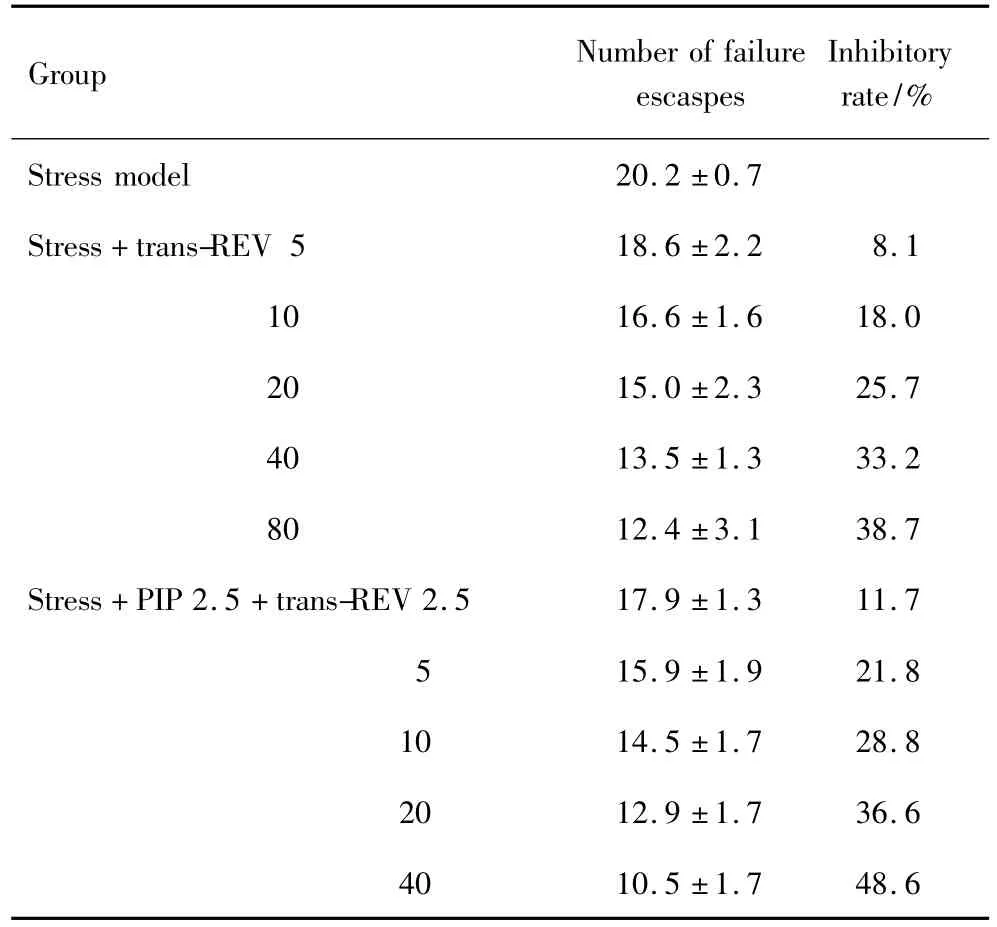
Tab.1 ED50value of trans-REV alone and its combination with piperine(PIP)on stressed rats in shuttle-box test
2.3 反式白藜芦醇与胡椒碱联用对应激大鼠在穿梭箱实验中逃避失败次数的影响
图2结果显示,与正常对照组相比,模型组大鼠的逃跑失败次数显著增加,分别给予PIP 2.5 mg·kg-1+反式REV 10,20和40 mg·kg-1后可显著降低逃避失败次数,作用类似于经典抗抑郁药FLU。
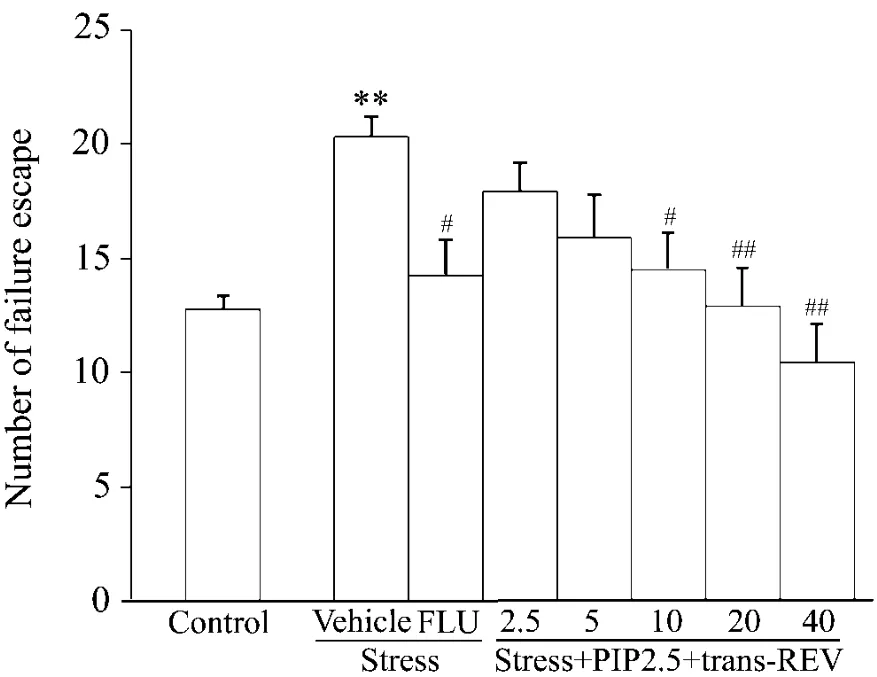
Fig.2 Effect of trans-REV combined with piperine on number of failure escape of stressed rats.See Fig.1 for the treatments.And on the 22th day,rats were exposed to the shuttle-box test,and the number of failure escape was recorded.,n=8.**P<0.01,compared with the normal control group;#P <0.05,##P <0.01,compared with model group.
2.4 反式白藜芦醇与胡椒碱联用对应激大鼠下丘脑单胺递质及其代谢产物含量的影响
如表2中显示,与正常对照组相比,模型组大鼠下丘脑中5-HT水平显著降低,5-HIAA/5-HT水平相对提高,给予 PIP 2.5 mg·kg-1+反式 REV 40 mg·kg-1后,5-HT 水平增加,而 5-HIAA/5-HT 水平则下降。其作用与FLU相当。各组多巴胺及其代谢产物二羟苯乙酸的水平均无显著差异。
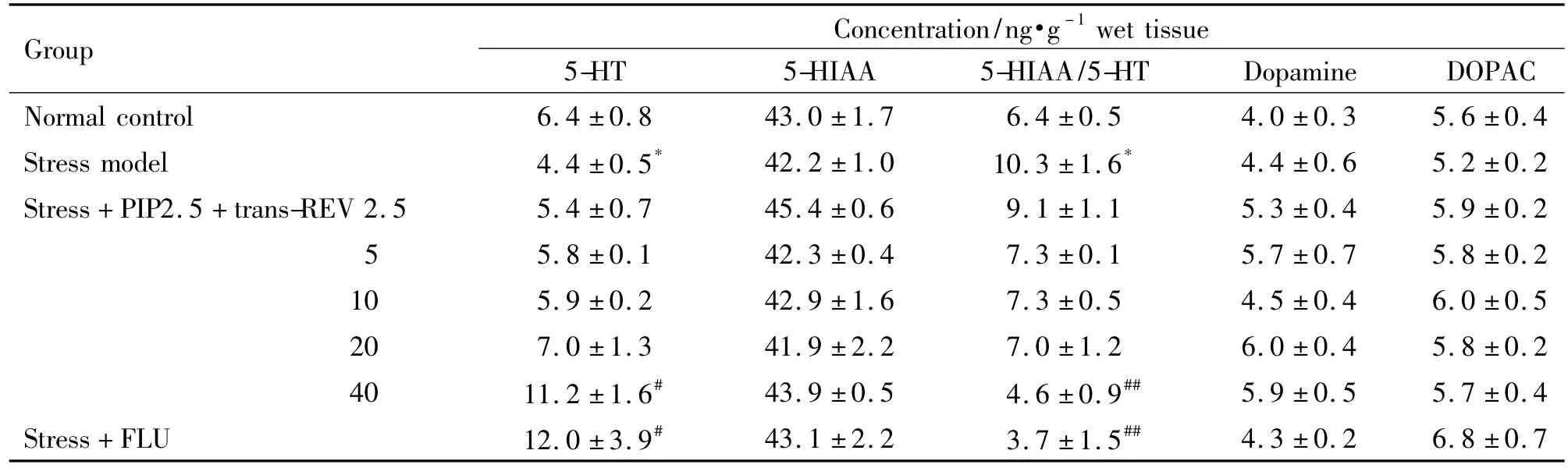
Tab.2 Effect of trans-REV combined with piperine on concentrations of monoamines and their metabolites in hypothalamus of stressed rats
2.5 反式白藜芦醇与胡椒碱联用对应激大鼠下丘脑单胺氧化酶活性的影响
与模型组比较,给予反式 REV 40 mg·kg-1+PIP 2.5 mg·kg-1,大鼠下丘脑中 MAO-A 和 MAO-B活性被明显抑制(表3)。MAO-A特异性抑制剂吗氯贝胺 20 mg·kg-1显著抑制 MAO-A的活性,对MAO-B的活性无影响。而经典抗抑郁药FLU对MAO活性无明显影响。
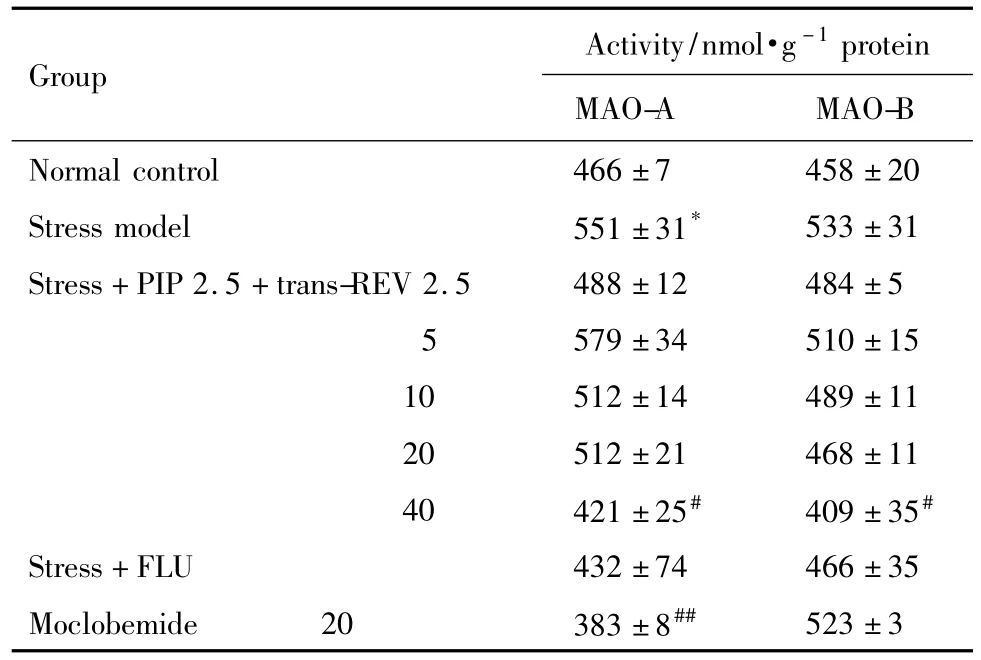
Tab.3 Effect of trans-REV combined with piperine on monoamine oxidase(MAO)activities in hypothalamus of stressed rats
2.6 白藜芦醇与胡椒碱联用对应激大鼠肾上腺的影响
如表4所示,与正常大鼠相比,大鼠在经历21 d慢性应激后,肾上腺指数明显提高,联合给予PIP和反式REV可以显著逆转这个趋势,尤其以反式REV20 和40 mg·kg-1组显著(P <0.01),效果类阳性对照药FLU。
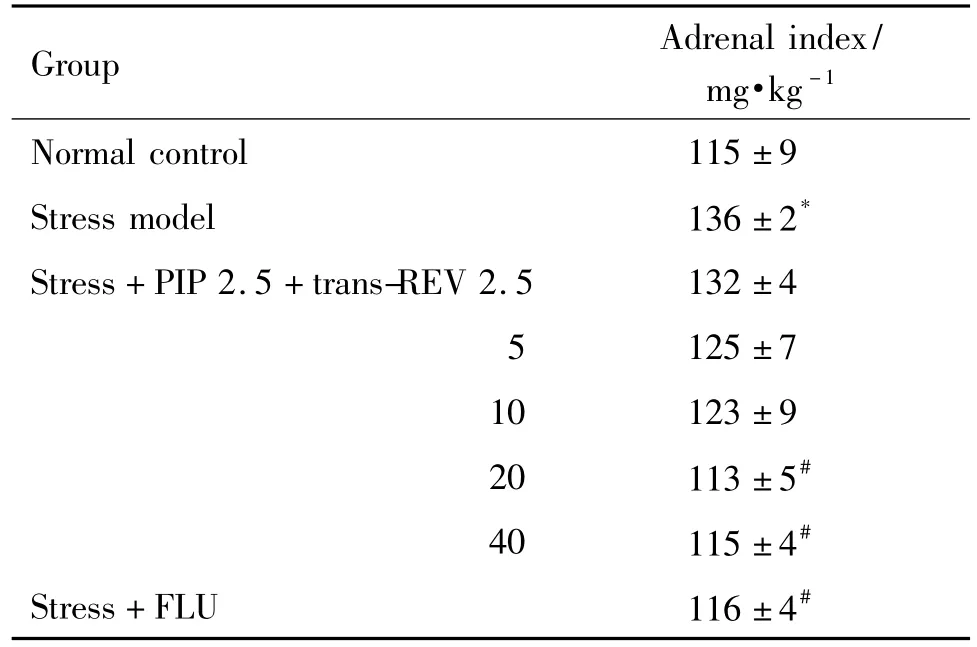
Tab.4 Effect of trans-REV combined with piperine on adrenal gland index in stressed rats
2.7 反式白藜芦醇与胡椒碱联用对应激大鼠血清皮质酮含量的影响
如表5所示,模型组大鼠的血清皮质酮含量明显高于正常对照组,而联合给予反式REV和PIP可以降低皮质酮含量,REV 10,20和40 mg·kg-1组差异显著(P<0.05)。与模型组相比,阳性对照药FLU也可显著降低大鼠血清皮质酮含量(P<0.01)。
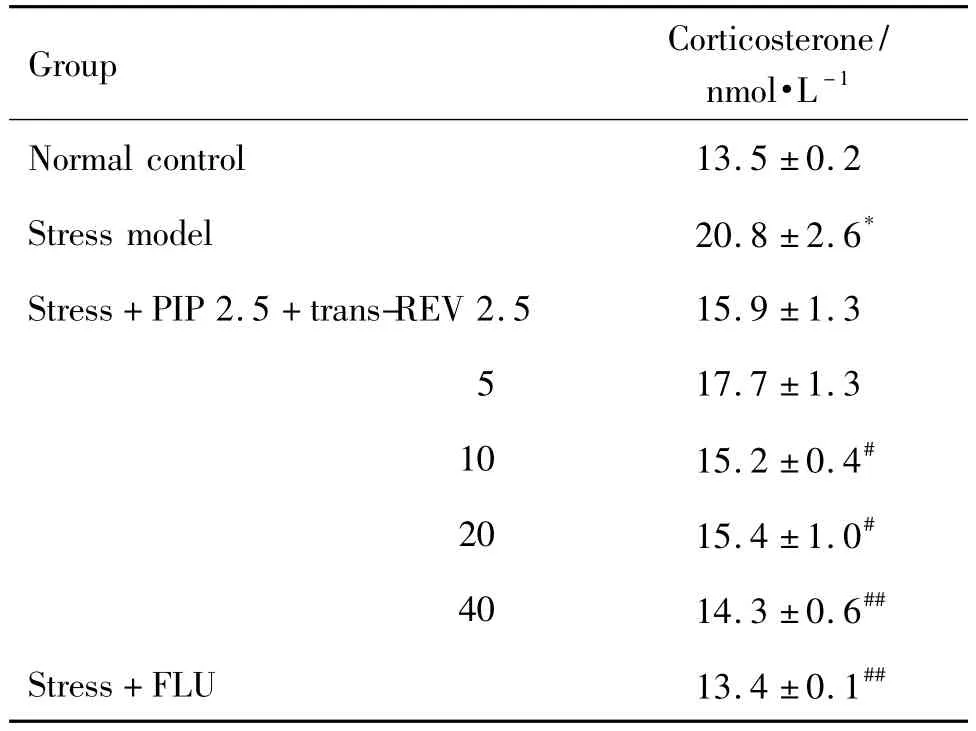
Tab.5 Effect of trans-REV combined with piperine on blood serum corticosterone level in stressed rats
3 讨论
本实验结果显示,反式REV和PIP联用后的ED50值显著下降,从192.0mg·kg-1降到49.1 mg·kg-1,说明 PIP 2.5 mg·kg-1可以提高反式REV的药理学活性,这可能与PIP抑制肝药酶活性的作用相关。因而本研究进一步探讨反式REV与PIP 2.5 mg·kg-1合用的抗抑郁功效及其可能作用机制。
本研究结果显示,大鼠经21 d慢性不可预知性应激后,在开野实验中的爬格数和探究次数明显降低,理毛次数及粪便粒数显著增加;穿梭箱实验中的主动逃避电击失败次数增加。说明慢性应激使大鼠食欲减退、活动能力下降、紧张程度增加、兴趣丧失、认知和记忆能力减退,这些表现与抑郁症患者表现出的精神运动性抑制、兴趣改变等具有相似性。给予PIP+反式REV 20和40 mg·kg-1可改善应激引起的大鼠在开野实验和穿梭实验中的行为改变,证明了反式REV合用PIP可能具有抗抑郁样作用。
下丘脑被认为是情绪的躯体反应和内脏反应的整合部位,具有直接或间接影响情绪表达的功能,调节愉快反应和快感行为,其功能障碍与抑郁症患者快感缺失、动力下降相关[19]。
5-HT是一种重要的中枢神经递质,参与多种行为、情绪活动的调节,在抑郁症的病因以及抗抑郁药物的机制研究中至关重要。增强5-HT的神经传递是抗抑郁药治疗不同类型抑郁症的共同机制。本研究结果显示,PIP+反式REV 40 mg·kg-1显著逆转应激引起的下丘脑中5-HT水平的下降及5-HT转换率5-HIAA/5-HT水平的提高。MAO-A主要氧化降解去甲肾上腺素和5-HT;而MAO-B主要氧化降解多巴胺和儿茶酚胺等;MAO特异性抑制剂可用于一些神经精神疾病的治疗,如抑郁症等。结果显示,反式REV在剂量为40 mg·kg-1时可抑制MAO活性,其药理功效类似MAO-A特异性抑制剂吗氯贝胺。吗氯贝胺可抑制MAO-A活性,使5-HT含量增加,5-HT转换率呈下降趋势。因此,REV合用PIP可能通过抑制MAO活性,尤其是抑制MAO-A活性,提高下丘脑中5-HT水平而发挥作用。这与已有报道指出的反式REV[6]和PIP[7]具有MAO活性抑制作用而发挥抗抑郁作用一致。
穿梭箱实验中的行为缺失与HPA功能障碍紧密相关[10],本研究中反式REV和低剂量PIP合用显著改善应激大鼠在穿梭箱实验中的行为缺失,促使我们进一步探讨其抗抑郁作用是否涉及HPA轴。临床研究表明,抑郁症患者的HPA轴功能亢进;抑郁症患者的唾液、血浆及尿液等代谢产物中皮质酮水平增高,失去夜间自发性分泌抑制的节律;垂体和肾上腺的体积增大[20]。而这种功能亢进和抑郁症具有一定的依赖性,随着抑郁的恢复,HPA轴的功能也逐步恢复正常[21]。Rubin等[22]研究发现,抑郁症患者的肾上腺皮质增生约38%,增生的程度与皮质醇有关;随着抑郁症状的缓解,这种增生也似乎随着皮质醇的正常化而逐步消失,这与HPA轴的慢性或持续活跃有关[23]。也有报道指出不管是临床抑郁症患者还是慢性应激大鼠,都表现出HPA轴负反馈功能抑制[24-25],并且这种HPA轴功能异常以血清皮质酮升高和肾上腺增生为特征[26]。本研究结果显示,大鼠经21 d慢性综合性应激后,肾上腺指数上升,说明慢性应激对HPA轴活动产生影响并致使肾上腺皮质出现增生;此外,本研究中慢性应激引起的HPA轴亢进,还表现为血清皮质酮水平的显著增加,而反式REV合用PIP可显著逆转这些现象。因此,推测本研究中大鼠肾上腺的增生与大鼠血清皮质酮含量增加紧密相关,且均由慢性应激引起的HPA轴失调导致。
HPA轴与5-HT系统间存在着广泛的相互作用。5-HT等递质减少时,下丘脑促肾上腺皮质释放因子的释放减少,HPA轴功能降低;HPA轴亢进时,则促使皮质醇升高而诱导肝产生色氨酸吡咯化酶,降解血液中的色氨酸而导致5-HT合成不足[11-12],从而引起抑郁症及其相关症状。此外,HPA轴系统紊乱导致的皮质激素水平升高,可以通过海马中糖皮质激素受体调节缝核-海马系统5-HT神经元活性,引起5-HT传导系统,尤其是5-HT1A受体传导功能受损,而5-HT1A受体与抑郁症密切相关。徐英等[27]指出,姜黄素的抗抑郁作用很可能与增加海马中糖皮质激素受体和5-HT1A受体的表达,维持应激状态下HPA轴的稳定有关。单胺神经递质水平降低是抑郁发生机制中的第一步,也是抑郁症首先导致的结果之一;HPA轴功能异常是应激及情感障碍性疾病导致整个中枢神经系统功能紊乱的生理基础。单胺递质水平的降低与HPA轴功能异常可相互影响而进一步加重单胺递质的减少和HPA轴负反馈障碍,最终导致严重抑郁症[28]。
综上所述,反式 REV 和 PIP 2.5 mg·kg-1合用可抑制MAO活性,尤其是MAO-A活性而提高下丘脑中5-HT浓度,降低其转换率,同时改善因应激引起的HPA轴失调而表现的肾上腺增生及血清皮质酮异常升高。因此,推测反式REV合用PIP在慢性不可预知性应激抑郁模型中的抗抑郁样作用涉及调节下丘脑中的5-HT递质系统和HPA轴功能,但其确切的作用靶点需在生物分子及基因水平上对该信号通路进行检测。此外,本研究中指出,PIP 2.5 mg·kg-1可以提高反式REV的药理学活性,但本研究并没有研究反式REV和PIP合用是否具有协同抗抑郁作用,但不排除两药合用具有协同作用,若要进一步研究反式REV和PIP联合作用的性质需采用等效线法进行检验。
[1]Kumar A,Naidu PS,Seghal N,Padi SS.Neuroprotective effects of resveratrol against intracerebroventricular colchicine-induced cognitive impairment and oxidative stress in rats[J].Pharmacology,2007,79(1):17-26.
[2]Kwon KJ,Kim HJ,Shin CY,Han SH.Melatonin potentiates the neuroprotective properties of resveratrol against beta-amyloid-induced neurodegeneration by modulating AMP-activated protein kinase pathways[J].J Clin Neurol,2010,6(3):127-137.
[3]Ranney A,Petro MS.Resveratrol protects spatial learn-ing in middle-aged C57BL/6 mice from effects of ethanol[J].Behav Pharmacol,2009,20(4):330-336.
[4]Vanamala J,Reddivari L,Radhakrishnan S,Tarver C.Resveratrol suppresses IGF-1 induced human colon cancer cell proliferation and elevates apoptosis via suppression of IGF-1R/Wnt and activation of p53 signaling pathways[J].BMC Cancer,2010,10:238.
[5]Bhutani MK,Bishnoi M,Kulkarni SK.Anti-depressant like effect of curcumin and its combination with piperine in unpredictable chronic stress-induced behavioral,biochemical and neurochemical changes[J].Pharmacol Biochem Behav,2009,92(1):39-43.
[6]Xu Y,Wang Z,You W,Zhang X,Li S,Barish PA,et al.Antidepressant-like effect of trans-resveratrol:Involvement of serotonin and noradrenaline system[J].Eur Neuropsychopharmacol,2010,20(6):405-413.
[7]Lee SA,Hong SS,Han XH,Hwang JS,Oh GJ,Lee KS,et al.Piperine from the fruits of Piper longum with inhibitory effect on monoamine oxidase and antidepressant-like activity[J].Chem Pharm Bull(Tokyo),2005,53(7):832-835.
[8]Hu Y,Liao HB,Liu P,Guo DH,Wang YY.Antidepressant effects of piperine and its neuroprotective mechanism in rats[J].J Chin Integra Med(中西医结合学报),2009,7(7):667-670.
[9]Yu ZF,Kong LD, Chen Y. Antidepressant activity of aqueous extracts of Curcuma longa in mice[J].J Ethnopharmacol,2002,83(1-2):161-165.
[10]Eede F V D,Claes SJ.Mechanisms of depression:role of the HPA axis[J].Drug Discov Today,2004,1:413-418.
[11]GrandPré T, Li S, Strittmatter SM.Nogo-66 receptor antagonist peptide promotes axonal regeneration[J].Nature,2002,417(6888):547-551.
[12]Kim JE, Liu BP, Park JH,Strittmatter SM.Nogo-66 receptor prevents raphespinal and rubrospinal axon regeneration and limits functional recovery from spinal cord injury[J].Neuron,2004,44(3):439-451.
[13]Qu Y,Feng ZZ.The effect of hypothalamic pituitary adrenal axis in depression disorder[J].J Reg Anat Oper Surg(局解手术学杂志),2004,13(1):57-60.
[14]Willner P.Validity,reliability and utility of the chronic mild stress model of depression:a 10-year review and evaluation[J].Psychopharmacology(Berl),1997,134(4):319-329.
[15]Kulkarni SK, Dandiya PC. Effects of antidepressant agents on open field behaviour in rats[J].Psychopharmacologia,1973,33(4):333-338.
[16]Murua VS,Gomez RA,Andrea ME,Molina VA.Shuttle-box deficits induced by chronic variable stress:reversal by imipramine administration[J].Pharmacol Biochem Behav,1991,38(1):125-130.
[17]Thiyagarajan M, Sharma SS. Neuroprotective effect of curcumin in middle cerebral artery occlusion induced focal cerebral ischemia in rats[J].Life Sci,2004,74(8):969-985.
[18]Xu Y,Ku BS,Yao HY,Lin YH,Ma X,Zhang YH,et al.Antidepressant effects of curcumin in the forced swim test and olfactory bulbectomy models of depression in rats[J].Pharmacol Biochem Behav,2005,82(1):200-206.
[19]Han XC.Regulatory role of HPA in the chronic stress reaction[J].Med Recapitulate(医学综述),2006,12(2):73-75.
[20]Ulrich-Lai YM,Figueiredo HF,Ostrander MM,Choi DC,Engeland WC,Herman JP.Chronic stress induces adrenal hyperplasia and hypertrophy in a subregion-specific manner[J].Am J Physiol Endocrinol Metab,2006,291(5):E965-E973.
[21]Mathew SJ,Manji HK,Charney DS.Novel drugs and therapeutic targets for severe mood disorders[J].Neuropsychopharmacology,2008,33(9):2080-2092.
[22]Rubin RT,Phillips JJ,McCracken JT,Sadow TF.Adrenal gland volume in major depression:relationship to basal and stimulated pituitary-adrenal cortical axis function[J].Biol Psychiatry,1996,40(2):89-97.
[23]Bashey RI,Martinez-Hernandez A,Jimenez SA.Isolation,characterization,and localization of cardiac collagen typeⅥ.Associations with other extracellular matrix components[J].Circ Res,1992,70(5):1006-1017.
[24]Morley-Fletcher S, Darnaudéry M, Mocaer E,Froger N,Lanfumey L,Laviola G,et al.Chronic treatment with imipramine reverses immobility behaviour,hippocampal corticosteroid receptors and cortical 5-HT1Areceptor mRNA in prenatally stressed rats[J].Neuropharmacology,2004,47(6):841-847.
[25]Tafet GE, Bernardini R. Psychoneuroendocrinological links between chronic stress and depression[J].Prog Neuropsychopharmacol Biol Psychiatry,2003,27(6):893-903.
[26]Mizoguchi K,Yuzurihara M,Ishige A,Sasaki H,Tabira T.Saiko-ka-ryukotsu-borei-to,an herbal medicine,prevents chronic stress-induced disruption of glucocorticoid negative feedback in rats[J].Life Sci,2002,72(1):67-77.
[27]Xu Y,Ku B,Tie L,Yao H,Jiang W,Ma X,et al.Curcumin reverses the effects of chronic stress on behavior,the HPA axis,BDNF expression and phosphorylation of CREB[J].Brain Res,2006,1122(1):56-64.
[28]Quiles JL, Mesa MD, Ramírez-Tortosa CL, Aguilera CM,Battino M,Gil A,et al.Curcuma longa extract supplementation reduces oxidative stress and attenuates aortic fatty streak development in rabbits[J].Arterioscler Thromb Vasc Biol,2002,22(7):1225-1231.
