杉木纤维素合成酶类似蛋白基因ClCslD1 的克隆及其生物信息学分析
2012-07-24彭沙沙童再康黄华宏周厚君林二培
彭沙沙, 童再康, 黄华宏, 周厚君, 时 剑, 林二培
(浙江农林大学 林业与生物技术学院, 浙江 临安311300)
纤维素是植物细胞壁的主要成分, 自然界中大约有1 800 亿t·a-1的纤维素产物产生, 具有较高的经济价值[1]。 研究表明: 纤维素的生物合成是纤维素合成基因、 非纤维素多糖合成基因以及结构蛋白基因等在细胞发育调控下进行协同表达、 相互作用的过程。 纤维素合成酶作为植物纤维素合成途径中的关键酶影响着纤维的产量和品质, 探明纤维素合成酶的作用机制及其在纤维合成过程中的功能, 对于材性品质改良至关重要。 纤维素合成酶类似蛋白作为一种重要的膜蛋白, 与纤维素合成酶具有相似的蛋白结构, 都含有D, D, D, QXXRW 保守区, 与棉花Gossypium hirsutum 纤维素合成酶相比, 最明显的差异在于后者具有额外的特异序列。 在拟南芥Arabidopsis thaliana[2-4], 水稻Oryza sativa[5-6], 烟草Nicotiana alata[7], 美洲山杨Populus tremuloides[8]等多种植物种已发现, 纤维素合成酶类似蛋白基因有A, B, C,D, E, F, G, H 等8 个庞大的基因家族, 也证实了几个类纤维合成酶(Csl)直接参与纤维的生物合成,但对其功能的了解不十分清楚。 本研究选用杉木Cunninghamia lanceolata 为材料来研究纤维素合成酶类似蛋白基因, 克隆了1 个CslD 基因, 并对其进行生物信息学分析, 为该基因的功能研究奠定基础, 同时也为利用CslD 基因对杉木进行遗传改良奠定基础。
1 材料与方法
1.1 试验材料
杉木取自浙江农林大学遗传学科苗圃地(29°56′N, 118°51′E), 取其茎叶作为mRNA 的提取材料。
1.2 试剂
克隆用的大肠埃希菌Escherichia coli 5α 为本研究小组实验室保存; PureLinkTMPlant RNA Reagen 试剂盒(Invitrogion); cDNA 合成试剂盒(Clon Tech); T4 DNA 连接酶和克隆载体pMD-T19 均为TaKaRa 公司生产; AxyPrep DNA 凝胶回收试剂盒(AxyGEN); 引物由南京金思特生物工程技术服务有限公司合成;cDNA 末端快速扩增(RACE)试剂盒为Clone-Tech 产品。
1.3 试验方法
茎叶mRNA 的提取按照PureLinkTMPlant RNA Reagen 试剂盒说明书进行, 并于10.0 g·kg-1琼脂葡萄糖凝胶电泳检测RNA 提取效果(图1)。
从GenBank 数据库中获得纤维素合成酶基因的编码序列, 通过Clustal X2 进行多序列比对, 根据序列保守性, 设计RT-PCR 引物RR: 5′-TGYTAYGTNCARTTYCCWC-3′和RF: 5′-GANCCRTADATCCANCC-3′(Y: C or T; N: A or T or C or G; R: A or G; W: A or T; D: A or G or T)。 比对的基因编码序列:火炬松Pinus radiata 登录号AAQ63936; 颤杨Populus tremuloides 登录号AAO25536.1; 毛果杨Populus trichocarpa 登录号XP_002324291; 马占相思Acacia mangium 登录号AAT66940.1。 cDNA 的合成及聚合酶链式反应(PCR)的扩增均参照试剂盒说明书进行。 凝胶回收PCR 产物, 按照pMD-T19 载体试剂盒操作流程, 将回收的DNA 片段连接到T 载体上, 转化大肠埃希菌DH5α 菌株, 蓝白斑筛选, 阳性克隆送南京金斯特生物工程技术服务有限公司测序。 测序结果经BLAST(basic local alignment search tool)检索序列数据库, 确定所克隆序列为杉木ClCslD1 基因编码序列。 根据反转录-聚合酶链式反应 (RT-PCR)片段的序列测定结果, 合成ClCslD1 特异引物GSP1: 5′-ACACATCCCGTTCCGACATACACAG-3′和GSP2: 5′-CTGGCAGATTCCATTCCCATCGCAG-3′, 分别用于克隆cDNA 的5′和3′端序列。 5′RACE 和3′RACE 具体步骤均按SMATRTMRACE cDNA Amplification Kit (ClonTech)的说明书进行, PCR 产物凝胶回收后经T载体克隆测序, 并与已克隆的CslD1 基因编码区拼接, 从而获得全长cDNA 序列。 以拼接得到的ClCSLD1 全长cDNA 设计引物CslD1-U: 5′-GAGACATTTGAATAACAGGCGTG-3′和CslD1-L: 5′-TTGAAGCTAGTCAGATCCAACCA-3-′, 再经PCR 扩增, 凝胶电泳分析、 测序, 验证所获基因全长的准确性。
用Nucleic Tools 分析推测CslD1 基因编码蛋白质的氨基酸组成, 用ProtParam(http: //www.expasy.org/tools/protparam.html)推测其分子量和等电点(PI), 用ProtScale (http: //ca.expasy.org/tools/protscale.html)推测其疏水性, 用TMHMM(http: //www.cds.dtu.dk/services/TMHMM-2.0/) 对其跨膜区进行预测, 并用SignalP (http: //www.cds.dtu.dk/services/SignalP/)软件对其N 端进行分析, 并进行蛋白质亚细胞定位, 同时用ExPASy 的HNN(http: //www.expasy.org/tools/HNN.html)预测其二级结构进行, 利用蛋白质保守结构域推测工具InterProScan(http: //ebi.ac.uk/Tools./InterProScan/)分析ClCslD1 的结构域。
分析杉木ClCslD1 与其他植物同源蛋白序列的同源性时, 在美国国家生物技术信息中心(NCBI)上用其BLAST (http://www.ncbi.nlm.nig.gov/blast)分别将杉木的ClCslD1 蛋白质序列与其他植物的CslD 蛋白质序列进行同源性比对。 同时用ClustalX2 软件对不同植物的CslD 蛋白质序列与杉木CslD1 蛋白序列进行多重序列比对, 并用MEGA3[9]软件构建不同植物的CslD 基因进化树。
2 结果与分析
2.1 杉木CslD1 基因的分离与分析
用PureLinkTMPlant RNA Reagen 试剂盒提取的RNA(图1), 电泳后28SrRNA 和18SrRNA 两条主带明显, 且28SrRNA 条带亮度约为18srRNA 条带亮度的2 倍。 这说明RNA 基本上没降解, 且无弥散。 同样加样孔附近没有杂带, 说明产物中没有DNA 的存在。
取上述RNA 利用逆转录酶获得cDNAs(图2), 通过RT-PCR, 获得1 个约600 bp 的产物, 连接到T载体且转化DH5α, 挑取阳性克隆测序。 测序结果用NCBI 的BLAST 程序检索数据库, 显示该序列与拟南芥、 烟草、 毛果杨的同源性都达到80%以上, 确定该片段为杉木的ClCslD1 基因片段。 用该序列设计特异引物GSP1 和GSP2, 分别克隆基因cDNA 的5′和3′端序列。 测序结果表明: 5′和3′端序列与获得的ClCslD1 基因编码序列有重叠, 为ClCslD1 的5′和3′端序列。 经拼接得到杉木的ClCslD1 基因完整的cDNA 序列, 共4 150 bp(图3)。
测序结果BLAST 显示: 在核苷酸水平上, 杉木ClCslD1 基因与毛果杨(XM_002325781), 颤杨(AY-162184), 拟南芥(AF232907), 烟草(AF304375)的相似性高达73%, 73%, 72%和70%。 其氨基酸序列的同源性与水稻(DAA01756), 颤杨(AAO03579), 拟南芥(NP_186955), 烟草(AF304375_1)的同源性高达71%, 81%, 78%和74%, 表明所克隆基因确实为杉木的纤维素合成酶类似蛋白D 基因(图4)。
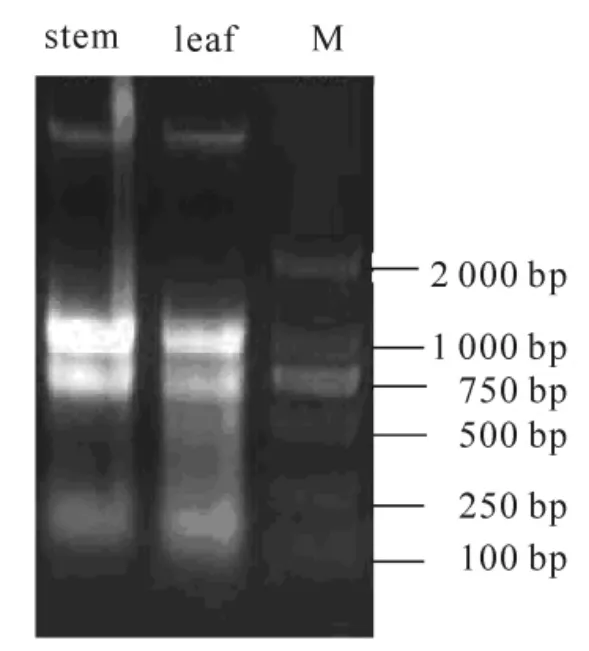
图1 杉木总RNA 提取结果Figure 1 Total RNA preparation Cunninghamia lanceolata
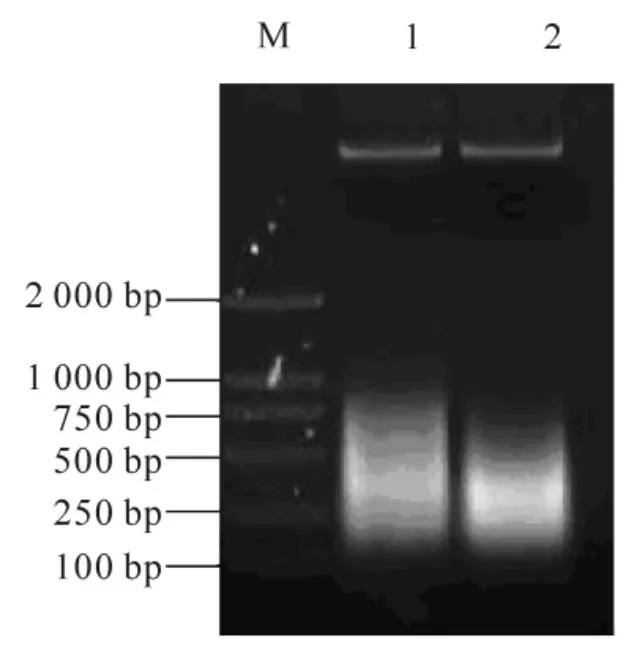
图2 杉木RNA 反转录产物Figure 2 RT product of Cunninghamia lanceolata RNA
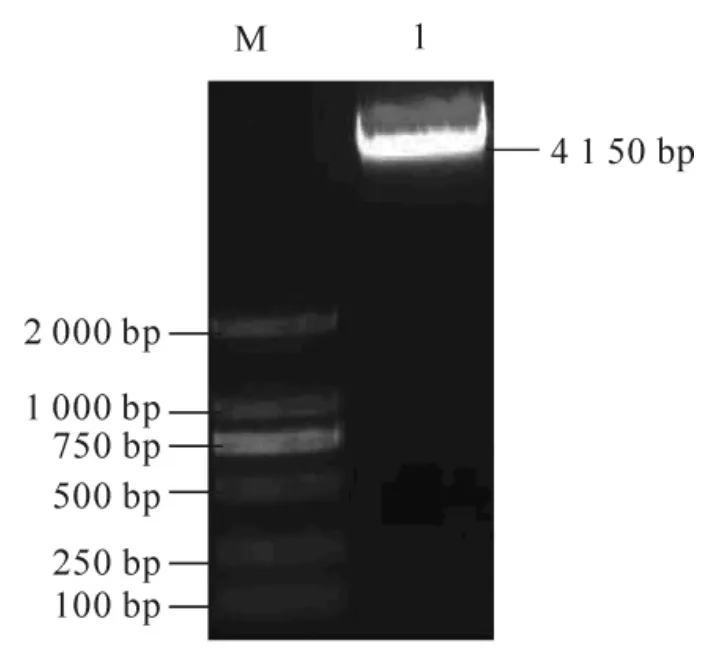
图3 杉木CslD1 全长cDNA RTPCR 产物的琼脂糖电泳图谱Figure 3 Agrose gel electropheropram of RTPCR product of CslD1 full-length cDNA in Cunninghamia lanceolata
2.2 杉木CslD1 基因的生物学信息
ClCslD1 蛋白的结构特点和理化性质。 该蛋白相对分子质量为126 801.2 KD, 等电点为6.68, 理论推导半衰期大于30 h, 不稳定系数为39.64, 属于稳定蛋白; ClCslD1 蛋白的二级结构中α-螺旋(helix)占34.84%, β-折叠(sheet)占14.68%, 无规则卷曲(coil)占50.94%; 疏水性/亲水性分析结果表明, 疏水性最大值为3.067, 最小值为-3.222, 总体属于亲水性蛋白; 跨膜结构预测表明, 该蛋白拥有8 个跨膜区, 分别是281~303, 310~332, 908~930, 943~962, 977~999, 1 029~1 051, 1 066~1 083 和1 096~1 115,跨膜螺旋长度最小19 个氨基酸残基, 最大22 个氨基酸残基, 平均长度为21.25 个氨基酸残基。 在保守区A 中含有保守的天冬氨酸残基, 排列为Dx…xDCD; 在保守区B 中含有保守的天冬氨酸残基, 排列为Dx…QVLRW。 蛋白质亚细胞定位预测认定其为细胞质蛋白质(reliability index=2; expected accuracy=74%),而且SignalP 软件分析该蛋白为非分泌蛋白, 不具有信号肽结构。 此外, 保守功能结构域分析结果显示,该蛋白质具有一个cellulose_synt 功能域, 该结构域为纤维素合成酶蛋白家族的一个特征性结构域, 具有催化尿苷二磷酸形成的功能。
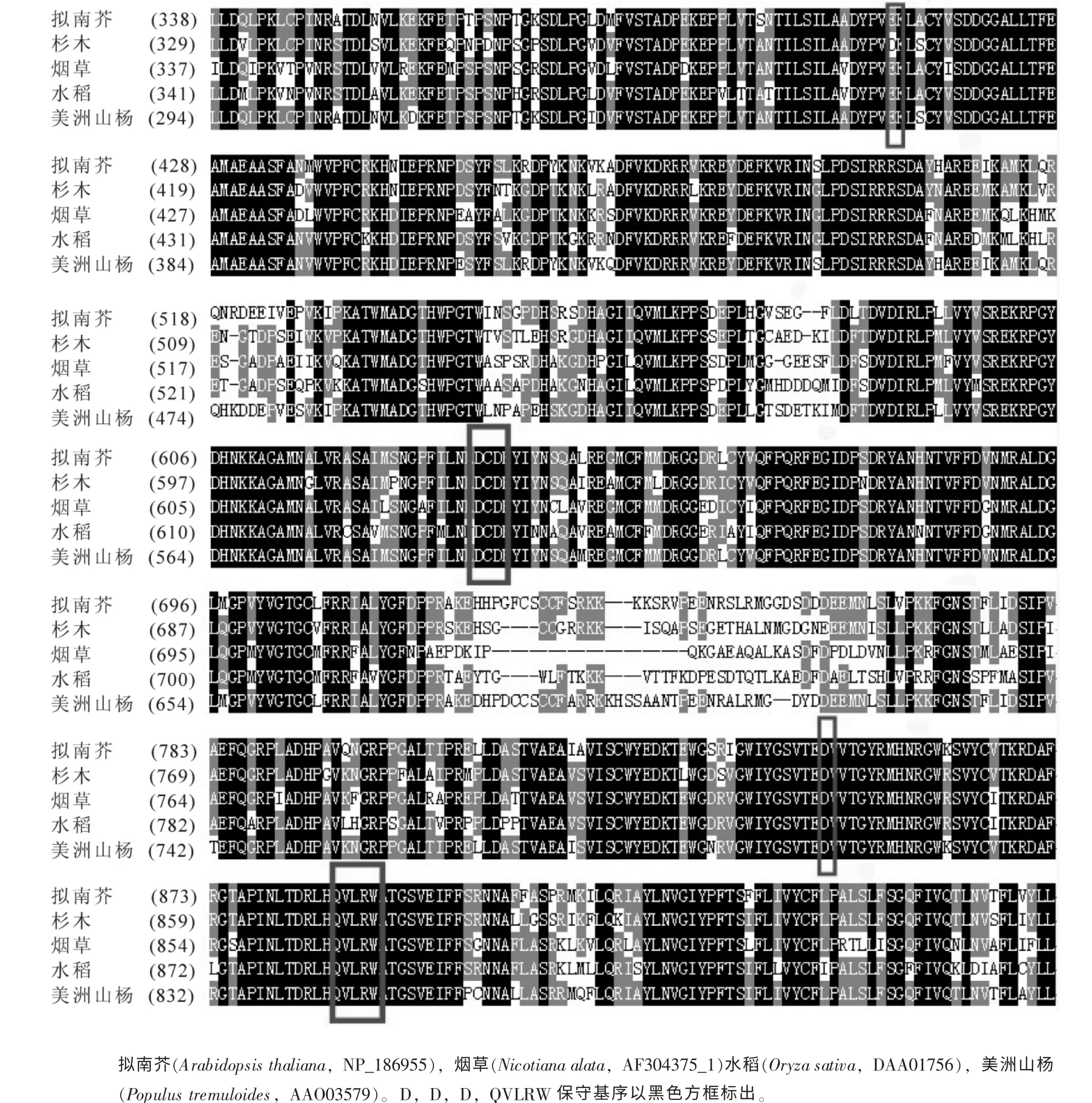
图4 杉木ClCslD1 部分蛋白序列及其他植物同源蛋白序列的比较Figure 4 Comparison of ClCslD1 in in Cunninghamia lanceolata and its homologus protein from other plants
用MEGA3 软件的邻接法(neighbor-joining, NJ)构建不同植物CslD 蛋白的系统发育树(图5)。 从构建的发育树中可以看出: 杉木CslD1 蛋白与OsCslD2, AtCslD2, AtCslD3 和PtrCslD4 距离最近。 已有研究表明: AtCslD3 在拟南芥根毛的伸长区及根毛区细胞壁的抗张强度有关, 而AtCslD2 和OsCslD1 也在根毛区的表达丰度较强, 推测ClCslD1 可能与根毛区细胞壁的合成有关, 其具体功能需要进一步验证。
3 讨论

图5 植物CslD 蛋白的系统进化关系分析Figure 5 Phylogenetic tree analysis of CslD from various plants specious
近年来, 对纤维素合成酶类似蛋白基因的研究获得了初步成果。 利用拟南芥突变体发现AtCslAT 基因在拟南芥花粉管及胚胎发育中起重要作用, 推测此蛋白质对于细胞壁合成是必需的[2]。 用T-DNA 插入法证明: AtCslD3 与拟南芥根毛的伸长及根毛区细胞壁的抗张强度有关, 推测此蛋白质可能与根毛区细胞壁合成有关[4], 而AtCslD2 也在根毛区表达丰度较高。 Doblin 等[8]研究发现: 烟草NaCslD1 基因可能是编码花粉管纤维素合成的特异基因。 Anita 等[7]利用定量PCR 技术发现PtrCslD2 基因在杨树木质部细胞的次生壁中有较高丰度的表达, 参与纤维素的合成。 Butron 等[10]将仅在水稻和大麦以及其他谷类中表达的CslD 基因插入到拟南芥中, 结果发现转基因拟南芥所产生的β 葡聚糖量很低, 意味着CslF 基因与纤维合成有关, 同时也表明这种细胞壁成分还需要其他的 “补充因子”。 植物纤维素的合成是一个复杂的过程, 而纤维素合成酶和纤维素合成酶类似蛋白基因更是一个大的基因家族。 本研究的局限性在于仅以茎叶组织为材料, 很难克隆出家族中的所有成员。 系统研究其分子调控过程, 需要克隆更多的纤维素合成酶及类似蛋白基因。 ClCslD1 基因的发现为进一步在分子水平上研究杉木的纤化打下了基础。
[1] ENGLEHARDT J.Sources, industrial derivatives, and commercial applications of cellulose [J].Carbohydr Eur, 1995,12: 5-14.
[2] GOUBET F, MISRAHI A, PARK S K, et al. AtCSLA7, a cellulose synthase-like putative glycosyltransferase, is important for pollen tube growth and embryogenesis in Arabidopsis [J]. Plant Physiol, 2003, 131 (2): 547-557.
[3] FAVERY B, RYAN E, FOREMAN J, et al. KOJAK encodes a cellulose synthase-like protein required for root hair cell morphogenesis in Arabidopsis [J]. Genes & Dev, 2001, 15: 79-89.
[4] WANG X, CNOPS G, VANDERHAEGHEN R, et al. AtCslD3, a cellulose synthase-like gene important for root hair growth in Arabidopsis [J]. Plant Physiol, 2001, 126 (2): 575-586.
[5] HAZEN S P, SCOTT-CRAIG J S, WALTON J D. Cellulose synthase-like genes of rice [J]. Plant Physiol, 2002, 128(2): 336-340.
[6] KIM C M, PARK S H, JE B I, et al. OsCslD1, a cellulose synthase-like D1 gene, is required for root hair morphogenesis in rice [J]. Plant Physiol, 2007, 143 (3): 1220-1230.
[7] SAMUGA A, JOSHI C P. Cloning and characterization of cellulose synthase-like gene, PtrCslD2 from developing xylem of aspen trees [J]. Physiol Plant, 2004, 120: 63l-641.
[8] DOBLIN M S, De MELIS L, NEWBIGIN E, et al. Pollen tubes of Nicotiana alata express two genes from different βglucan synthase families [J]. Plant Physiol, 2001, 125 (4): 2040-2052.
[9] KUMAR S, TAMURA K, NEI M. MEGA3: integrated software for molecular evolutionary genetics analysis and sequence alignment [J]. Brief Bioinform, 2004, 5 (2): 150-163.
[10] BURTON R A, WILSON S M, HRMOVA M, et al. Cellulose synthase-like CslF genes mediate the synthesis of cell wall(1, 3; 1, 4)-β-D-glucans [J]. Science, 2006, 311 (5769): 1940-1942.
