改变大脑5-羟色胺水平对戊四氮点燃大鼠癫形成过程的影响
2012-07-20陈文珍王开颜刘学源陈玉娟
陈文珍,王开颜,洪 震,刘学源,陈玉娟
(1.同济大学附属第十人民医院神经内科,上海 200072;2.复旦大学附属华山医院神经内科,上海 200040)
研究近年表明,戊四氮(pentylenetetrazol,PTZ)诱发急性癫发作和慢性癫模型形成过程5-羟色胺(5-HT)动态变化中,在急性发作海马5-HT显著升高,在慢性癫模型形成过程,海马5-HT水平随着点燃的时间延长而逐步降低[1-2]。那么脑内5-HT水平升高或降低对癫的形成会有什么样的影响呢?本文分别用西酞普兰(升高5-HT)和利血平(降低5-HT)干预,研究大脑5-HT变化对PTZ点燃慢性癫形成过程的影响,为癫形成的干预措施提供有效的证据。
1 材料与方法
1.1 材料与仪器
PTZ、5-HT(Sigma USA);水合氯醛(上海化学试剂公司);多导生理记录仪(BioPAC systems MP150,USA)。
脑内微透析系统:包括CMA/120清醒动物装置、CMA/102微量泵、CMA/170低温样品收集器、CMA/150动物温度控制器、CMA/12微透析探头(膜长2 mm、内径400 mm、外径500 mm、允许透过的最大分子质量界限值为20 000道尔顿),套管,微电脑工作站,2 μm无菌针头滤膜。
高效液相色谱仪组成:ESA Model 582 pump,BAS Sample Sentinel autosampler,and ESA CouloChem Ⅲ detector,Enhanced Model 5041 Cell,Model 5020 Guard Cell,EZChrom Elite data system.BAS USA。
1.2 实验大鼠分组和模型大鼠癫发作程度的评估
清洁级健康成年雄性Wistar大鼠48只,体质量250~300 g(复旦大学上海医学院实验动物部提供)。置室温(24±2)℃,24 h昼夜循环光照条件下生活,保证环境安静和昼夜节律。大鼠随机分为4组:(1)对照组,每日同一时间点,腹腔注射生理盐水;(2)戊四氮组(PTZ group,PTZ组)、每日同样时间腹腔注射1%PTZ(Sigma公司,美国)35 mg/kg,且在用PTZ注射前0.5 h予以生理盐水1 ml/d灌胃7 d作为对照,分别在 PTZ注射第7、14、21、28 d的发作间期(PTZ注射诱发癫发作后3 h)行微透析取样。(3)西酞普兰组(CTP+PTZ group,CTP组):为了评估5-HT水平升高对癫形成的影响作用,用西酞普兰(一种选择性5-HT再摄取抑制剂)提高大鼠脑内5-HT浓度,在用PTZ每日(35 mg/kg)腹腔注射一周前开始给予西酞普兰(Citalopram,西安杨森公司提供)灌胃,0.5 mg/kg(按成人剂量20 mg/d,折算而得)干预。每日在PTZ腹腔注射前0.5 h予西酞普兰灌胃,在PTZ腹腔注射第7、14、21、28 d的发作间期(PTZ注射诱发癫发作后3 h)进行微透析取样。(4)利血平组(RSP+PTZ group,RSP 组):为了评估 5-HT 水平降对癫形成产生的作用,用利血平(5-HT耗竭剂)降低5-HT水平,每日在PTZ(35 mg/kg)腹腔注射一周前开始给予灌胃利血平(Reserpine,复旦复华制药),1 mg/kg(按成人剂量40 mg/d,折算而得)干预,每日在PTZ注射前0.5 h予利血平灌胃,在PTZ腹腔注射点燃第7、14、21、28 d发作间期(PTZ注射诱发癫发作后3 h)进行微透析取样。
1.3 微透析活体获取大鼠脑海马组织间液[4]
1.3.1 微透析探针外套管和海马电极导管安置术10%的水合氯醛300 mg/kg腹腔注射麻醉大鼠至大鼠翻转反射消失,再以2%利多卡因双侧外耳道表面麻醉,将大鼠头颅水平固定于立体定向仪上(背朝上固定呈头颅水平位)。常规消毒,正中矢状位切口,分离骨膜,用3%H2O2止血并充分暴露前囟,确认前后囟在同一平面。根据Paxinos and Watson的《大鼠脑立体定位图谱》[5]确定右侧海马CA1和CA3区靶点:CA1区在前囟向后5.6 mm,矢状缝线向右侧4.6 mm,硬膜向下4.6 mm,置入微透析外套管;CA3区前囟向后2.64 mm,矢状缝线向右侧2.0 mm,硬膜向下 4.0 mm,置入电极导管。
同时在颅骨上旋入4 mm螺丝,与其他两点形成三角形,用牙科水泥固定在钻孔周围的颅骨上,待牙科水泥凝固后形成一个平面,常规消毒并缝合伤口,待大鼠清醒后送回动物房。实验中保证微透析实验和脑内海马电极检查顺利进行。
1.3.2 人工脑脊液配置[6]NaCl 126、KCl 5、MgSO42、CaCl22、NaH2PO41.25、NaHCO326、Glu 10 mmol/L,调节 pH 值为7.4,2 μm 无菌针头滤膜过滤,4℃冰箱保存,2周内用于微透析实验。
1.3.3 微透析活体取样 在大鼠清醒状态下移去导引管针芯,连接微透析装置,排出系统中的气泡,将探针沿导管插入大鼠海马,探针前端2 mm半透膜完全置于海马内,微量泵内充满人工脑脊液,微灌注泵以2 μl/min的恒定流速使人工脑脊液通过流入管、探针、流出管。平衡1 h,使探针内人工脑脊液和大鼠海马细胞外液的物质交换趋于稳定,然后连接微透析装置以便检测。
1.3.4 取样时间 在第7、14、21、28 d发作间期分别取样1次,每次收集 30 min透析液样品,置Eppendorf管中,每管 60 μl,-80 ℃ 冰箱保存,2 周内用于高效液相检测;对照组取样1次。
1.3.5 各组体外回收率测定法 配置333 ng/ml,5-HT标准液,37℃,将探针前端浸在溶液中,以2 μl/min的流速推动人工脑脊液通过探针。平衡1 h后,连续收集流出液60 μl/次,共3管。
1.3.6 高效液相检测仪 分别检测回收脑组织间液和标准液中 5-HT、5-HIAA 浓度。
1.3.7 5-HT、5-HIAA 浓度和 5-HT 转化率公式

1.3.8 海马靶点确认 实验结束后用4%多聚甲醛对动物进行心脏灌流,取鼠脑,冰冻切片机切片,行苏木精-伊红染色确定探针所在位置为海马。
1.4 脑电图(EEG)记录
1.5 统计学方法
应用SPSS14.0统计软件进行统计学处理,计量数据以±s表示,应用均数两两比较t检验。
2 结 果
2.1 行为学观察结果
生理盐水对照组未出现发作。(1)在点燃期间,CTP组,14 d以内,其发作程度为1~3级,发作潜伏期较长,20 d左右出现5级发作,24 d全部点燃,无动物死亡;在点燃期间,CTP组发作潜伏期延长,发作程度轻和点燃时间延长,发作死亡率低,与PTZ组比较差异有显著性(P<0.05);点燃后,CTP组诱发发作潜伏期、发作程度等与戊四氮组比较无统计学意义。(2)在点燃期间,RSP组,在腹腔注射3~5 d内就出现3~5级发作,7 d就有3~4只点燃,10 d左右全部点燃,有2只出现癫持续状态后死亡;在点燃期间,RSP组诱发发作程度重,发作潜伏期短、点燃时间短,发作持续时间长,死亡率高,与戊四氮组和对照组比较差异有显著性(P<0.05);点燃维持期,发作情况与戊四氮组差异无显著性,见表1。
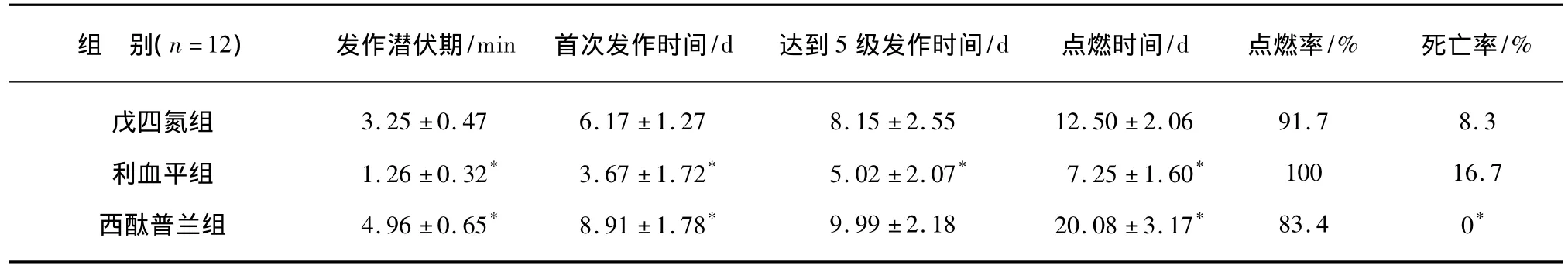
表1 戊四氮点燃癫 形成过程各组主要参数比较Tab.1 Parameters of PTZ kindling epileptic model by different groups in rats
2.2 大鼠点燃后各组发作前后典型EEG表现(图1、2)
对照组为正常EEG。PTZ点燃第7、14、21天可见散在尖波,第28天可见自发癫样放电。PTZ点燃第7、14、21、28 天发作时出现癫波潜伏期随点燃时间延长而缩短,均出现尖波、棘波、尖慢及棘慢综合波等。在点燃期间(第7天和第14天),各组脑电图典型表现略有差异,RSP组尖波爆发的幅度和数量均比CTP组高;在维持点燃期间(第21天和28天),CTP组、RSP组和PTZ组的脑电图比较无明显差异。

图1 戊四氮点燃大鼠发作间期典型EEG表现Fig.1 Interictal typical EEG of PTZ kindling rats
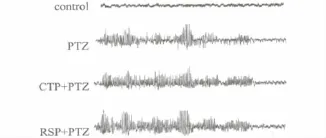
图2 戊四氮点燃大鼠发作期典型EEG表现Fig.2 Ictal typical EEG of PTZ kindling rats
2.3 5-HT 和5-HIAA 浓度以及5-HT 转化率变化
体外回收率为15% ~20%,计算各组发作间期的5-HT和5-HIAA浓度以及5-HT转化率结果如表2所示。(1)在戊四氮点燃癫形成过程中,发作间期5-HT水平,点燃初期,CTP组大鼠的海马 5-HT 水平升高,5-HT 转化率(5-HIAA/5-HT)降低,与对照组和PTZ组比较有显著性差异(P<0.05);维持点燃阶段,CTP组,5-HT 水平逐日降低,与戊四氮组比较无统计学意义;与对照组比较有显著性差异(P<0.05);CTP组5-HIAA水平在点燃过程逐步降低与对照组和点燃不同时期比较,差异有显著性(P<0.01),与戊四氮组比较差异无统计学意义;点燃维持期5-HT转化率(5-HIAA/5-HT)变化与PTZ组和对照组比较无统计学意义。(2)RSP组,在点燃期间,5-HT水平降低与戊四氮组和对照组比较差异有显著性(P<0.05);点燃维持期,RSP组5-HT水平逐渐下降与对照组比较有显著性差异(P<0.05)和PTZ组比较无统计学意义;RSP组5-HIAA水平,呈逐日下降趋势,与对照组比较有显著性差异(P<0.01),与PTZ组比较无统计学意义;5-HT转化率(5-HIAA/5-HT)变化无统计学意义,与对照组和戊四氮组比较差异无显著性。
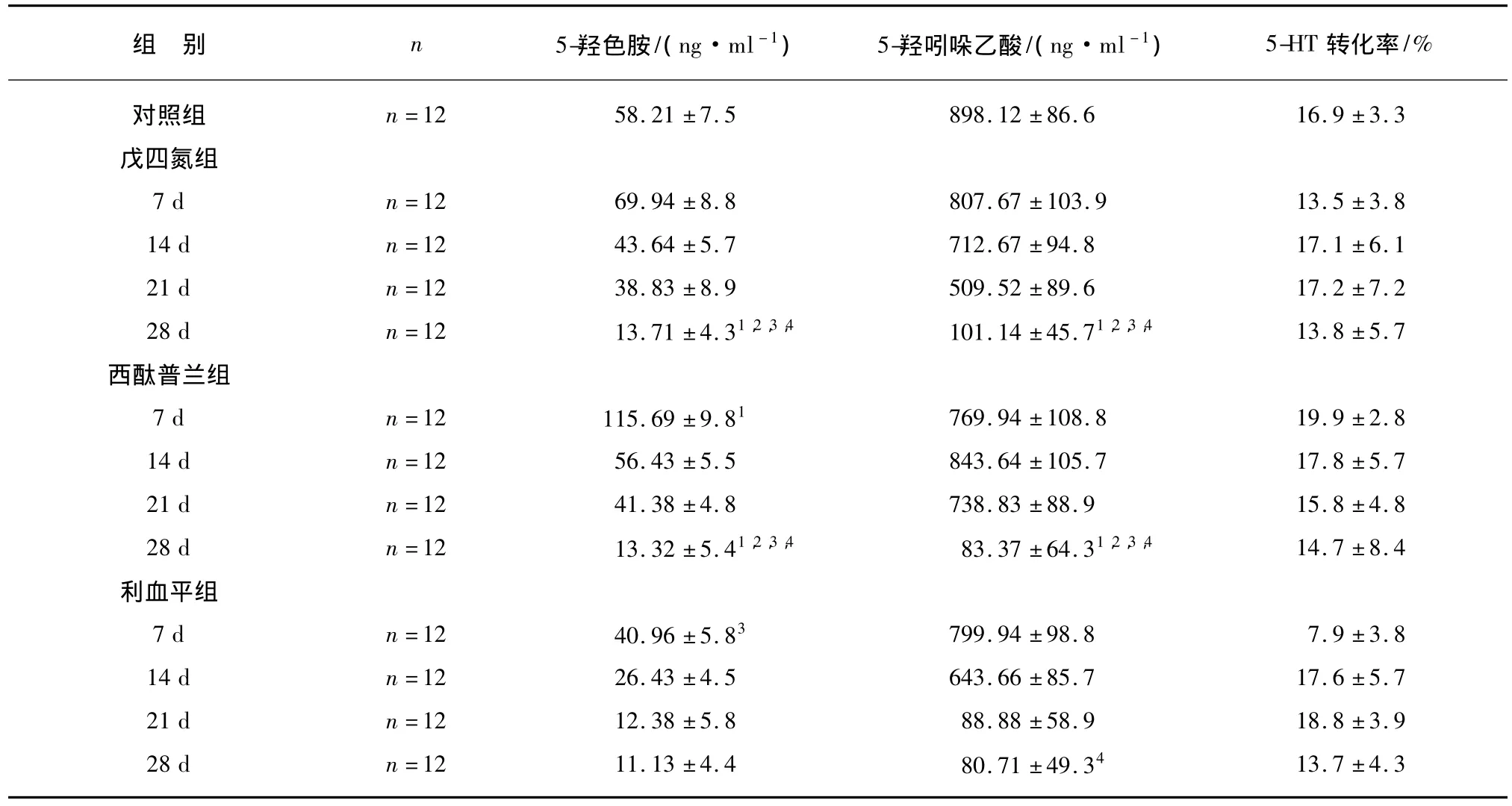
表2 4组各时间点PTZ点燃大鼠海马组织间液5-HT、5-HIAA浓度和5-HT转化率Tab.2 Concentration of 5-HT,5-HIAA and 5-HT turnover rate in hippocampus in different time of PTZ kindling rats(x±s)
3 讨 论
用西酞普兰和利血平分别提高和降低脑内5-HT水平,通过改变5-HT水平来研究PTZ点燃癫形成的变化。结果显示,戊四氮点燃癫形成过程中,在点燃早期,西酞普兰干预后使戊四氮诱发癫发作潜伏期延长,发作程度较轻,发作持续时间短,点燃时间延长,死亡率降低;但是,在点燃后,戊四氮诱发发作潜伏期,发作严重程度和发作持续时间与戊四氮组比较无明显的区别。脑电图显示在点燃早期西酞普兰延长了脑电图癫波出现的潜伏期,但是在点燃后,并没有减少脑电自发放电和抑制癫波爆发;用HPLC检测透析液结果证明,在点燃早期,CTP组海马 5-HT 显著升高,5-HT 转化率降低这与文献报道相一致[9];点燃过程中,5-HIAA 水平呈持续性的降低,5-HIAA是5-HT的一种重要代谢产物,5-HIAA浓度在PTZ点燃过程中逐步减少,但是与5-HT变化并不一致,这跟Burger等研究发现细胞外5-HT水平升高并没有伴随着5-HIAA变化的结果相一致[10]。用 5-HIAA/5-HT 比值作为估计5-HT转化率和代谢的一种近似的工具[11],在点燃早期(7d)与对照组比较5-HT转化率降低,提示西酞普兰作用下,可能导致5-HT分解代谢减少,有学者在PTZ惊厥模型中发现,在海马和前脑皮质有比较低的5-HT转化率,与结果相一致;他们也证明了,PTZ诱导癫发作减少了西酞普兰在海马的结合,这些数据提示,至少在PTZ模型,西酞普兰减少5-HT 再摄取,可能与 5-HT 转化率降低有关[7,12]。有文献报道,西酞普兰的作用依靠5-HT浓度和5-HT1A受体作用[12],在点燃早期 5-HT 神经递质和受体活性没有受到明显破坏,给予西酞普兰干预,可以升高5-HT水平,降低5-HT转化率,储存足够的5-HT,而抑制癫发作,和延长点燃时间。到了点燃后,大鼠海马神经元坏死、丢失,也可能造成部分海马5-HT神经元丢失,分泌5-HT减少,所以,在点燃晚期,没有足够的5-HT浓度,西酞普兰不能够抑制癫发作,也不能阻断癫形成。
总之,西酞普兰戊干预四氮点燃期间可以提高脑内5-HT水平,延长点燃时间,减轻发作程度和降低死亡率,点燃形成后,西酞普兰无明显减轻发作作用;利血平降低5-HT水平,缩短点燃时间,加重发作程度,促进癫形成。升高5-HT水平对癫形成有一定的延缓作用。
[1]陈文珍,王开颜,刘学源,等.戊四氮点燃癫大鼠海马5-羟色胺能神经递质的动态研究[J].中国临床神经科学,2010,18(5):449 -455.
[2]陈文珍,王开颜,洪震,等.戊四氮点燃大鼠癫发作和癫形成过程中海马5-HT水平的变化[J].癫与神经电生理学杂志,2010,19(4):199-203.
[3]陈自柳,赵玉武,余爱勇,等.AQP4在癫大鼠海马区的表达及意义[J].同济大学学报:医学版,2008,29(3):27-29.
[4]Stanley EM,Fadel J.Aging-related deficits in orexin/hypocretin modulation of the septohippocampal cholinergic system[J].Synapse,2012;66(5):445 -452.
[5]Paxinos W.The rat brain in stereotaxic coordinates[M].Academic Press,2007:6-10.
[6]Miyajima M,Shimoji K,Watanabe M,et al.Role of artificial cerebrospinal fluid as perfusate in neuroendoscopic surgery:a basic investigation[J].Acta Neurochirurgica,2012,113(suppl):103 -107.
[7]Igelström KM. Preclinicalantiepileptic actions of selective serotonin reuptake inhibitors implications for clinical trial design [J]. Epilepsia, 2012,53(4):596-605.
[8]Saharia K,Arya U,Kumar R.Reserpine modulates neurotransmitter release to extend lifespan and alleviate age-dependentAβ proteotoxicity in Caenorhabditis elegans[J].Experimental gerontology,2012,47(8):541-551.
[9]Wallinga AE,Grahlmann C,Granneman RA,et al.Gender differences in hyperthermia and regional 5-HT and 5-HIAA depletion in the brain following MDMA administration in rats[J].Brain research,2011,1398:13-22.
[10]Geldof M,Freijer JI,Peletier LA,et al.Mechanistic model for the acute effect of fluvoxamine on 5-HT and 5-HIAA concentrations in ratfrontalcortex [J].European Journal of Pharmaceutical Sciences,2008,33(3):217-229.
[11]Park H, YooD, KwonS, etal. Acupuncture stimulation at HT7 alleviates depression-induced behavioral changes via regulation ofthe serotonin system in the prefrontal cortex of maternally-separated rat pups[J].Journal of Physiological Sciences,2012,62(4):351-357.
[12]Raedt R,Clinckers R,Mollet L,et al.Increased hippocampal noradrenaline is a biomarker for efficacy of vagus nerve stimulation in a limbic seizure model[J].Journal ofneurochemistry,2011,117(3):461-469.
