大鼠腹膜间皮细胞的分离培养方法
2012-07-20马姝琛严海东庄守纲张瑞青
马姝琛,严海东,庄守纲,兰 洋,张瑞青,王 奕
(同济大学附属东方医院肾内科,上海 200120)
随着终末期肾衰竭发病率的升高,临床上腹膜透析的运用越来越多。而随着透析龄的增加,腹膜透析的重要合并症腹膜失超滤的发生率也随之增加。已知腹膜间皮细胞在保持腹膜的正常结构和功能中起主要作用。为了探讨腹膜间皮细胞在腹膜失超滤中的作用,有必要建立一种简便有效的方法获取腹膜间皮细胞,本实验为在体外进行腹膜间皮细胞及腹膜的研究提供了有效手段。
1 材料与方法
1.1 材料
1.1.1 取材 雄性SD大鼠(体质量:120~160 g,由上海交通大学附属瑞金医院实验动物中心提供)无菌手术取得的大网膜及脾胃韧带。
1.1.2 主要仪器设备 超净台、吸管、离心管、0.22 μm滤膜过滤器、手术剪、眼科剪、镊子、培养皿、25 cm2培养瓶、普通离心机、CO2培养箱、倒置相差显微镜等。
1.1.3 主要试剂 磷酸盐缓冲液(PBS)、DMEM/F12培养液(加入青链霉素各100 μ/ml)、胎牛血清(FCS)、完全培养液(含15%FCS的DMEM/F12培养液)、细胞消化液(0.25% 胰蛋白酶 0.02%EDTA)、免疫荧光抗体(抗细胞角蛋白抗体)、免疫组化染色抗体(抗波形蛋白抗体、抗白细胞CD45抗体、抗第Ⅷ因子相关抗原抗体)
1.2 方法
1.2.1 RPMC的分离培养 无菌取得SD大鼠大网膜及脾胃韧带,置于培养皿内,PBS液洗3次。加入细胞消化液,置于37℃培养箱中消化约10 min。取出后加入等量完全培养液终止消化,吸管吹打约10 min。液体移入10 ml尖底离心管中,1000 r/min,离心5 min。弃上清。加入适量完全培养液重悬细胞,装于25 cm2培养瓶中。放置于37℃、5%CO2培养箱内培养。
1.2.2 RPMC的传代培养 消化下的RPMC置于37℃、5%CO2培养箱内培养,根据细胞贴壁情况24~48 h后予以首次换液。此后,每2~3 d换液一次。约5~8 d细胞生长融合,开始首次传代。PBS洗1次,加入细胞消化液约1 ml,镜下观察细胞消化情况,待细胞变圆脱落后,加入2 ml完全培养液终止消化,并适当吹打,液体移入10 ml尖底离心管内。1 000 r/min,离心5 min。弃上清,加入适量完全培养液重悬细胞。分装于25 cm2培养瓶中,继续置于培养箱内培养。
1.2.3 鉴定 取第2代RPMC置光镜下观察细胞形态,染色并计算纯度。鉴定:免疫荧光鉴定:细胞爬片经95%冷乙醇固定后,用抗细胞角蛋白荧光抗体染色;免疫组化鉴定:细胞爬片经95%冷乙醇固定后,分别用抗波形蛋白抗体、抗白细胞CD45抗体、抗第Ⅷ因子相关抗原抗体,行细胞免疫组化染色(图1~4)。
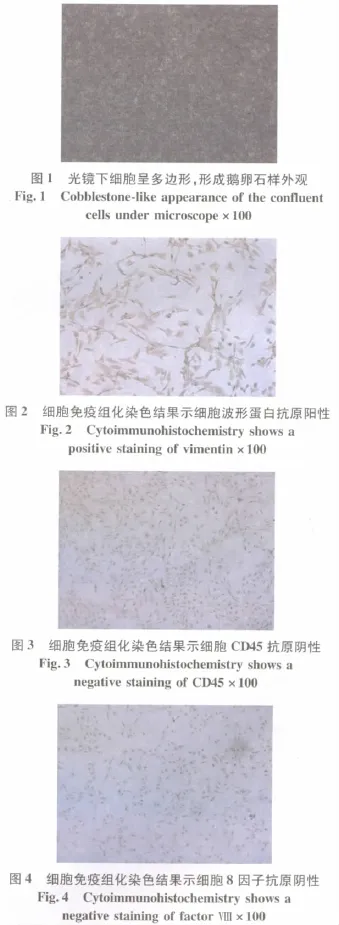
2 结 果
本实验结果显示从大网膜等消化而来的RPMC在光镜下呈葡萄串状。细胞培养约8 h即可开始贴壁生长,细胞呈多形性(梭形、椭圆形、多角形),边缘不整,呈拉网状生长。以后细胞生长融合呈多角形,大小较一致,整体似铺路石外观。细胞免疫荧光染色提示细胞角蛋白抗原阳性,细胞免疫组化染色分析提示波形蛋白抗原阳性,白细胞CD45抗原、抗第Ⅷ因子相关抗原阴性。故可排除成纤维细胞、内皮细胞、白细胞,可证实本实验分离培养所得为腹膜间皮细胞。
3 讨 论
为提高RPMC分离培养的成功率需注意:①无菌操作非常重要。新鲜获取的组织最好及时处理。如不能马上处理,需浸泡于含青链霉素的PBS液中,尽量在24 h内使用。②严格掌握消化时间。时间过短会导致未能消化下所需细胞,时间过长会影响细胞的活性,细胞存活率明显下降,如消化时间超过30 min,则成纤维细胞的出现率将大于50%。③一般培养6~8 h即可开始贴壁,如仍未贴壁,则一般贴壁生长可能性明显降低,但一般初次换液仍将在培养24~48 h后进行,换液前尽量减少晃动以免影响其贴壁。④传代超过3次细胞可出现老化、形态异常。故实验最好采用前三代细胞。
目前PMC的分离培养方法较多,据文献介绍有直接将胰酶等注入腹腔消化获取消化液进行培养[1-2],或从腹透流出液中分离、培养[3],有将剪取的网膜组织直接接种于培养瓶中的直接消化法[4],胶原酶消化法[5]等,因实验目的不同,各种方法都被采用,但都存在一定局限性,如细胞获取率较低,费时、费力,对仪器有特殊要求,培养周期长,费用昂贵等,而且人腹膜的获取还存在伦理问题。
本实验采用的是大鼠的网膜,采用胰酶消化法,用时短,重复性好,费用相对低廉,总之,可操作性强。为体外研究PMC的生理功能及其在腹膜炎、腹膜纤维化等防治中的作用提供了必要的、很好的物质基础。
[1]樊敏,刘伏友,段绍斌,等.改良法培养鼠腹膜间皮细胞[J].湖南医科大学学报,2002,27(6):542-544.
[2]徐家云,樊小军,常洁,等.几丁糖对高糖腹透液刺激大鼠腹膜间皮细胞TGF-β1表达的影响[J].第三军医大学学报,2010,32(13):1446 -1448.
[3]周循,凌光辉,邹莎琳,等.腹膜透析流出液中人腹膜间皮细胞的培养及转分化特征[J].中国现代医学杂志,2010,20(17):2634 -2642.
[4]石永兵,金东华,詹周兵,等.人腹膜间皮细胞的原代培养及传代[J].苏州大学学报:医学版,2010,30(2):307-309.
[5]董柯,陈香美,傅博,等.高糖和抗生素对大鼠腹膜间皮细胞表达 PAI和 TGF-β mRNA的影响[J].中华内科杂志,1997,10(36):689 -692.
