LDL对小鼠成骨细胞的影响
2012-07-20倪菊花翟玉娟
倪菊花,翟玉娟,周 筠,雷 涛
(同济大学附属同济医院内分泌科,上海 200065)
骨质疏松症(Osteoporosis,OP)是一种以单位体积内骨量降低,骨组织微结构退化,骨皮质变薄,骨小梁数目减少,骨髓腔增宽,骨强度减低为特征,导致骨质脆性增加易于发生骨折的全身性疾病。随着我国人口的老龄化,骨质疏松症正在成为一种新型的流行病,由骨质疏松症引起的骨折及其他并发症严重影响患者生活质量,给国家和社会造成了极大的经济负担。因此,如何有效预防和治疗骨质疏松症成为了近年来研究的一大热点。众多研究表明,血脂紊乱和骨质疏松之间关系密切[1-4],但结论不一,仍存在着很大的争议,且其之间相互关联的确切机制也尚不明确。本课题拟检测低密度脂蛋白(Low density lipoprotein,LDL)对于MC3T3-E1成骨细胞增殖、分化能力的影响,并利用实时荧光定量技术检测LDL作用下的LRP5、DKK1基因mRNA表达情况,以分析其可能的作用机制。
1 材料与方法
1.1 实验细胞
成骨细胞株MC3T3-E1购于中国科学院细胞库,于同济医院保种。
1.2 主要实验材料、试剂和仪器
LDL购于广州奕源生物科技有限公司,小鼠骨钙素ELISA Kit购于美国IBL公司,细胞培养瓶、培养板购自美国Corning公司,高糖a-MEM培养基及胎牛血清均购自美国 Gibco公司,TRIzol购于Invitrogen公 司,PrimeScriptTM RT reagentKit(Perfect Real Time)DRR037A购于Takara公司,SYBR Premix Ex Taq(Perfect Real Time)DRR041A购于Takara公司,引物由上海生工生物有限公司合成。酶标仪(METERTECH Σ960),培养箱(Thermo HEPA class100),荧光定量 PCR仪(Roche Cycler application system Version 1.5)。
1.3 LDL对小鼠成骨细胞增殖影响
取对数生长期的MC3T3-E1细胞,配细胞悬液密度为2×104/ml后,在96孔板选择20孔,分别在24、48、72 h三个时间组。每个时间组里分 0.05、0.10、0.20 mg/ml LDL 和空白对照组。每孔注入100 μl细胞悬液,对于实验组每孔细胞,轻轻注入相应量LDL和一定量的无血清的a-MEM培养液,使实验总体系为150 μl,使LDL混合液浓度分别达到0.05、0.10、0.20 mg/ml。对照组均加入 100 μl的细胞悬液,每孔再加入50 μl的无血清a-MEM 培养液,每一浓度做5个复孔。按24、48、72 h三个细胞培养时间段进行如下操作:每孔加入10 μl的CCK8溶剂,继续培养2 h。在酶联免疫检测仪上检测450 nm波长处各孔的吸光度(OD)值。
1.4 细胞培养液中骨钙素水平的测定
细胞传代后培养于直径为6 cm的细胞培养皿,约70%融合时同上分别加入相应量的LDL和一定量的无血清的a-MEM培养液,使实验总体系为2 ml,使 LDL 混合液浓度分别达到 0.05、0.10、0.20 mg/ml。并设对照组。继续培养24、48和72 h收集细胞培养上清,用OC测定试剂盒(EL ISA法)检测给药组、对照组细胞上清OC水平。建立标准曲线:设标准孔8孔,每孔中各加入样品稀释液100 μl,第一孔加标准品 100 μl,混匀后用加样器吸出100 μl,移至第二孔,如此反复作倍比稀释至第七孔,最后,从第七孔中吸出100 μl弃去,使之体积均为100 μl,第八孔为空白对照。参照美国IBL公司小鼠骨钙素ELISA Kit说明书完成ELISA,在450 nm处测吸光值。结果计算与判断:所有OD值都应减除空白值后再行计算。以标准品1 000、500、250、125、62.5、31.25、15.625、0 ng/ml之 OD 值在半对数纸上作图,画出标准曲线。根据样品OD值在该曲线图上查出相应小鼠Osteocalcin含量。
1.5 小鼠成骨细胞中LRP5、DKK1mRNA的表达
分别以 0.05、0.10、0.20 mg/ml浓度的 LDL 作用于成骨细胞MC3T3-E1 24、48和72 h。荧光定量PCR检测DKK1和LRP5 mRNA的表达,分别收集细胞,Trizol法提取总RNA,根据Takara RT-PCR试剂盒说明书,进行cDNA合成和PCR扩增。引物根据Medline基因文库用 Primer 5.0软件自行设计(表1)。反应结束后,RQ manager分析软件统计处理,获取Ct值,并根据熔解曲线判断产物的纯度。

表1 各基因和内参引物Tab.1 Genes and Internal control primers
1.6 统计学方法
所有实验均重复检测三次,去除异常值后取平均值,计量资料采用均数±标准差的形式表示。采用SPSS13.0统计软件行单因素方差分析统计CCK8和ELISA实验组及对照组之间的差异。实时荧光定量检测,结果分析根据Kenneth[5]的描述,采用半定量分析。样品数据符合正态分布,本实验用单因素方差分析检测LRP5、DKK1 mRNA在实验组和对照组之间的差异,P<0.05认为有统计学意义。
2 结 果
2.1 LDL对小鼠成骨细胞增殖影响
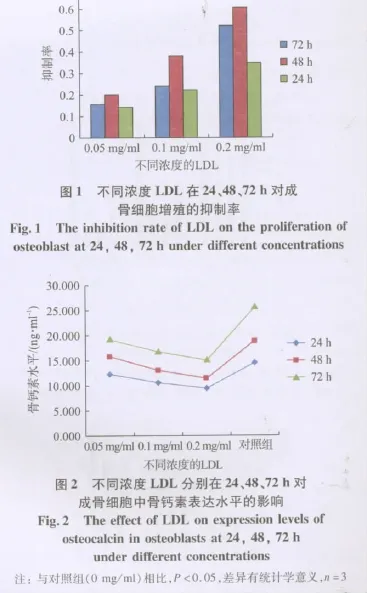
实验结果表明,在24 h LDL浓度为0.05 mg/ml时,成骨细胞的增殖受到明显抑制,与对照组比较,差异具有统计学意义(P<0.05)。LDL作用时间为48 h,浓度为0.20 mg/ml时,对该株细胞增殖的抑制作用最大,为63.48%。单因素方差分析显示同一时间点,0.05、0.10、0.20 mg/ml HDL 和 LDL 浓度组和对照组OD值差异显著(P<0.01);同一浓度,24、48、72 h不同作用时间 OD值差异显著(P<0.01),提示LDL对成骨细胞增殖的作用在一定程度上呈剂量及作用时间依赖性,见图1。
2.2 LDL对小鼠成骨细胞培养液中骨钙素水平的影响
ELISA实验结果显示在24 h浓度为0.05 mg/ml LDL明显抑制成骨细胞培养液中的骨钙素表达,与对照组比较,差异具有统计学意义(P<0.05)。单因素方差分析显示同一时间点,0.05、0.10、0.20 mg/ml LDL浓度组和对照组骨钙素水平差异显著(P<0.01),而同一浓度,24、48、72 h 不同作用时间骨钙素水平差异显著(P<0.01),提示LDL对成骨细胞骨钙素表达的抑制作用在一定程度上具有LDL剂量及作用时间依赖性(图2)。
2.3 LDL对小鼠成骨细胞LRP5、DKK1 mRNA表达的影响
荧光定量PCR实验结果显示在48 h浓度为0.05 mg/ml LDL明显下调成骨细胞中的 LRP5 mRNA表达水平,显著上调DKK1 mRNA表达水平,与对照组比较,差异具有统计学意义(P<0.05)。单因素方差分析显示当作用时间为24 h,0.05、0.10、0.20 mg/ml LDL 实验组和对照组 LRP5 mRNA相对表达量差异不显著(P>0.05),作用时间为48 h 和 72 h,0.05、0.10、0.20 mg/ml LDL 实验组和对照组LRP 5 mRNA相对表达量明显差异(P<0.01)。同一浓度,24、48、72 h 不同作用时间LDL实验组LRP5 mRNA相对表达量差异显著(P<0.01)。当作用时间为 24 h,0.05、0.10、0.20 mg/ml,LDL实验组和对照组DKK1 mRNA 相对表达量差异不显著(P>0.05),作用时间为48 h和 72 h,0.05、0.10、0.20 mg/ml LDL 实验组和对照组DKK1 mRNA相对表达量明显差异(P<0.01),同一浓度,24、48、72 h不同作用时间 LDL实验组DKK1 mRNA相对表达量差异显著(P<0.01),见图 3、4。

3 讨 论
骨的重建由骨的生成和吸收构成,成骨细胞具有骨的形成功能,破骨细胞具有骨吸收作用。两者之间的动态平衡是维持正常骨量的关键[5]。成骨细胞是骨形成、生长、发育的重要细胞之一,其起源于多功能骨髓基质的间质细胞,在骨形成过程中历经分裂增殖、分化成熟和基质钙化三个阶段。其中任何一个阶段出现异常时,都会对骨量和骨的组成产生重要的影响。目前有关胆固醇与骨密度关系的研究结果存在有分歧。既往的大量研究表明LDL水平与骨密度呈负相关[6-7],本次研究发现LDL在24 h浓度为0.05 mg/ml时,明显抑制成骨细胞的增殖,LDL对成骨细胞增殖的促进作用在一定程度上呈LDL剂量及作用时间依赖性。LDL作用时间为48 h,浓度为0.20 mg/ml时,对该株细胞增殖的抑制作用最大,抑制率为63.48%。Brodeur等发现,10~50 μg/ml的ox-LDL促进成骨细胞的增殖,而150 μg/ml浓度以上的ox-LDL可杀死细胞,其机制与ox-LDL引发的溶酶体膜损伤有关[8]。Klein发现,LDL和ox-LDL可诱导Saos2成骨细胞凋亡,LDL可抑制Akt及其下游基因FKHR和GSK3的磷酸化,同时LDL可上调促凋亡基因Bcl-Xs和下调抗凋亡 Src激酶活性[9]。Brodeur等也发现,ox-LDL可诱导成骨细胞的凋亡,证明LDL在成骨细胞中具有多重功能。
骨钙素(OC)又称骨γ-羟基骨蛋白(BGP)或骨依赖维生素K蛋白,是由成骨细胞及肥大细胞合成分泌的一种小分子蛋白,含49个氨基·酸残基,分子质量5.8 kD。血清中OC水平变化直接反映成骨细胞活性,体外研究显示OC为成熟骨细胞的标志物,当骨组织矿化和成骨细胞分化增加时,OC也随之特异增加[10]。本次研究发现在24 h、浓度为0.05 mg/ml LDL明显抑制成骨细胞中的骨钙素表达,随着LDL浓度和作用时间的增加,抑制作用不断增强,说明LDL抑制成骨细胞中骨钙素的表达,证明LDL均参与调节了成骨细胞的分化。Taylor等发现,ox-LDL可与β-磷酸甘油协同作用诱导小牛主动脉平滑肌细胞分化,其机制可能与Osterix与Msx2基因的表达上调有关[11]。体外实验中,采用轻度氧化LDL或其他活性氧化脂质处理骨髓中前成骨细胞,发现成骨细胞分化标志物,如骨钙素等受到抑制;而前成骨细胞则在氧化脂质的诱导下向脂细胞分化;兔血清、脂肪酸和LDL氧化产物也能诱导成骨细胞系向脂肪样细胞分化[12]。
经典Wnt通路可调节成骨细胞的分化、骨基质的形成及矿化等环节并可影响破骨细胞的发生和骨吸收[13-14]。大量研究显示LRP5可通过Wnt/LRP5/β-连环蛋白途径直接调节成骨细胞功能及骨量[15-16]。抑制剂Dickkopf-1是由细胞内分泌的内源性蛋白质或生物活性物质[17],它可通过作用于Wnt信号通路的上游分子卷曲蛋白和散乱蛋白起作用,从而产生拮抗Wnt通路的作用。目前确认的DKKl受体有低密度脂蛋白受体(LRP-5与LRP-6)[18]及含 kringle 结构域的 Kremen 蛋白受体[19]。DKK1直接与LRP受体结合,或者与其跨膜受体Kremen(Kremen-1,Kremen-2)结合后再与LRP5/6结合形成三聚体,诱导快速的细胞内吞,减少细胞膜上的LRP5/6,由此阻断了Wnt信号向胞内的传递[20],使骨形成减少。实验也证实过度表达的DKK1能抑制骨髓基质细胞向成骨细胞分化,使成骨细胞数量减少,还能抑制骨基质的矿化及骨折后的修复[21-22]。
荧光定量PCR实验结果显示,在LDL在24 h浓度为0.05 mg/ml时明显下调成骨细胞中的LRP5 mRNA表达水平,显著上调DKK1 mRNA表达水平,提示HDL和LDL对成骨细胞增殖和分化的抑制作用可能与 wnt信号通路 LRP5及其抑制剂DKK1的表达有一定关系。
[1]Makovey J,Chen JS,Hayward C,et al.Association between serum cholesterol and bone mineral density[J].Bone,2009,44(2):208 -213.
[2]Buizert PJ,van Schoor NM,Lips P,et al.Lipid levels:a link between cardiovascular diseaseand osteoporosis?[J].J Bone Miner Res,2009,24(6):1103-1109.
[3]D'Amelio P,Di Bella S,Tamone C,et al.HDL cholesterol and bone mineral density in normal-weight postmenopausal women:is there any possible association?[J].Panminerva Med,2008,50(2):89 -96.
[4]Dennison EM,Syddall HE,Aihie Sayer A,et al.Lipid profile,obesity and bone mineral density:the hertfordshire cohort study[J].QJM,2007,100(5):297-303.
[5]唐泉,孙元明.经典Wnt信号通路对成骨细胞增殖和分化的影响[J].天津医药,2012,40(2):187-189.
[6]尤婷婷,吴铁,张志平,等.高脂血症致大鼠骨质疏松作用研究初探[J].中国临床药理学与治疗学,2007,12(3):299-303.
[7]Orozco P.Ath erogenic lipid profile and elevated lipoprotein(a)are associated with lower bone mineral density in early postmenopausal overweight women[J].Eur J Epidemio,2004,19(12):1105 -1112.
[8]Brodeur MR,Brissette L,Falstrault L,et al.Influence of oxidized low-density lipoproteins(LDL)on the viability of osteoblastic cells[J].Free Radic Biol Med,2008,44(4):506 -517.
[9]Klein BY,Kerem Z,Rojansky N.LDL induces Saos2 osteoblasts death via Akt pathways responsive to a neutral sphingomyelinase inhibitor[J].J Cell Biochem,2006,98(3):661 -671.
[10]刘红,廖二元,伍贤平.骨钙素与代谢性骨病[J].国外医学:内分泌学分册,2004,24(4):239-240.
[11]Taylor J,Butcher M,Zeadin M,et al.Oxidized lowdensity lipoprotein promotes osteoblast differentiation in primary cultures of vascular smooth muscle cells by upregulatingosterixExpression in an Msx2-Dependent manner[J].J Cell Biochem,2011,112(2):581 -588.
[12]Parhami F,Morrow AD,Balucan J,et al.Lipid oxidation products have opposite effects on calcifying vascular cell and bone cell differentiation.A possible explanation for the paradox of arterial calci fication in osteoporotic patients[J].Arterioscler Thromb Vasc Biol,1997,17(4):680 -687.
[13]BenneR CN, Longo KA, wrightWS, eta1.Regulation of esteoblastogenesis and bone mass by Wntlob[J].Proc Natl Acad Sci USA,2005,102(9):3324-3329.
[14]Yu HM,Jerchow B,Sheu TJ,et a1.The role of Axin2 in calvarial morphogenesis and craniosynostosis[J].Development,2005,132(8):1995 -2005.
[15]Van wL,Cleiren E,Gram J.Six novel missense mutations in the LDL recepter-related protein 5(LRP5)gene in different conditions with increased bone density[J].Am J Hum Genet,2003,72(3):763 -771.
[16]Qiang YW,Hu B,Chen Y,et al.Bortezomib induces osteoblast differentiation via Wnt-independent activation of beta-catenin/TCFsignaling[J].Blood,2009,113(18):4319-4330.
[17]Kawano Y,Kypta R.Secreted antagonists of the Wnt signaling pathway[J].J Cell Sci,2003,116(13):2627-2634.
[18]Mao B,Wu w,Li Y,et a1.LDL-receptor-related protein 6 is a receptor for dickkopf proteins[J].Nature,2001,411:321 -325.
[19]Mao B,Wu W,Davidson G,et a1.Kromen proteins are Dickkopf receptors that regulate Wnt/beta-catenin signalling[J].Nature,2002,417:664 -667.
[20]Mikheev AM,Mikheeva SA,Rostomily R,et a1.Dickkopf-1 activatescelldeath in MDA-MB435 melanoma cells[J].Biochem Biophys Res Commun,2007,352(3):675 -680.
[21]Amantea CM,Kim WK,Meliton V,el a1.Oxysterel induced estoogenic differentiation of marrow stromal cells is regulated by Dkk-l inhibitable and P13-kinase mediated signaling[J].J Cell Bioohem,2008,105(2):424-436.
[22]Lia J,Sarosib I,Russell C,et al.Dkkl mediated inhibition of Wnt signaling in bone results in esteopenia[J].Bone,2006,39(4):754 -766.
