MMP-9、TIMP-1在心力衰竭幼鼠心肌中的表达
2012-07-20陆凤凤
梅 峻,谷 丽,陆凤凤,杨 蓉
(同济大学附属第十人民医院儿科,上海 200072)
目前,认为小儿慢性心力衰竭(chronic heart failure,CHF)发生是由心室重塑引起。基质金属蛋白酶(MMPs)是降解细胞外基质成分的主要蛋白水解系统,金属蛋白酶组织抑制因子(TIMPs)是(MMPs)的内源性特异性抑制剂,本文拟通过建立后负荷过高的慢性心力衰竭幼鼠实验模型,用免疫组化法检测心力衰竭幼鼠心肌MMP-9、TIMP-1的表达,以探讨 MMP-9、TIMP-1在心室重塑中的作用。
1 材料与方法
1.1 动物模型制作及实验分组
60只雄性5~6周龄Wistar幼鼠,对照组10只(仅开腹并分离腹主动脉,但不予以结扎),余50只采用肾上腹主动脉缩窄法制作慢性心力衰竭模型,喂养5周后,死亡22只,余28只幼鼠中有18只出现明显心力衰竭表现,随机抽取这18只幼鼠中的10只行血流动力学测定,证明均达到心力衰竭(左室舒张末压≥15 mmHg)[2],作为心力衰竭组,检测血流动力学参数,用Masson染色法观察左室心肌胶原形态,图像分析测量胶原容积分数(CVF)和血管周围胶原面积(PVCA),免疫组化法检测心室肌中MMP-9、TIMP-1表达。
1.2 血流动力学检测
观察期满后测血流动力学指标。10%乌拉坦腹腔麻醉,导管内充满肝素,右颈总动脉逆行插管至左心室,另一端接多媒体生物信号记录仪系统,记录分析后得左室舒张末压(LVEDP)。
1.3 检测指标
1.3.1 血流动力学指标 9周后测左室舒张末压(LVEDP)。
1.3.2 幼鼠心肌细胞和胶原的定性和定量分析取左室纵截面心肌组织,常规固定、包埋和制片,进行MASSON染色:在MASSON染色下心肌细胞呈红色,胶原呈蓝色。采用 Biosens Digital Imaging System医学图像分析系统,测量心肌胶原容积分数(CVF)及心肌血管周围胶原面积和管腔面积之比(PVCA)。其中CVF=心肌胶原面积/所测视野面积,PVCA=小动脉管腔周围胶原面积/管腔面积,每张心肌切片标本均随机取4个视野测量,取平均值。
1.3.3 免疫组织化学检测 兔抗大鼠MMP-9多克隆抗体购自北京中杉金桥生物公司,TIMP-1抗体购自武汉博士德生物工程公司。sp免疫组织化学试剂盒购自北京中杉金桥生物公司。免疫组化方法按说明书进行。
1.4 数据处理
数据以±s表示,组间差异采用方差分析进行统计学处理,P<0.05或P<0.01认为具有统计学显著性意义。
2 结 果
2.1 各组幼鼠一般状态变化
模型制作5周后对照组幼鼠一般状态正常,模型组幼鼠出现明显心力衰竭表现。
2.2 各组幼鼠的血流动力学及心肌纤维化指标的变化(表1)
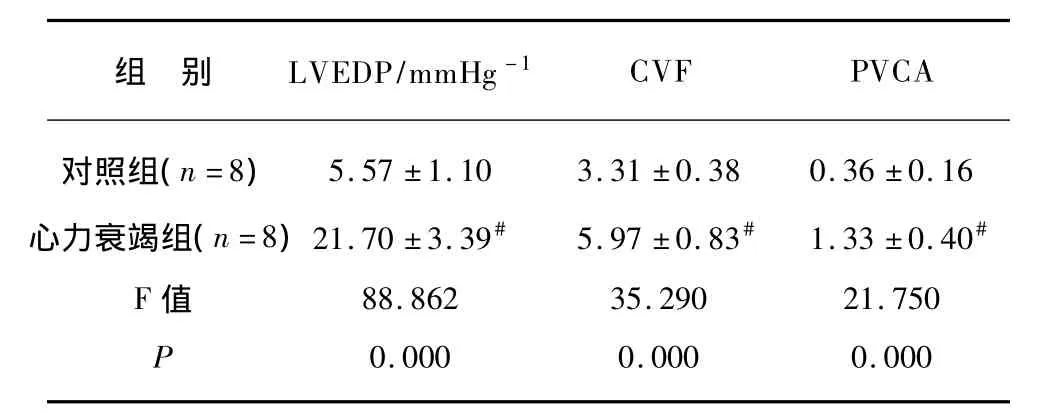
表1 各组幼鼠LVEDP、CVF、PVCA的变化Tab.1 Changes of LVEDP,CVF,PVCA in 2 groups of juvenile rats
由表中数据可知,心力衰竭组幼鼠与对照组幼鼠相比,LVEDP显著升高,各指标具有统计学意义(P<0.01),说明心力衰竭模型制作成功,心力衰竭组幼鼠心肌收缩和舒张能力下降。心力衰竭组幼鼠同对照组相比,心室肌纤维排列紊乱,心肌细胞肥大,间质中可见基质沉积,血管周围可见反应性纤维化,反映心室重塑的指标CVF、PVCA差别有统计学意义(P<0.01)。
2.3 各组幼鼠心肌 MMP-9、TIMP-1表达的变化(表2)
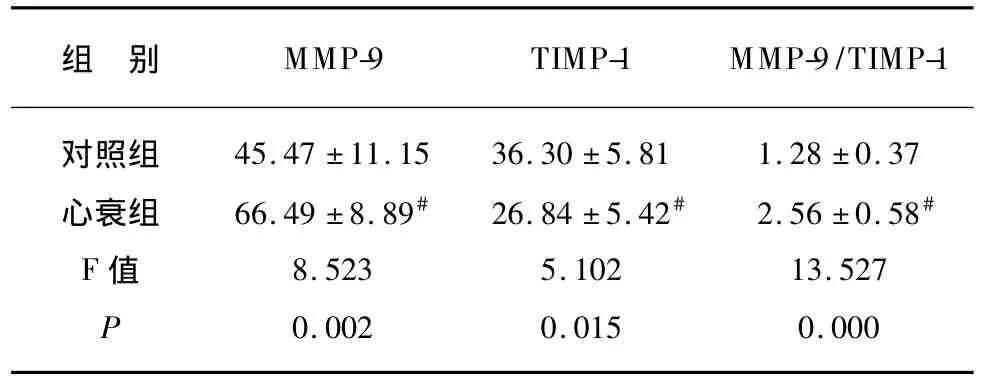
表2 各组幼鼠心肌MMP-9、TIMP-1平均灰度值的比较Tab.2 Comparison of the average value of MMP-9 and TIMP-1 in rat myocardium
MMP-9在对照组幼鼠心肌细胞胞浆内表达较弱,在心力衰竭组强阳性表达,两组相比差别有统计学意义(P<0.01)。TIMP-1在心力衰竭组幼鼠心肌细胞胞浆内表达较对照组明显减弱,差别有统计学意义(P<0.01~0.05)。MMP-9/TIMP-1比值在心力衰竭组幼鼠明显高于对照组,差别有统计学意义(P<0.01)。
3 讨 论
MMP-9是由Sopata和Dancewica在1974年从人的中性粒细胞中首次提纯,1989年的金属蛋白酶学会上被正式命名。分子量92 KDa,是已发现的MMPs中分子量最大的酶。主要由成纤维细胞、单核细胞及嗜中性粒细胞合成[3]。TIMP-1(28 KD)广泛存在于组织和体液中,被多种细胞因子(IL-1,TGF-d等)诱导表达,与胶原酶和明胶酶有高亲和性,是MMP-9的特异抑制因子,是体内调节MMP-9活性的重要内生性抑制系统[4]。
越来越多的实验及临床研究证明MMP-9水平的增高在心室重塑中起着非常重要的作用[5],研究发现,MMP-9对基底膜的过度的降解会影响心肌细胞的空间排列和组合[6]。心房颤动时,MMP-9表达增加可导致心房肌细胞外基质的过度降解,使心房肌细胞对机械牵张抵抗力下降,并易于扩张。Khan等在快速心室起搏诱导的犬的心力衰竭模型中发现,在心力衰竭发展的不同阶段左房、右房压力及左房壁张力指数均显著增高,心力衰竭末期心房肌细胞肥大,心房胶原合成和降解增加,胶原纤维排列紊乱。在心室扩张伴心力衰竭鼠模型心脏中MMP-9活性显著增强。心肌梗死后,移除MMP-9基因的小鼠,左心室的扩张程度明显减低。这是因为MMP-9活性增高导致过度降解细胞外基质,降解正常的胶原蛋白,结果被纤维性间质所取代,造成心肌收缩的协调性减弱,最终导致心室壁变薄和心腔扩张[7]。既往研究发现慢性心力衰竭时MMP-9表达水平增高与以下因素有关:①TIMP的抑制作用。研究表明 MMP-9与TIMP-1关系密切,机理推测TIMP-1可能通过第17-19位的亮氨酸一撷氨酸一异亮氨酸与MMP-9的S1'-S2'-S3'区结合,从而抑制其活性[8]。②细胞外基质金属蛋白酶诱导物(EMMPRIN),把人心肌成纤维细胞暴露于重组的EMMPRIN时,可诱导MMPs的表达[9]。③肾素—血管紧张素—醛固酮系统(RAAS)激活。慢性心力衰竭时,神经内分泌系统的激活,使RAAS活性增高,通过收缩阻力血管维持血压及刺激醛固酮分泌导致水钠潴留,从而维持心输出量和重要器官供血。如果心力衰竭病因不能及时清除,循环中血管紧张素Ⅱ(AngⅡ)水平的持续增高,通过一系列复杂的机制增加MMP-9的表达[10]。
研究发现,TIMP-1的正常表达是维持正常的心脏结构所必需的,TIMP-1基因敲除的大鼠心肌梗死后左室显著扩张,心脏超声显示其左室舒张末容积增加18%,心脏重量增加38%。随心力衰竭加重,心肌TIMP-1 mRNA表达下调。免疫组化发现,心力衰竭末期心肌标本TIMP-1显著下降。另有研究表明TIMP-1可能通过细胞表面的TIMP-1受体起作用,具有抗凋亡促生长的作用。由于TIMP-1的减少,抗凋亡促生长的作用减弱,造成心肌细胞凋亡增加,加重心室重构过程。本试验研究也表明在幼鼠衰竭心脏中TIMP-1表达水平是降低的[11]。
本实验成功建立了充血性心力衰竭幼鼠动物模型,发现与对照组幼鼠相比,心力衰竭组幼鼠心肌中MMP-9、MMP-9/TIMP-1的比值增高,提示MMP-9、TIMP-1表达水平的变化与心室重塑的形成可能有关。本试验研究表明,MMP-9/TIMP-1相互作用的失衡参与了心力衰竭幼鼠心室重塑的发病过程。
[1]Massart PE,Donckier J,Kyselovic J,et al.Carvedilol and lacidipine prevent cardiac hypertrophy and endothelin-1 gene overexpression after aortic banding[J].Hypertension,1999,34:1197 -1201.
[2]Xu Y,Li X,Liu X.Neuregulin-1/ErbB signaling and chronic heart failure[J].Adv Pharmacol,2010,59:31-51.
[3]Das G,Shiras A,Shanmuganandam KC,et al.Rictor regulates MMP-9 activity and invasion through Raf-1-MEK-ERK signaling pathway in glioma[J].cells,2011,50(6):412 -23.
[4]Yang DC,Ma ST,Tan Y,et al.Imbalance of matrix metalloproteinases/tissue inhibitor of metalloproteinase-1 and loss of fibronectin expression in patients with congestive heart failure[J].Cardiology,2010,116(2):133-41.
[5]Lin YH,Lin C,Lo MT,et a1.The relationship between aminoterminal propeptide of type III procollagen and heart rate variability parameters in heart failure patients:a potential serum marker to evaluate cardiac autonomic control and sudden cardiac death[J].Clin Chem Lab Med,2010,48(12):1821 -1827.
[6]Wang WJ,Meng ZL,Mo YC,et a1.,Unloading the infarcted heart affect MMPs-TIMPs axis in a rat cardiac heterotopic transplantation model[J].Mol Biol Rep.2012,39(1):277-283.
[7]Jin YF, HanHC, BergerJ,etal, Combining experimental and mathematical modeling to reveal mechanisms of macrophage-dependent left ventricular remodeling[J].BMC Syst Biol.2011,5(5):60.
[8]Zhou J,Li J.Thrombopoietin protects the brain and improves sensorimotor functions:reduction of strokeinduced MMP-9 upregulation and blood-brain barrier injury[J].J Cereb Blood Flow Metab,2011,31(3):924-33.
[9]吴乐舟,李觉.心力衰竭的诊断进展[J];同济大学学报:医学版,2011,32(2):115-119.
[10]Givvimani S,Tyagi N.MMP-2/TIMP-2/TIMP-4 versus MMP-9/TIMP-3 in transition from compensatory hypertrophy and angiogenesis to decompensatory heart failure[J].Arch Physiol Biochem,2010,116(2):63-72.
[11]Schram K,De Girolamo S,Madani S,et a1.Leptin regulates MMP-2,TIMP-1 and collagen synthesis via p38 MAPK in HL-1 murine cardiomyocytes[J].Cell Mol Biol Lett,2010,15(4):551 -563.
