施其乐对泥鳅外周血红细胞核异常的诱导效应
2012-07-19胡廷尖郝向举王雨辰刘士力
胡廷尖,李 倩,郝向举,王雨辰,刘士力
(1.浙江省淡水水产研究所,浙江湖州 313001;2.全国水产技术推广总站,北京 100026)
施其乐为浙江北部地区主要渔用药,主要成分为戊二醛和苯扎氯铵。戊二醛为养殖鱼类的体表消毒药物,苯扎氯铵是一种阳离子表面活性剂,属非氧化性杀菌剂,主要适用于因水质恶化引起的水霉、出血、肠炎、烂鳃、赤皮等疾病的预防和治疗。生产实践中对施其乐的用量没有具体依据,仅根据经验和建议量使用,缺乏科学依据。国内关于施其乐的研究报道较少,仅王雨辰等[1]进行了施其乐对泥鳅Misgurnus anguillicaudatus水花、夏花苗种的急性毒性的研究,有关施其乐对泥鳅遗传毒性报道还未见报道。
微核测试法是20世纪70年代由HEDDLE(1973)和SCHMID(1975)分别独自创立的一种检测化学物质毒性的常规方法[2]。该方法已经被广泛应用于检测和监察各种理化因子对机体的致癌、致突变效应[3]。泥鳅的血红细胞具核,在外来诱变剂的作用下会出现微核和各种核畸变现象。近年来学者将泥鳅作为研究水体污染的材料,取得较好效果[4-6]。泥鳅在实验室易于饲养,分布广泛,取材容易,易于涂片,且具有较高的敏感性等优点,因而常被用于检测水体的污染情况[7]。因此,可用泥鳅作为评价水体污染和化学物质对水生生物遗传损害及毒理效应的指示生物[8]。
本试验的试验材料为泥鳅,以施其乐建议用量为基础,研究施其乐(规格为20%浓戊二醛溶和5%烃铵盐类)对泥鳅红细胞核异常产生的影响,从细胞遗传学角度探讨施其乐对泥鳅的毒性效应,为研究施其乐对水生动物的毒性提供试验依据,也为合理使用施其乐提供科学依据。
1 材料与方法
1.1 材料
1.1.1 实验动物
泥鳅购于湖州市某农贸市场,选取体重10.0~14.5 g、体长11.0~14.0 cm的健康个体。在曝气的自来水中暂养4 d,实验时选用体重相近、体表无损、健康活泼的个体作为试验材料,试验水温23~28℃。
1.1.2 主要试剂
施其乐购自湖南坤源生物科技有限公司,规格为20%戊二醛+5%烃铵盐类。用蒸馏水配置成100 mg/L的母液,用时稀释成所需浓度。Giemsa染液购自sigma公司,使用前用0.2 mol/L磷酸缓冲液(pH 6.8)稀释10倍。
1.2 方法
1.2.1 试验设计
在预实验的基础上设不同质量浓度施其乐处理组5组,分别为0.2 mg/L、2 mg/L、4 mg/L、6mg/L和8 mg/L(质量浓度依次为建议治疗用量的1、10、20、30和40倍),设对照组1组。实验泥鳅放在装有10 L曝气自来水的水族箱内,设3个重复,暴露时间为4 d。为避免残饵和粪便对实验结果的影响,实验期间不投食,为避免实验期间施其乐浓度的变动,染毒期间不换水。染毒时间为24 h、48 h、72 h和96 h 4个时间段,对照组和实验组各投放20尾泥鳅。
1.2.2 染色和观察
用常规血图片制作方法制片。取试验泥鳅,断尾取血,制成血涂片,自然晾干,用甲醇固定10 min,水洗,晾干,再用磷酸缓冲液(pH 6.8)稀释的Giemsa染液染色15~20 min,水洗,晾干,置于Olympus显微摄影仪下拍照观察。
1.3 统计与分析
每个涂片随机观察3 000个以上的红细胞,记录具有核异常的红细胞数量;核异常细胞率(‰)=具有核异常的细胞总数/观察细胞的总数×1 000‰。
试验数据用SPSS进行t检验,当P<0.05时表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 施其乐对泥鳅外周血红细胞核异常的诱导
泥鳅正常的红细胞呈圆形或椭圆形,本实验中观察到的异常细胞包括微核细胞、核质外凸、核质内凹、细胞形状不规则、膜溶解、无核红细胞、核质断裂等异常情况(图 1)。
2.2 不同浓度施其乐对泥鳅外周血红细胞的影响
由表1可知:对照组泥鳅在实验期间平均核异常率为8.53‰,6 mg/L组平均核异常率最高,为22.46‰,为对 照组平均值的2.63倍。所有处理组中,6 mg/L组在96 h达到峰值(28.326‰)。施其乐均能不同程度地引起泥鳅红细胞核异常的产生,除0.2 mg/L组在24 h和72 h与对照组无显著差异外,其余处理组泥鳅红细胞核异常率和对照组差异显著,其中,高浓度组(4 mg/L、6 mg/L、8 mg/L)达极显著水平。
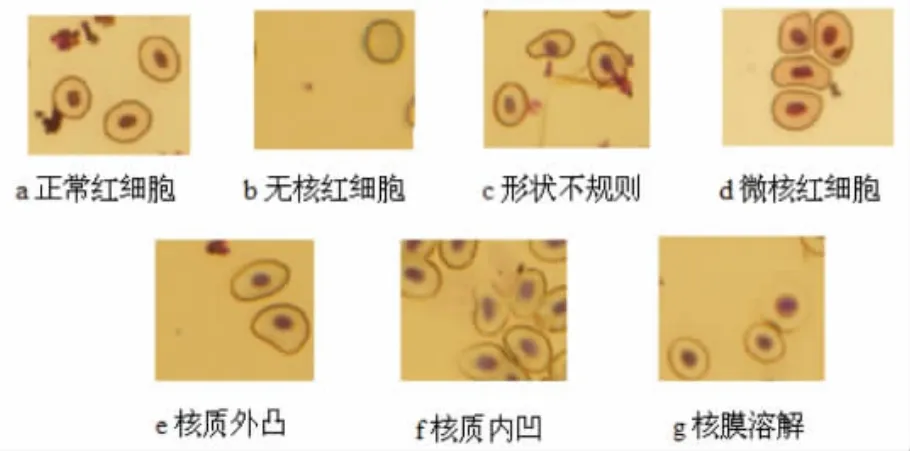
图1 正常红细胞和异常红细胞Fig.1 Normal cell and nuclear abnormalities
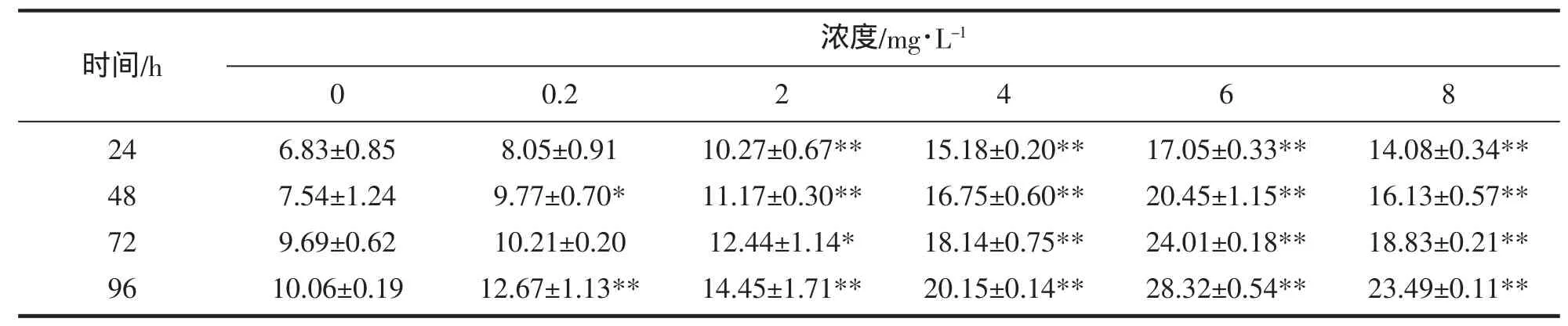
表1 施其乐诱导的泥鳅红细胞核异常(‰)Tab.1 Inducement of glutaraldehyde on abnormal nucleas in loach red blood cells
2.3 不同处理时间对泥鳅外周血红细胞核异常的诱导
由图2可知,在各取样时间点,泥鳅红细胞核异常率随着浓度的升高呈现先升高后降低的趋势,各取样时间点均在6 mg/L达到最大值然后下降;同一浓度处理下,泥鳅红细胞核异常率均随着处理时间的延长而升高,表现为明显的时间-效应关系。方差分析结果表明,各处理组之间差异表现较为复杂,但和对照组相比差异均显著(除0.2 mg/L组在24 h外)。该图表明,6 mg/L浓度组对泥鳅红细胞核异常的诱导最为明显。
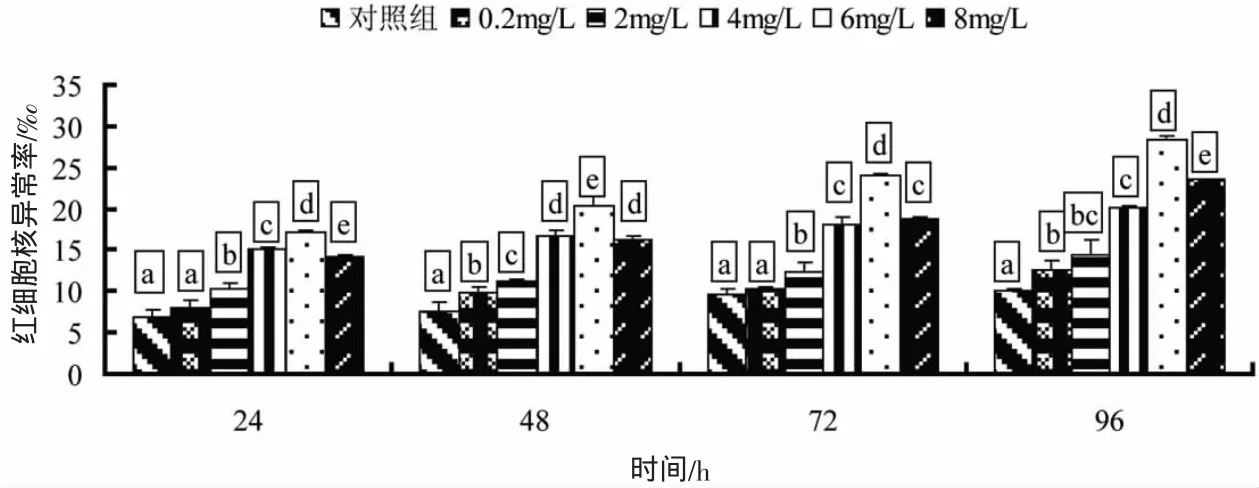
图2 施其乐对泥鳅红细胞核异常的影响Fig.2 The effect of glutaraldehyde on nuclear abnormalities in loach red blood cells
3 讨论
试验结果表明,施其乐均能不同程度地诱导泥鳅红细胞核异常的产生,原因可能是施其乐引起泥鳅红细胞染色体损伤,使染色体断裂、丢失、结构破坏从而形成核异常[9-10]。
各染毒时间段内,泥鳅红细胞核异常率呈现先升高后降低的趋势,在6 mg/L施其乐浓度处理后的取样时间段,核异常达到峰值,8 mg/L反而下降,原因可能有两点:一是核异常变化趋势同浓度范围有一定的相关性,当处理浓度大于某个浓度范围,高剂量的诱变剂会影响、抑制甚至终止细胞正常的分裂活动,导致这些核异常细胞死亡[11-13];二是同泥鳅机体修复能力有关。在开始暴露于高剂量诱变剂施其乐溶液中时,泥鳅对施其乐的适应能力较差,出现明显的跳跃、翻腾、粘液分泌过多和呼吸困难的情况,随着时间的延长,泥鳅的适应能力逐渐增强,机体的调整能力逐渐发挥作用,染色体突变能被机体修复能力修复,从而降低了核异常率[14]。
血液指标是良好的生理、病理和毒理学指标,广泛地用来评价鱼类的健康状况、营养状况及环境适应能力[15-16]。鱼类机体在受到环境胁迫时,外周血细胞特征性指标会出现明显变化,如数量、形态、遗传特性等[17]。本实验最低处理浓度为建议用量,高于建议用量时均能引起泥鳅红细胞核异常率的升高,且高浓度组的泥鳅随着时间的增加有个别泥鳅死亡,结合试验结果来看,施其乐虽为常用渔药之一,但在使用时要严格用量,要在安全使用浓度内,对使用方法和事项严格规范,超出一定的范围会引起泥鳅的遗传损伤,避免污染养殖水体。
本研究中的核异常率与施其乐质量浓度具有一定的正相关关系,在72 h内各处理组微核率均随着施其乐浓度的升高而增加,表明以核异常率作为施其乐胁迫下泥鳅红细胞毒害程度的指标具有可行性。核异常率在施其乐质量浓度4 mg/L时与对照组出现极显著差异,表明此质量浓度对染色体、细胞核的破坏作用已经明显。可将4 mg/L施其乐质量浓度作为发生遗传损伤的阈值,在生产实践中使用时建议用量在4 mg/L以下。
[1]王雨辰,胡廷尖,刘士力,等.混力康与施其乐对泥鳅水花、夏花苗种的急性毒性试验[J].齐鲁渔业,2010,27(12):10-11.
[2]杜启艳,李宁宁,崔俊丽,等.柠檬黄对大鳞副泥鳅的急性毒性及遗传毒性实验[J].水生态学杂志,2009,2(3):81-84.
[3]谢志浩,李 骏,平 波,等.四种除草剂对泥鳅红细胞遗传毒性的研究[J].应用与环境生物学报,2003,9(4):412-416.
[4]吴若箐,吴惠平,杜惠东.亚硫酸氢钠对泥鳅红细胞微核和核变形的诱导[J].福建师范大学学报:自然科学版,2006,22(2):85-88.
[5]钱晓薇,南旭阳,许成武,等.三氧化二砷对黄鳝外周血红细胞微核的影响[J].中国公共卫生,2004,20(10):1 205-1 206.
[6]田志环,付荣恕.废旧于电池对泥鳅的致毒作用[D].济南:山东师范大学,2006.
[7]李宁宁,党炳俊,杜启艳,等.有机融雪剂对泥鳅的急性毒性以及红细胞微核研究[J].湖北农业科学,2009,48(9):2 224-2 226.
[8]徐士霞,李旭东,王跃招.两栖动物在水体污染生物监测中作为指示生物的研究概况[J].动物学杂志,2003,38(6):110-114.
[9]范宇哲,徐仕霞,姚春生,等.应用蝌蚪快速检测环境变异的两种方法-微核试验和单细胞凝胶电泳[J].四川动物,2004(1):74-76.
[10]张晓红,张虎芳,孟紫强.三种洗衣粉对泥鳅红细胞微核形成和核异常的影响[J].山西大学学报:自然科学版,2008,31(1):124-127.
[11]吴美仙.除草剂克芜踪对泥鳅红细胞核异常的诱导效应[J].宿州师专学报,2004,19(1):94-96.
[12]谢志浩,蔡亚非,陈 国,等.四种除草剂对泥鳅红细胞微核及核异常诱导[J].水产科学,2004,23(6):17-19.
[13]耿德贵,王秀琴,刘士旺,等.除草剂使它隆对黄鳝细胞的致突变作用研究[J].环境与健康杂志,2000(2):103-105.
[14]金焕荣,段志文,张 越,等.阿特拉津的遗传毒性研究[J].工业卫生与职业病,1999,25(6):341-343.
[15]张 民,顾宇飞,顾 颖,等.低浓度五氯酚对鲫鱼血液细胞毒性的外体研究[J].环境化学,2005,24(3):302-306.
[16]周 玉.鱼类血液指标研究的进展[J].上海水产大学学报,2001,10(2):163-165.
[17]任培丽,张迎梅,耿广琴,等.污染水域鲫鱼外周血细胞形态和数量的变化[J].动物学杂志,2008,43(2):37-42.
